



高中化学人教版 (2019)选择性必修2第二节 原子结构与元素的性质精品课件ppt
展开1.通过对元素周期表发展史的了解,认识科学家对元素周期表经历的探索过程,培养科学态度与社会责任的核心素养。2.认识元素周期表的基本结构,了解元素周期律、元素周期系与元素周期表之间的关系。3.能从原子价电子数目和价电子排布的角度解释元素周期表的分区、周期和族的划分,促进对“位置”与“结构” 关系的理解。
1869年,门捷列夫发现,按相对原子质量从小到大的顺序将元素排列起来,得到一个元素序列,并从最轻的元素氢开始进行编号,称为原子序数。这个序列中的元素性质随着原子序数递增发生周期性的重复,这一规律被门捷列夫称作元素周期律。
1913年,英国物理学家莫塞莱证明原子序数即原子核电荷数。随后元素周期律表述为元素的性质随元素原子的核电荷数递增发生周期性递变。元素的这一按其原子核电荷数递增排列的序列称为元素周期系。
原子序数=核电荷数=质子数
一、原子结构与元素周期表
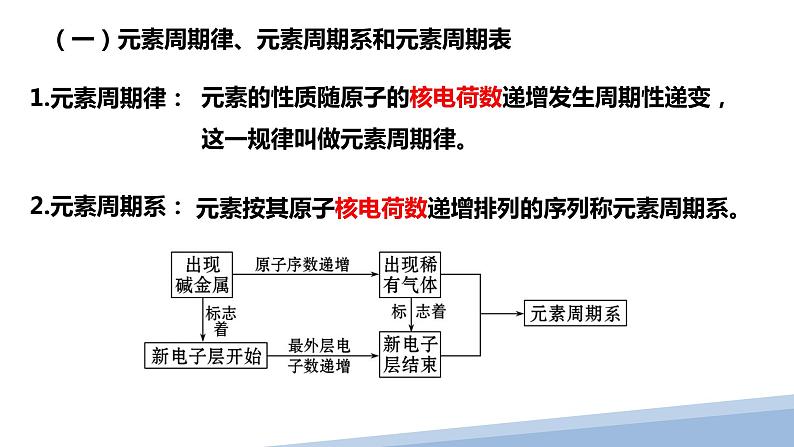
元素的性质随原子的核电荷数递增发生周期性递变,这一规律叫做元素周期律。
元素按其原子核电荷数递增排列的序列称元素周期系。
(一)元素周期律、元素周期系和元素周期表
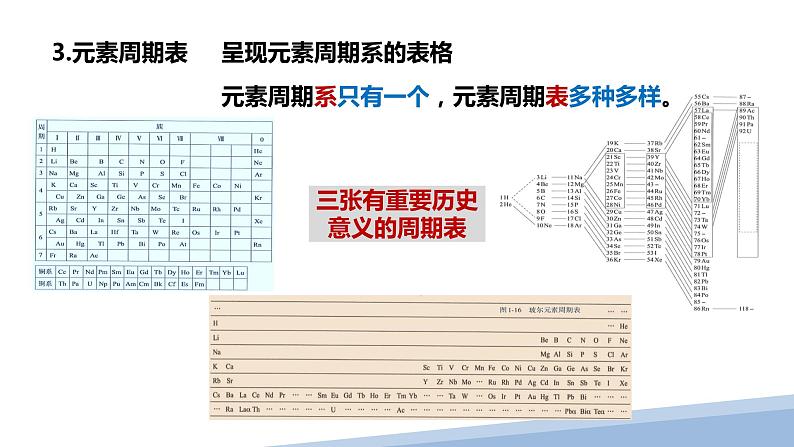
三张有重要历史意义的周期表
元素周期系只有一个,元素周期表多种多样。
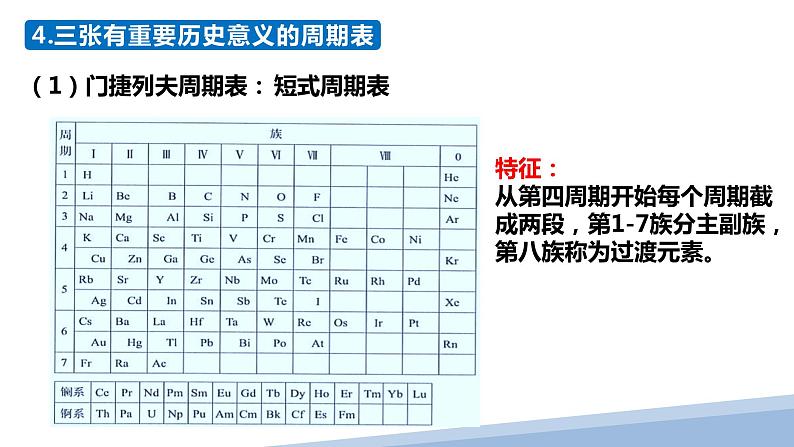
特征:从第四周期开始每个周期截成两段,第1-7族分主副族,第八族称为过渡元素。
(1)门捷列夫周期表:
4.三张有重要历史意义的周期表
特征:确定了前五周期的元素种类 Be、Mg的位置与现今周期表不同
(2)维尔纳的特长式周期表:
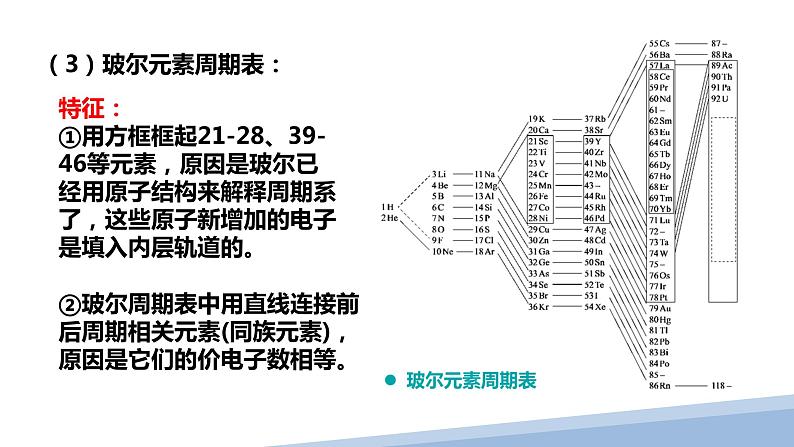
(3)玻尔元素周期表:
特征:①用方框框起21-28、39-46等元素,原因是玻尔已经用原子结构来解释周期系了,这些原子新增加的电子是填入内层轨道的。
②玻尔周期表中用直线连接前后周期相关元素(同族元素),原因是它们的价电子数相等。
1.元素周期表共有几个周期、几个主族、几个副族?2.Ⅷ族在元素周期表中占几列?
短周期:3个(第1、2、3周期)长周期:4个(第4、5、6、7周期)
主族:7个副族:7个VIII :1个(3列)零族:1个
周期序数=电子层数 主族序数=最外层电子数
第一周期:从 开始,以 结束
其余各周期:从 能级开始,以 能级结束
(n=周期序数=电子层数)
(二)构造原理与元素周期表
1~36号元素的基态原子的价层电子排布式
2.原子核外电子排布与周期的关系
1s→2s→2p→3s→3p→4s→3d→4p→5s→4d→5p→6s→4f→5d→6p→7s→5f→6d→7p
若将p段与p段对齐,d段与d段对齐、f段单独列出,将1s2与p段末端对齐,则得到书末的元素周期表
如何将下图变成书末的元素周期表?
1、元素周期表共有几个周期?每个周期有多少种元素?
为什么第一周期结尾元素的电子排布跟同族的其他周期元素的不同?
2、元素周期表共有多少列?各列的价层电子数各为多少?同列元素价层电子数是否相等?
元素周期表可分为哪些族?族序有什么规律?
2,8,8,18,18,32,32
只有一个电子层,能级只有1s能级
Ⅰ~ⅦA族、Ⅰ~ⅦB 和Ⅷ、0族
3.主族元素和副族元素的价层电子排布:
结论:同主族元素原子的价层电子排布完全相同,价层电子全部排布在ns或 ns 、np轨道上。价层电子数与族序数相同。
主族元素的价层电子排布式、价层电子数
副族元素的价层电子排布式、价层电子数(以第四周期为例):
结论:副族元素同一纵列原子的价层电子排布基本相同,价层电子排布为(n-1)d1~10ns1~2。第ⅢB~ⅦB族的价层电子数与族序数相同,第ⅠB族、ⅡB族价层电子数与族序数不同。
价层电子:(n-1)d6~8ns2
价层电子:ns2或ns2np6
三个纵行(8、9、10),位于Ⅶ B 与ⅠB中间
【补充】对价电子的认识:(1)主族元素:主族序数=价电子数=最外层电子数=最高正价(O、F除外)。(2)副族元素:ⅢB-ⅦB:族序数 = 价层电子数=最高正价 ⅠB-ⅡB:族序数 = 最外层电子数(3)第Ⅷ族中元素的价电子排布不相同。
(1)除短周期外,其他周期均有18种元素 ( )(2)每一周期都是碱金属元素开始,稀有气体元素结束。( )(3)元素周期表有7个横行,即7个周期;有18个纵列,即18个族。 ( )(4)价电子数与最高化合价相等的元素一定是主族元素 ( )(5)次外层全充满而最外层有不成对电子的元素一定是主族元素 ( )(6)主族元素的原子价电子层排布都含s,但都不含d ( )
课堂练习1:判断正误(正确的打“√”,错误的打“×”)
课堂练习2:下列关于原子核外电子排布与元素在周期表中位置关系的叙述中,正确的是( )A.原子价电子排布为ns2np1~6的元素一定是主族元素B.基态原子最外电子层的p能级上有5个电子的元素一定是第ⅦA族元素C.原子的价电子排布为(n-1)d6~8ns2的元素一定位于第ⅢB~ⅦB族D.基态原子N能层上只有1个电子的元素一定是主族元素
电子填充的最后一个能级是s能级
电子填充的最后一个能级是p能级
电子填充的最后一个能级是d能级
按电子排布,把周期表里的元素划分成5个区—— s区、p区、d区、ds区、f区。除ds区外,区的名称来自按构造原理最后填入电子的能级符号
4.元素周期表中的分区
除H外,其余为活泼金属
除H外,所有非金属元素都在p区
均为金属元素,性质相似
均为金属元素,结构相似
(2) 为什么s区(H除外)、d区、ds区的元素都是金属元素?
最外层电子数为1~2个( 始终不超过2 ),即为ns1-2(Pd例外),容易失去电子(H除外)
(3) 处于非金属与金属分界线上的元素常被称为半金属或类金属,为什么?
处于非金属与金属分界线上的元素:既能表现出一定的非金属性,又能表现出一定的金属性
(4) Cr和Cu的价层电子排布符合构造原理么?还有哪些不符合?
Nb、M、Ru、Pd、Ag、Pt、Au等
(5) 预言119号元素基态原子最外层电子排布,并预测第八周期有多少种元素。
价层电子填入的能级顺序:
8s → 5g → 6f → 7d → 8p
2 + 18 + 14 + 10 + 6 = 50 种
某些主族元素与其右下方的主族元素(如图)的有些性质是相似的。
锂和镁:在过量的氧气中燃烧均生成正常氧化物,而不是过氧化物
处于“对角线”位置的元素,它们的性质具有相似性。
b.在过量的氧气中燃烧均生成正常氧化物,而不是过氧化物,并且Li2O和MgO与水反应都十分缓慢。
a.锂与镁的沸点较为接近:
b.氧化物和氢氧化物都具有两性:
既能溶于强酸又能溶于强碱溶液
Al(OH)3+3HCl=AlCl3+3H2O,Al(OH)3+NaOH=NaAlO2+2H2O
Be(OH)2+2HCl=BeCl2+2H2O,Be(OH)2+2NaOH=Na2BeO2+2H2O
c.BeCl2和AlCl3都是共价化合物,易升华。
a.二者的氧化物Al2O3和BeO的熔点和硬度都很高
a.自然界中B与Si均以化合物的形式存在。
b.B与Si的单质都易与强碱反应,且不与稀酸反应:
2B+2KOH+2H2O = 2KBO2+3H2↑,
Si+2KOH+H2O= K2SiO3+2H2↑
c.B和Si的含氧酸都是弱酸
元素周期表、元素周期系、元素周期律
元素性质随着__________递增发生周期性的重复
元素按原子__________递增排列的序列
周期序数=基态原子的能层数
某些主族元素与其右下方的主族元素有些性质是相似的。
ⅢB-ⅦB:族序数 = 价层电子数
ⅠB-ⅡB:族序数 = 最外层电子数
Ⅰ A-ⅦA:族序数 = 价层电子数
课堂练习3:若某原子的价层电子排布式为4d15s2,则下列说法正确的是( )A.该元素位于周期表中第五周期第ⅢB族B.该元素原子价层电子数为2C.该元素为非金属元素D.该元素原子N能层共有8个电子
课堂练习4:已知某元素基态原子的价电子排布为(n-1)dansb(a、b均为大于0的正整数),下列有关说法正确的是( )A.该元素一定位于元素周期表中的d区 B.该元素一定位于元素周期表中的ds区C.该元素的族序数为a+b D.该元素一定为金属元素
课堂练习5:下列有关元素周期表的说法中不正确的是( )A.位于元素周期表ⅡA族左边的元素一定属于主族元素B.氯元素位于元素周期表中第三周期ⅦA族C.元素周期表中ⅢB族到ⅡB族10个纵行的元素都是金属元素D.目前使用的元素周期表中,包含元素种类最多的族为ⅥA
课堂练习6:下列关于元素在元素周期表中的位置以及元素原子的价层电子排布特点的有关叙述正确的是( )A.Cu位于元素周期表中第四周期第ⅠB族,属于ds区元素B.O的基态原子中,2p能级为半充满,属于p区元素C.最外层电子排布式为4s1,一定属于第ⅠA族D.最外层电子排布式为ns2np1,该元素可能是第ⅢA族或第ⅢB族
高中化学人教版 (2019)选择性必修2第二节 分子的空间结构完美版课件ppt: 这是一份高中化学人教版 (2019)选择性必修2<a href="/hx/tb_c4002447_t3/?tag_id=26" target="_blank">第二节 分子的空间结构完美版课件ppt</a>,共26页。PPT课件主要包含了学习目标,分子结构的测定,红外光谱,质谱法1原理,最常见的是四面体形等内容,欢迎下载使用。
人教版 (2019)选择性必修2第一章 原子结构与性质第二节 原子结构与元素的性质精品课件ppt: 这是一份人教版 (2019)选择性必修2<a href="/hx/tb_c4002443_t3/?tag_id=26" target="_blank">第一章 原子结构与性质第二节 原子结构与元素的性质精品课件ppt</a>,共44页。PPT课件主要包含了元素周期律,PCl3,NH3,NF3,NaAlH4,NaBH4,电负性相近等内容,欢迎下载使用。
高中化学人教版 (2019)选择性必修2第一节 原子结构优秀ppt课件: 这是一份高中化学人教版 (2019)选择性必修2<a href="/hx/tb_c4002442_t3/?tag_id=26" target="_blank">第一节 原子结构优秀ppt课件</a>,共37页。PPT课件主要包含了学习目标,思考与讨论,电子云,2注意,电子云轮廓图,原子轨道,轨道数,哑铃形,小结原子轨道的特点,电子自旋等内容,欢迎下载使用。













