高三化学复习知识清单(通用版) 知识清单29 原子结构与性质
展开【知识归纳】
一、人类对原子结构认识的演变
二、核外电子运动状态的形象描述
1.电子云图
(1)含义:形象描述核外电子在空间出现的概率大小
(2)小黑点:表示电子在某一时刻曾在此处出现一次
(3)小黑点疏密程度:表示电子出现的概率大小
①离核近的地方,小黑点密,电子云密度大,电子出现的概率大
②离核远的地方,小黑点疏,电子云密度小,电子出现的概率小
(4)氢原子的电子云呈球形对称
2.能层(n):(又称:电子层)
3.原子轨道(又称:能级、电子亚层)
4.构造原理示意图
5.1~36号元素的能层和能级
(1)K层:有1s一个电子亚层
(2)L层:有2s、2p两个电子亚层
(3)M层:有3s、3p、3d三个电子亚层
(4)N层:有4s、4p、4d、4f四个电子亚层
6.电子能量高低的比较
三、原子核外电子排布
1.原子核外电子排布的原理
(1)能量最低原理:电子尽先排布在能量最低的轨道中。
(2)泡利不相容原理:每个原子轨道上最多只能容纳2个自旋方向相反的电子。如:
(3)洪特规则:电子在能量相同原子轨道上排布时,应尽可能分占不同的轨道而且自旋方向相同。
(4)洪特规则特例:能量相同的原子轨道在下列情况时,体系能量最低
①全满;即s2、p6、d10
②半满;即s1、p3、d5
③全空;即s0、p0、d0
2.基态原子核外电子排布
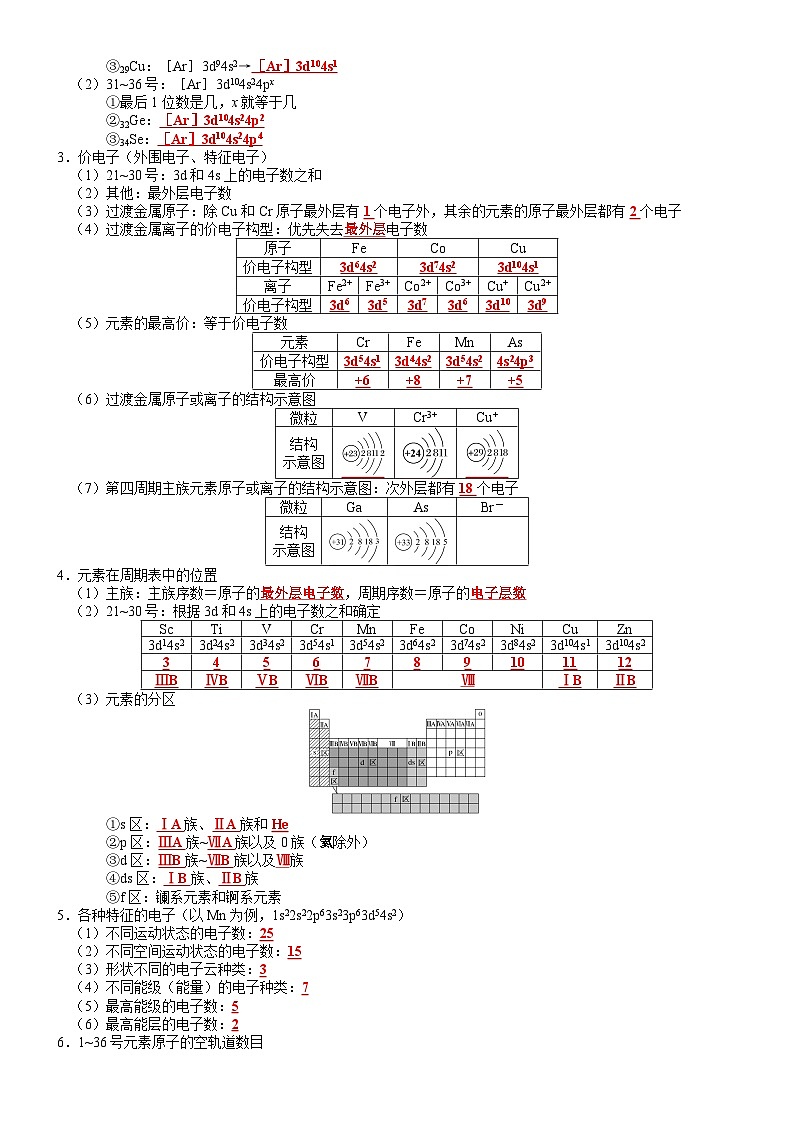
(1)21~30号:[Ar]3dx4s2
①一般最后1位数是几,x就等于几
②24Cr:[Ar]3d44s2→[Ar]3d54s1
③29Cu:[Ar]3d94s2→[Ar]3d104s1
(2)31~36号:[Ar]3d104s24px
①最后1位数是几,x就等于几
②32Ge:[Ar]3d104s24p2
③34Se:[Ar]3d104s24p4
3.价电子(外围电子、特征电子)
(1)21~30号:3d和4s上的电子数之和
(2)其他:最外层电子数
(3)过渡金属原子:除Cu和Cr原子最外层有1个电子外,其余的元素的原子最外层都有2个电子
(4)过渡金属离子的价电子构型:优先失去最外层电子数
(5)元素的最高价:等于价电子数
(6)过渡金属原子或离子的结构示意图
(7)第四周期主族元素原子或离子的结构示意图:次外层都有18个电子
4.元素在周期表中的位置
(1)主族:主族序数=原子的最外层电子数,周期序数=原子的电子层数
(2)21~30号:根据3d和4s上的电子数之和确定
(3)元素的分区
①s区:ⅠA族、ⅡA族和He
②p区:ⅢA族~ⅦA族以及0族(氦除外)
③d区:ⅢB族~ⅦB族以及Ⅷ族
④ds区:ⅠB族、ⅡB族
⑤f区:镧系元素和锕系元素
5.各种特征的电子(以Mn为例,1s22s22p63s23p63d54s2)
(1)不同运动状态的电子数:25
(2)不同空间运动状态的电子数:15
(3)形状不同的电子云种类:3
(4)不同能级(能量)的电子种类:7
(5)最高能级的电子数:5
(6)最高能层的电子数:2
6.1~36号元素原子的空轨道数目
7.1~36号元素原子的未成对电子数(n)
(1)n=1:ns1(4)、ns2np1(3)、ns2np5(3)、3d14s2(1)、3d104s1(1),共12种
(2)n=2:ns2np2(3)、ns2np4(3)、3d24s2(1)、3d84s2(1),共8种
(3)n=3:ns2np3(3)、3d34s2(1)、3d74s2(1),共5种
(4)n=4:3d64s2(1),共1种
(5)n=5:3d54s2(1),共1种
(6)n=6:3d54s1(1),共1种
8.基态原子核外电子排布的表示方法(以铁原子为例)
(1)各类要求的电子排布式
①电子排布式:1s22s22p63s23p63d64s2
②简化电子排布式:[Ar]3d64s2
③价电子(外围电子、特征电子)排布式:3d64s2
④最外层电子排布式:4s2
⑤M层电子排布式:3s23p63d6
⑥最高能级电子排布式:3d6
(2)各类要求的电子排布图
①电子排布图:
②轨道表示式:
③价电子排布图:
④原子结构示意图:
四、原子光谱
1.电子的跃迁
(1)基态电子:处于最低能量的电子
(2)激发态电子:能量比基态电子高的电子
(3)电子跃迁
3.原子光谱:电子跃迁时会吸收或释放不同的光形成的谱线
(1)测量光谱仪器:光谱仪
(2)光谱图上数据:波长
(3)光谱类型:线状光谱
①发射光谱:1s22s22p63s23p34s1→1s22s22p63s23p4
②吸收光谱:1s22s22p3→1s22s22p13s2
(4)解释原子发光现象
①在××条件,基态电子吸收能量跃迁到激发态
②由激发态跃迁回基态过程中,释放能量
③释放的能量以××可见光的形式呈现
(5)可见光的波长(λ)和能量(E)
①公式:E=hv,c(光速)=λv
②颜色和波长的关系
五、电离能大小的比较及应用
1.概念:气态原子或离子失去1个电子所需要的最小能量
(1)第一电离能(I1):M(g)-e-=M+(g)
(2)第二电离能(I2):M+(g)-e-=M2+(g)
(3)第n电离能(In):M(n-1)+(g)-e-=Mn+(g)
2.同一原子各级电离能
(1)变化规律:I1<I2<I3<…
(2)变化原因
①电子分层排布
②各能层能量不同
3.第一电离能变化规律
(1)根据递变规律判断
①基本规律:周期表右上角位置的He原子的I1最大
②特殊规律:同一周期中I1,ⅡA>ⅢA;ⅤA>ⅥA
(2)根据金属性判断
①基本规律:I1越小,金属性越强,注意ⅡA和ⅤA族元素的特殊性
②金属元素和非金属元素的I1:I1(金属)<I1(非金属)
(3)根据微粒结构判断
①稳定结构微粒的I大:全满、半满和全空状态稳定
②I(全满)>I(半满)
③判断:I1(Cu)<I1(Ni),I2(Cu)>I2(Zn)
4.各级电离能数据的应用
(1)判断元素价态:In+1≫In,最高正价为+n
(2)判断某一级电离能最大:第n级电离能最大,说明其最高正价为+(n-1)价
(3)判断电离能的突增点:形成相应电子层最稳定状态后再失去1个电子
六、电负性
1.意义:衡量元素的原子在化合物中得电子能力
2.递变规律
(1)周期表右上角氟元素的最大
(2)电负性大小
①电负性最大的前三种元素:F>O>N
②氢元素的电负:C>H>B;P>H>Si
3.其他判断方法
(1)根据共用电子对的偏向判断:偏向一方元素的电负性大
(2)化合物中化合价的正负判断:显负价元素的电负性大
(3)根据元素的非金属性判断
①最高价氧化物对应水化物的酸性越强,电负性越大
②单质与氢气越容易化合,电负性越大
③气态氢化物越稳定,电负性越大
4.判断元素的属性
5.判断化合物的类型
(1)差值:|△X|>1.7,离子化合物
(2)差值:|△X|<1.7,共价化合物
6.根据电负性写水解方程式
(1)水解原理
①电负性大的原子显负价,结合水中的H+
②电负性小的原子显正价,结合水中的OH-
(2)实例
①BrI:IBr+H2OHIO+HBr
②NCl3:NCl3+3H2ONH3+3HClO
七、微粒半径的比较(以短周期为例)
1.相同电性微粒半径大小的比较
(1)原子半径:左下角的钠最大
(2)阳离子半径:左下角的钠离子最大
(3)阴离子半径:左下角的磷离子最大
2.不同电性微粒半径大小的比较
(1)同周期:阴离子半径>阳离子半径,如Na+<Cl-
(2)同元素:电子数越多,微粒半径越大,如Fe2+>Fe3+
(3)同结构:质子数越多,离子半径越小,如Na+<O2-
八、原子结构推断常用的突破口
1.1~36号原子结构的特殊点
(1)未成对电子数最多的元素原子是:Cr(3d54s1,6个)
(2)未成对电子数最多的短周期元素的原子是:N、P(ns2np3,3个)
(3)空轨道数最多的原子是:Sc(3d14s2,4个)
2.1~36号原子结构推断题常见的突破口
(1)2p能级有一个未成对电子的基态原子是:B(2s22p1)或F(2s22p5)
(2)3p能级上有两个未成对电子的元素原子是:Si(3s23p2)或S(3s23p4)
(3)M层上有一个半充满的能级的主族元素原子是:Na(3s1)或P(3s23p3)
(4)M层上有一个半充满的能级的元素原子是:K(3d04s1)或Cr(3d54s1)或Cu(3d104s1)
(5)N层上有一个半充满的能级的元素原子是:Sc(3d14s2)或Mn(3d54s2)
(6)+1价阳离子中所有电子正好充满K、L、M三个电子层的离子:Cu+(1s22s22p63s23p63d10)
(7)基态原子中s电子数比p电子数多1的元素:N(1s22s22p3)
(8)原子的最外层中p亚层电子数等于前一电子层电子总数的主族元素的原子:O(1s22s22p4)
(9)基态原子电子占据三种能量不同的原子轨道且每种轨道中的电子总数相同的短周期元素:C(1s22s22p2)
(10)基态原子占据两种形状的原子轨道,且两种形状轨道中的电子总数均相同的短周期元素:O(1s22s22p4)
(11)基态原子核外成对电子数是成单电子数的3倍的短周期元素:O(1s22s22p4)
(12)元素原子核外电子仅有一种原子轨道的短周期元素:H(1s1)或He(1s2)
(13)元素的原子核外所有p轨道半满的短周期元素:N(1s22s22p3)
(14)原子的L电子层中,成对电子与未成对电子占据的轨道数相等,且无空轨道的短周期元素:O(1s22s22p4)
(15)正三价离子的3d亚层为半充满的元素:Fe(3d64s2)
(16)基态原子的4s能级中只有1个电子的元素:K(3d04s1)或Cr(3d54s1)或Cu(3d104s1)
(17)M层中只有两对成对电子的元素:S(3s23p4)
分层依据
按照电子的能量差异、运动区域离核的远近
各层取值(n)
1
2
3
4
5
6
7
能层符号
K
L
M
N
O
P
Q
能量高低
能量依次升高
离核远近
离核逐渐变远
轨道符号
s
p
d
f
电子云形状
(轨道形状)
球形
纺锤形或哑铃形
花瓣形
形状较复杂
轨道个数
1
3
5
7
空间伸展方向个数
1
3
5
7
错误
正确
N原子的2p轨道
原子
Fe
C
Cu
价电子构型
3d64s2
3d74s2
3d104s1
离子
Fe2+
Fe3+
C2+
C3+
Cu+
Cu2+
价电子构型
3d6
3d5
3d7
3d6
3d10
3d9
元素
Cr
Fe
Mn
As
价电子构型
3d54s1
3d44s2
3d54s2
4s24p3
最高价
+6
+8
+7
+5
微粒
V
Cr3+
Cu+
结构
示意图
微粒
Ga
As
Br-
结构
示意图
Sc
Ti
V
Cr
Mn
Fe
C
Ni
Cu
Zn
3d14s2
3d24s2
3d34s2
3d54s1
3d54s2
3d64s2
3d74s2
3d84s2
3d104s1
3d104s2
3
4
5
6
7
8
9
10
11
12
ⅢB
ⅣB
ⅤB
ⅥB
ⅦB
Ⅷ
ⅠB
ⅡB
空轨道数
价电子构型
元素种类
1
ns2np2(3)
3
2
ns2np1(3)、3d34s2(1)
4
3
3d24s2(1)
2
4
3d14s2(1)
1
元素
Li
Be
B
C
N
O
F
Ne
I1大小
⑧
⑥
⑦
⑤
③
④
②
①
元素
原子
突增点的电离能级数
第一次
第二次
第三次
P
I6
I14
Ca
I3
I11
I19
高三化学复习知识清单(通用版) 知识清单03 离子反应: 这是一份高三化学复习知识清单(通用版) 知识清单03 离子反应,共7页。学案主要包含了电解质和非电解质,电解质的电离,离子反应,离子方程式的正误判断,离子反应和离子共存等内容,欢迎下载使用。
高三化学复习知识清单(通用版) 知识清单01 物质的量: 这是一份高三化学复习知识清单(通用版) 知识清单01 物质的量,共8页。学案主要包含了基本公式及关系式,容量瓶的使用,配制一定浓度的溶液,阿佛加德罗常数的判断等内容,欢迎下载使用。
高三化学复习知识清单(通用版) 知识清单32 化学实验基础: 这是一份高三化学复习知识清单(通用版) 知识清单32 化学实验基础,共11页。学案主要包含了知识网络,知识归纳,方法技巧等内容,欢迎下载使用。