



专题二 物质结构与性质 选择题专攻 2.元素“位—构—性”关系的分析应用课件-2024年高考化学二轮复习
展开1.原子结构与元素的性质
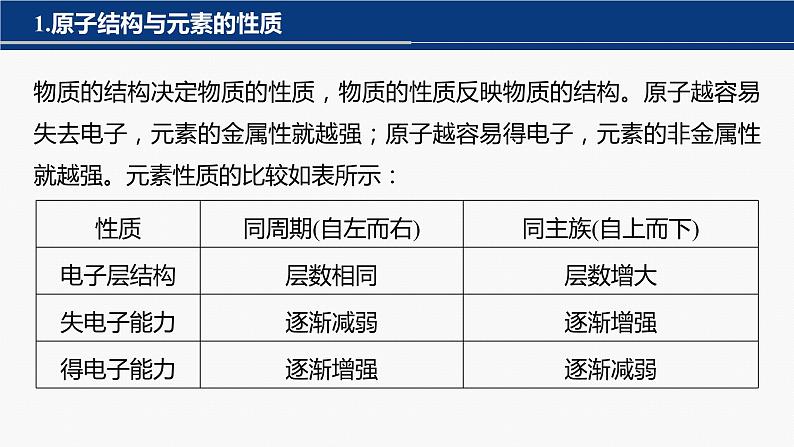
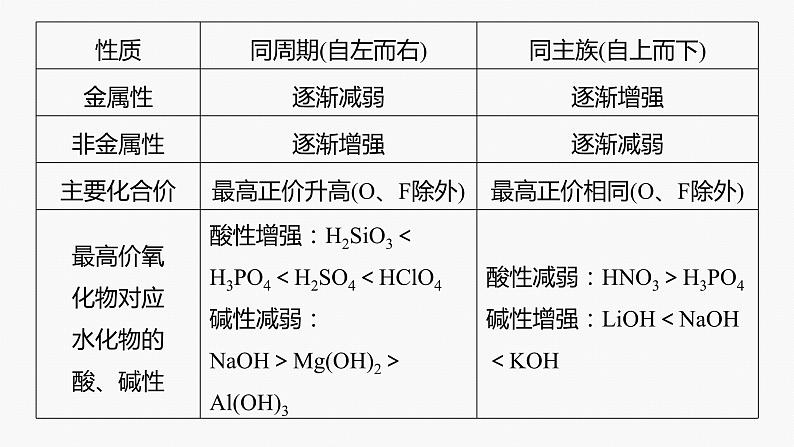
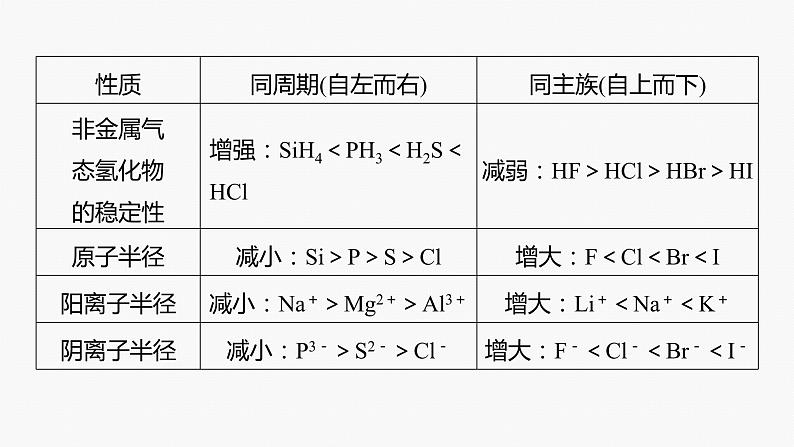
物质的结构决定物质的性质,物质的性质反映物质的结构。原子越容易失去电子,元素的金属性就越强;原子越容易得电子,元素的非金属性就越强。元素性质的比较如表所示:
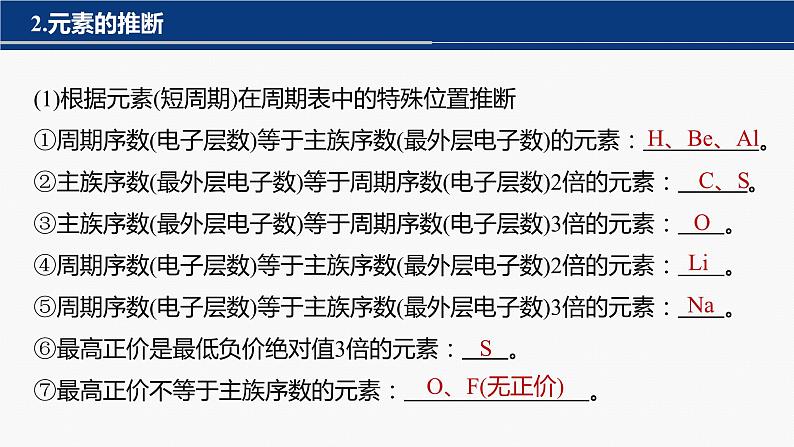
(1)根据元素(短周期)在周期表中的特殊位置推断①周期序数(电子层数)等于主族序数(最外层电子数)的元素: 。②主族序数(最外层电子数)等于周期序数(电子层数)2倍的元素: 。③主族序数(最外层电子数)等于周期序数(电子层数)3倍的元素: 。④周期序数(电子层数)等于主族序数(最外层电子数)2倍的元素: 。⑤周期序数(电子层数)等于主族序数(最外层电子数)3倍的元素: 。⑥最高正价是最低负价绝对值3倍的元素: 。⑦最高正价不等于主族序数的元素: 。
⑧短周期中原子半径最小的元素: 。⑨短周期中原子半径最大的元素: 。⑩W与X是同主族的短周期元素,X的原子序数是W的2倍, 。⑪最高正价与最低负价代数和为6的元素: 。⑫最高正价与最低负价代数和为4的元素: 。⑬最高正价与最低负价代数和为2的元素: 。⑭最高正价与最低负价代数和为0的元素: 。
(2)根据金属性、非金属性推断①短周期中金属性最强的元素: 。②非金属性最强的元素: 。③常见的半导体材料: 。(3)根据含量推断①空气中含量最多的元素: 。②地壳中含量最多的元素: 。③地壳中含量最多的金属元素: 。
(4)根据特殊性质推断①既能与强酸反应又能与强碱反应的常见物质: 。②形成化合物种类最多、其单质是硬度最大的物质的元素: 。③气态氢化物溶于水显碱性的元素: 。④密度最小的气体: 。⑤气态氢化物能和它的氧化物在常温下反应生成该元素的单质的元素: 。
Al、Al2O3、Al(OH)3、
⑥气态氢化物和其最高价氧化物对应的水化物能反应生成离子化合物的元素: 。⑦同主族并且能够形成离子化合物的元素: 。⑧同周期的三种元素,最高价氧化物对应水化物两两之间反应生成盐和水: 。
Na、Al、S(或Cl)
(1)熟记主族元素的价层电子排布式ⅠA:ns1 ⅡA:ns2 ⅢA:ns2np1 ⅣA:ns2np2ⅤA:ns2np3 ⅥA:ns2np4 ⅦA:ns2np5(2)掌握第四周期副族元素的价层电子排布式Sc:3d14s2 Ti:3d24s2 V:3d34s2 Cr:3d54s1Mn:3d54s2 Fe:3d64s2 C:3d74s2Ni:3d84s2 Cu:3d104s1 Zn:3d104s2
4.认识几种含氧酸的结构
1.(2021·江苏,5)前4周期主族元素X、Y、Z、W的原子序数依次增大,X是空气中含量最多的元素,Y的周期序数与族序数相等,基态时Z原子3p原子轨道上有5个电子,W与Z处于同一主族。下列说法正确的是A.原子半径:r(X)
Y的最高价氧化物对应水化物的酸性比Z的弱,即酸性:Al(OH)3<HClO4,故C错误;同主族元素从上到下,非金属性逐渐减弱,简单氢化物的稳定性逐渐减弱,所以Z的简单气态氢化物的热稳定性比W的强,故D错误。
2.(2023·浙江1月选考,10)X、Y、Z、M、Q五种短周期元素,原子序数依次增大,X的2s轨道全充满,Y的s能级电子数量是p能级的两倍,M是地壳中含量最多的元素,Q是纯碱中的一种元素。下列说法不正确的是A.电负性:Z>XB.最高正价:Z
Y的s能级电子数量是p能级的两倍,Y为C,X的2s轨道全充满,原子序数:X
3.(2023·浙江6月选考,11)X、Y、Z、W四种短周期主族元素,原子序数依次增大。X、Y与Z位于同一周期,且只有X、 Y元素相邻。X基态原子核外有2个未成对电子,W原子在同周期中原子半径最大。下列说法不正确的是A.第一电离能:Y>Z>XB.电负性:Z>Y>X>WC.Z、W原子形成稀有气体电子构型的简单离子的半径:W
由题给信息分析知,E为O,Y为N,Z为H,M为P,X为Mg。元素电负性:O>N>H,A正确;氢化物沸点:H2O>NH3>PH3,B错误;第一电离能:N>O>Mg,C错误;NH3价层电子对数为4,有1个孤电子对,空间结构为三角锥形,价层电子对数为3,没有孤电子对,空间结构为平面三角形,D错误。
5.(2023·湖北,6)W、X、Y、Z为原子序数依次增加的同一短周期元素,其中X、Y、Z相邻,W的核外电子数与X的价层电子数相等,Z2是氧化性最强的单质,4种元素可形成离子化合物(XY)+(WZ4)-。下列说法正确的是A.分子的极性:WZ3
由题干分析知,W为H,X为C,Y为O,Z为F,Q为Al。
1.(2023·南通市高三下学期第三次调研)前四周期主族元素X、Y、Z、W的原子序数依次增大。X元素位于p区,且基态X原子中成对电子数是未成对电子数的2倍,金属元素Y的第一电离能比同周期相邻元素的大,Z元素单质常温下为黄绿色气体,W与Y同主族。下列说法正确的是A.简单离子半径:W>Z>YB.化合物WX2中阴、阳离子个数比为2∶1C.工业上常用钢瓶储运Z单质D. 最高价氧化物对应水化物的碱性:Y>W
分析可推知,X的核外电子排布为1s22s22p2,X为C,Y为Mg,Z为Cl,W为Ca。Ca2+、Cl-核外电子层排布相同,但核电荷数:Cl
常温下X的单质是一种淡黄色气体,则X为F,基态Y原子核外有4个能级且均充满电子即1s22s22p63s2,则Y为Mg,Z的原子共有16种不同运动状态的电子,故Z为S,它们最外层电子数之和为20,W最外层有5个电子,原子序数比S大,故为As。原子半径大小顺序为Mg>S>F,A错误;As原子4p能级电子排布半充满,较稳定,其第一电离能比同周期相邻元素的大,B正确;
F的非金属性比S强,HF的热稳定性比H2S强,C错误;S的非金属性强于As,最高价氧化物对应水化物酸性:H2SO4>H3AsO4,D错误。
3.(2023·江苏南通二模)X、Y、Z、W是原子序数依次增大的四种短周期元素。X和Y的基态原子s能级电子总数均等于其p能级电子总数,Z的原子最外层电子数是Y原子最外层电子数的2倍,W和X位于同一主族。下列说法不正确的是A.Z单质可用于制作半导体材料B.元素Z、W的最高价氧化物对应的水化物都是强酸C.元素X的简单气态氢化物的热稳定性比W的强D.简单离子半径:r(W)>r(X)>r(Y)
短周期元素X、Y的s能级电子总数均等于其p能级电子总数,若是第二周期元素则s能级电子数为4,2p能级电子数为4,原子序数为8,为O元素,若位于第三周期,则s能级电子数为6,2p能级电子数为6,3p能级没有电子,原子序数为12,为Mg元素,因此X为O,Y为Mg;W与X同主族,则W为S;Z原子最外层电子数是Y原子最外层电子数的2倍,则Z为Si。Z为Si,其单质可用于制作半导体材料,A正确;Z的最高价氧化物对应的水化物是硅酸,为弱酸,B错误;
O的非金属性比S强,因此简单气态氢化物更稳定,C正确;电子层数越多,简单离子半径越大,电子层数相同时,原子序数越小,简单离子半径越大,因此简单离子半径:r(W)>r(X)>r(Y),D正确。
4.五种短周期元素M、X、Y、Z、W的原子序数依次增大,其中X、Y、Z、W同周期,Z、M同主族;X+与M2-具有相同的电子层结构;简单离子半径:Z2->W-;基态Y原子最高能级上只有2个电子。下列说法正确的是A.固态单质的熔点:Z>YB.ZM2和ZM3两种分子的空间结构相同C.最高价氧化物对应水化物的酸性:Z>W>YD.M3是一种极性分子,相同外界条件下,M3在水中的溶解度比M2大
五种短周期元素M、X、Y、Z、W的原子序数依次增大,X+与M2-具有相同的电子层结构,则X为Na,M为O;Z、M同主族,则Z为S,简单离子半径:Z2->W-,则W为Cl;基态Y原子最高能级上只有2个电子,X、Y、Z、W同周期,Y位于第三周期,其价电子排布式为3s2或3s23p2,则Y为Mg或Si元素,以此分析解答。若Y的单质为硅,硅形成的晶体为共价晶体,具有较高熔点,若Y的单质为镁,镁形成的晶体为金属晶体,熔点较高,Z的单质为硫,硫形成的晶体为分子晶体,其熔点较低,则固态单质的熔点:Z
专题三 选择题专攻 2.物质结构与性质 2024年高考化学二轮复习课件+讲义: 这是一份专题三 选择题专攻 2.物质结构与性质 2024年高考化学二轮复习课件+讲义,文件包含专题三选择题专攻2物质结构与性质pptx、专题三选择题专攻2物质结构与性质教师版docx、专题三选择题专攻2物质结构与性质docx等3份课件配套教学资源,其中PPT共52页, 欢迎下载使用。
专题三 选择题专攻 1.元素“位—构—性”关系的分析应用 2024年高考化学二轮复习课件+讲义: 这是一份专题三 选择题专攻 1.元素“位—构—性”关系的分析应用 2024年高考化学二轮复习课件+讲义,文件包含专题三选择题专攻1元素“位构性”关系的分析应用pptx、专题三选择题专攻1元素“位构性”关系的分析应用教师版docx、专题三选择题专攻1元素“位构性”关系的分析应用docx等3份课件配套教学资源,其中PPT共47页, 欢迎下载使用。
专题二 物质结构与性质 选择题专攻 3.晶体结构课件-2024年高考化学二轮复习: 这是一份专题二 物质结构与性质 选择题专攻 3.晶体结构课件-2024年高考化学二轮复习,共38页。PPT课件主要包含了核心精讲,真题演练,考向预测等内容,欢迎下载使用。












