






所属成套资源:新教材适用2023_2024学年高中化学全一册课件打包22套苏教版必修第二册
- 新教材适用2023_2024学年高中化学专题6化学反应与能量变化第1单元化学反应速率与反应限度第1课时化学反应速率课件苏教版必修第二册 课件 0 次下载
- 新教材适用2023_2024学年高中化学专题6化学反应与能量变化第1单元化学反应速率与反应限度第2课时化学反应的限度课件苏教版必修第二册 课件 0 次下载
- 新教材适用2023_2024学年高中化学专题6化学反应与能量变化第2单元化学反应中的热课件苏教版必修第二册 课件 0 次下载
- 新教材适用2023_2024学年高中化学专题6化学反应与能量变化第3单元化学能与电能的转化第1课时化学能转化为电能课件苏教版必修第二册 课件 0 次下载
- 新教材适用2023_2024学年高中化学专题6化学反应与能量变化第3单元化学能与电能的转化第2课时化学电源电解池课件苏教版必修第二册 课件 0 次下载
新教材适用2023_2024学年高中化学专题6化学反应与能量变化专题整合课件苏教版必修第二册
展开
这是一份新教材适用2023_2024学年高中化学专题6化学反应与能量变化专题整合课件苏教版必修第二册,共38页。
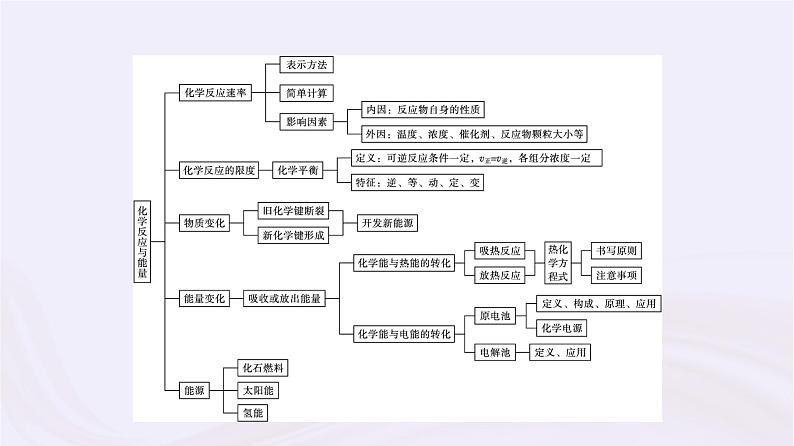
专题6 化学反应与能量变化专题整合知识网络系统构建核心归纳素养整合知识网络系统构建 核心归纳素养整合一、控制变量法探究影响化学反应速率的因素研究影响化学反应速率的因素时,由于外界影响因素较多,故为弄清某个因素的影响,均需控制其他因素相同或不变,再进行实验。因此,常用控制变量思想解决该类问题。1.常见考查形式。(1)以表格的形式给出多组实验数据,让学生找出每组数据的变化对化学反应速率的影响。(2)给出影响化学反应速率的几种因素,让学生设计实验分析各因素对化学反应速率的影响。2.解题策略。(1)确定变量。解答这类题目时首先要认真审题,理清影响实验探究结果的因素有哪些。(2)定多变一。在探究时,应该先确定其他的因素不变,只变化一种因素,看这种因素与探究的问题存在怎样的关系;这样确定一种以后,再确定另一种,通过分析每种因素与所探究问题之间的关系,得出所有影响因素与所探究问题之间的关系。(3)数据有效。解答时注意选择数据(或设置实验)要有效,且变量统一,否则无法作出正确判断。【例题1】 草酸(H2C2O4)与高锰酸钾在酸性条件下能够发生如下反应: +5H2C2O4+6H+══2Mn2++10CO2↑+ 8H2O。用4 mL 0.001 mol·L-1 KMnO4溶液与2 mL 0.010 mol·L-1 H2C2O4溶液,研究反应的温度、反应物的浓度与催化剂等因素对化学反应速率的影响。改变的条件如下表所示。(1)实验Ⅰ和Ⅱ可得出的结论:影响化学反应速率的因素是 ;如果研究温度对化学反应速率的影响,使用实验Ⅰ和 (用Ⅱ~Ⅳ表示)。 (2)实验Ⅳ中加入1 mL蒸馏水的目的是 。 答案:(1)催化剂 Ⅲ(2)确保所有实验中c(KMnO4)、c(H2C2O4)不变和总体积不变,实验Ⅳ中c(H+)不同解析:(1)实验Ⅰ和Ⅱ中温度、浓度相同,研究了催化剂对化学反应速率的影响;研究温度对化学反应速率的影响,应保证浓度相同,且不使用催化剂,则选实验Ⅰ和Ⅲ。(2)实验Ⅰ和Ⅳ中,硫酸的浓度不同,可研究浓度对化学反应速率的影响,加1 mL蒸馏水可确保两实验中各物质浓度和总体积相等。二、“三段式”在化学平衡计算中的运用解答有关化学反应速率和化学平衡的计算题时,一般需要写出化学方程式,列出起始量、转化量及平衡量,注意单位的统一,再根据题目其他条件和定律列方程求解。如: mA(g)+ nB(g) pC(g)+qD(g)起始量/mol a b 0 0转化量/mol mx nx px qx平衡量/mol a-mx b-nx px qx注意:①转化量与化学方程式中各物质的化学计量数成比例;②反应物:平衡时的量=起始的量-转化的量;生成物:平衡时的量=起始的量+转化的量。另外,差量法、守恒法、极限法也可运用到化学平衡的计算中。【例题2】 将等物质的量的A、B混合于2 L的密闭容器中,发生如下反应:3A(g)+B(g)x C(g)+2D(g),5 min末,测得D的物质的量浓度为0.5 mol·L-1,c(A)∶c(B)=3∶5,C的平均反应速率为0.1 mol·L-1·min-1。(1)5 min末时A的物质的量浓度c(A)= mol·L-1,反应开始前容器中A、B的物质的量:n(A)=n(B)= mol。 (2)B的平均反应速率:v(B)= mol·L-1·min-1。 (3)x的值为 。 答案:(1)0.75 3 (2)0.05 (3)2解析:(1) 3A(g)+B(g) xC(g)+2D(g)起始量/mol a a 0 0变化量/mol 1.5 0.5 1 15 min末/mol a-1.5 a-0.5 0.1×2×5 0.5×2三、化学反应速率及平衡图像问题的分析方法化学反应速率及化学平衡的图像,能直观描述反应进行的快慢、反应进行的程度等问题。图像题是化学中常见的一种题目,做这类题既要读文字内容,又要读图。解答化学反应速率图像题可采用“一看”“二想”“三判断”的方法。1.“一看”——看图像。(1)看坐标轴:弄清纵、横坐标表示的含义;(2)看线:弄清线的走向、趋势;(3)看点:弄清曲线上点的含义,特别是一些特殊点,如曲线的折点、交点、最高点与最低点等;(4)看量的变化:弄清是物质的量的变化还是浓度的变化。2.“二想”——想规律。如各物质的变化量之比与化学计量数之比的关系、各物质的速率之比与化学计量数之比的关系等。3.“三判断”——通过对比分析,作出正确判断。【例题3】 在某温度下的2 L密闭容器中,A、B两种气体间发生相互转化反应,实验测得A、B的物质的量随时间变化的曲线如图所示。(1)该反应的化学方程式为 。 (2)反应从开始至4 min时,A的平均反应速率为 。 (3)4 min时,反应是否达到平衡状态? (填“是”或“否”); 8 min时,v正(A) (填“>”“Q2 B.Q1






