





高二化学选修1-1 4.2爱护水资源课件及练习题含答案详解
展开
这是一份高二化学选修1-1 4.2爱护水资源课件及练习题含答案详解,共41页。PPT课件主要包含了生态系统,和铬Cr,微生物,+HCl,蛋白质,洗涤剂,氨基酸,HNO2,HNO3,硝酸盐等内容,欢迎下载使用。
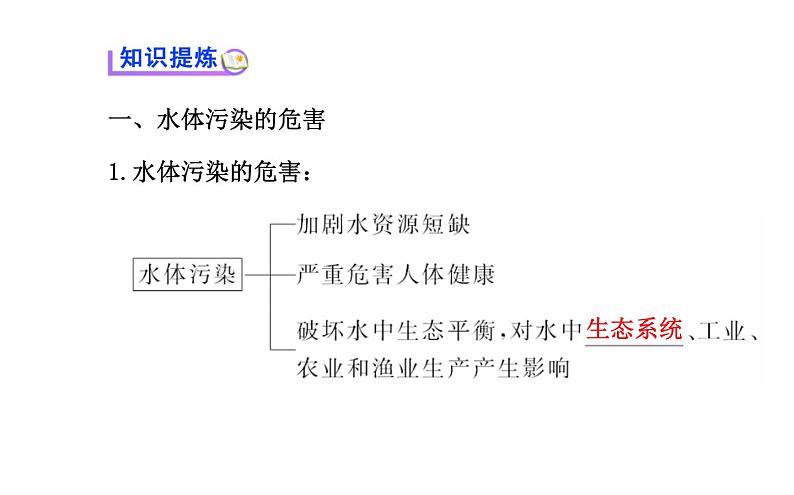
一、水体污染的危害1.水体污染的危害:
2.水体污染的类型:(1)重金属污染。①主要污染物及来源:化工、冶金、电子和电镀等行业排放的工业废水中含有的重金属,如________________________________等。②主要危害。
汞(Hg)、镉(Cd)、铅(Pb)
HgCl2+CH4====CH3HgCl
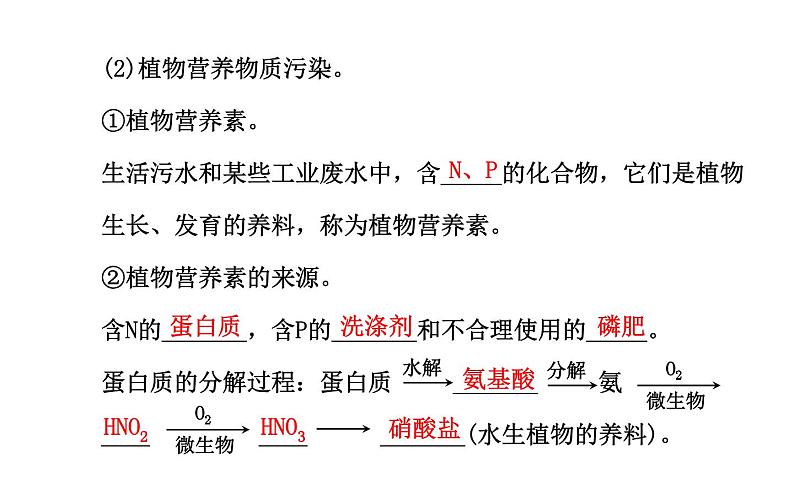
(2)植物营养物质污染。①植物营养素。生活污水和某些工业废水中,含_____的化合物,它们是植物生长、发育的养料,称为植物营养素。②植物营养素的来源。含N的_______,含P的_______和不合理使用的_____。蛋白质的分解过程:蛋白质 _______ 氨____ ____ _______(水生植物的养料)。
含氮、磷的物质在分解过程中大量消耗水中溶解的氧,并释放出养分,使藻类和其他浮游生物大量繁殖,而使水面呈现蓝色、红色或棕色等。若出现在江河、湖泊中称为“水华”,若出现在海湾,则称为“赤潮”。(3)其他污染:石油泄漏、农药的广泛使用、工业废水中的酸、碱、盐等对水体造成的污染。
二、改善水质1.措施:控制___________________的排放。2.改善水质的四种常用方法:(1)重复利用废水,回收废水中的_________,减少废水的________。(2)采用革新工艺,降低废水中_____________。(3)加强污水处理,使污水达到_______________以后再排放。(4)加强对_____________的监测和管理。
3.污水处理:(1)处理方法:_______、_______和_______。(2)处理程度:_________________。一般根据_________和处理后_________来确定污水处理程度。
4.污水处理的四种化学方法及其原理:
Al3++3H2O Al(OH)3
1.造成水污染的主要物质及危害:
2.明矾与硫酸铁的净水原理:明矾净水原理:Al3++3H2O Al(OH)3(胶体)+3H+,氢氧化铝胶体具有吸附聚沉的作用,所以可以净水,而硫酸铁中含有Fe3+,也会水解形成氢氧化铁胶体,有相同的作用,不同的是硫酸铁还能沉淀H2S、 、和OH-等,形成的沉淀更加细密均匀而不会形成松散的大块,因此效果更好。
3.自来水、纯净水的制取方法:(1)自来水的制法。
(2)纯净水的制取方法:将软化后的自来水用离子交换法、电渗析法、反渗透法或蒸馏法去掉某些离子,如Na+、Cl-等,可制得纯净水。(3)饮用水消毒:饮用水消毒的原理是加入氧化剂或高温,使细菌病毒的蛋白质变性死亡。工业上通常用氧化剂对饮用水消毒。
类型一 水体的污染及防治【示范题1】(2014·长沙高二检测)(1)某城镇生产、生活的分布情况如图所示,河流中W、X、Y、Z处某次水样抽测结果如表所示。
①导致X、Y处水样pH变化的原因可能是_________________________________________________________________;②Z处鱼类大量减少,产生这种现象的原因可能是_______________________________________________________。
(2)①某河道两旁有甲、乙两厂。它们排放的工业废水中,共含K+、Ag+、Fe3+、Cl-、OH-、 六种离子。甲厂的废水明显呈碱性,故甲厂废水中所含的三种离子是____________、__________、_________;乙厂的废水中含有另外三种离子。②如果加一定量的________________(填“活性炭”“硫酸亚铁”或“铁粉”),可以回收其中的金属____________(填写金属元素符号)。③另一种设想是将甲厂和乙厂的废水按适当比例混合,可以使废水中的____________(填写离子符号)转化为沉淀。经过滤后的废水主要含____________,可用来浇灌农田。
【解题指南】解答本题时要注意以下3点:(1)造纸厂排出的废水可能是碱性的,火力发电厂燃煤产生SO2,排出的废水是酸性的。(2)化肥厂和生活污水都可能含有大量的氮、磷元素。(3)根据离子共存的条件分析第(2)小题。
【解析】(1)①从题干图像和表中所给数据可知W处水源pH=6,而X处pH=8,pH变化的原因是造纸厂排放的碱性污水使X处pH升高,而Y、Z两处pH=5,pH变化的原因可能是火力发电厂燃煤产生的含酸性气体SO2的污水处理未达标就排放造成的。②Z处的河水污染有化肥厂废水,农田使用化肥,居民生活污水,会使河水富营养化,使藻类植物过多过快地生长,河水中溶解的氧气被大量消耗,导致鱼类缺氧而死亡。
(2)①甲厂排放的工业废水明显显碱性,一定含有OH-,与OH-可共存的离子有K+、Cl-、 ,考虑到Ag+与Cl-不能共存,所以甲厂废水含OH-、K+、Cl-,乙厂废水中含Ag+、Fe3+和 。②在乙厂废水中加入一定量的铁粉可以回收银。③若将两厂废水按适当比例混合,可将Ag+与Cl-、Fe3+与OH-分别转化为AgCl、Fe(OH)3沉淀,经过滤后溶液中主要含有KNO3,KNO3是含钾、氮的复合肥料,可用来灌溉农田。
答案:(1)①造纸厂排放的碱性污水使X处河水pH升高,火力发电厂燃煤产生的含酸性气体的污水处理未达标就排放,造成Y处的河水pH降低②化肥厂废水、农田使用化肥不当及生活污水处理不达标使Z处河水富营养化,水温较高,适于藻类等水生植物生长,河水中溶解氧被大量消耗,导致鱼类死亡(2)①OH- Cl- K+ ②铁粉 Ag③Ag+、Fe3+、Cl-、OH- KNO3
【示范题2】国家环境保护总局发布的《地表水环境质量标准》,对地表水质量作了明确规定,部分指标如下(除pH外,各项目的单位:mg·L-1):
(1)如果让你测定河水水样的pH,可选用________。A.石蕊试液 B.酚酞试液C.pH试纸 D.碳酸钠溶液(2)《地表水环境质量标准》中所指出的“磷”“氮”“锌”“铅”,是指________。A.单质 B.元素 C.离子 D.分子(3)经测定,某化工厂排放的污水中铅的质量分数为(1×10-5)%。则该污水的水质属于(设该污水的密度为1 g·cm-3)________。A.Ⅰ类 B.Ⅲ类 C.Ⅳ类 D.Ⅴ类
【解析】(1)石蕊试液、酚酞试液只能测出水样的酸碱性,不能测出水样的pH;碳酸钠溶液不能测水样的酸碱性。(2)《地表水环境质量标准》中所指出的“磷”“氮”“锌”“铅”是指元素。(3)1 L溶液中铅的质量=1 000 mL×1 g·cm-3×1 000 mg·g-1×(1×10-5)%=0.1 mg。答案:(1)C (2)B (3)D
【方法规律】对水体污染的认识水体污染防治措施的关键是了解污染的来源。水体污染有两类:一类是由自然因素造成的;另一类是由人为因素造成的,主要是工业排放的废水及生活污水、降雨淋洗大气中的污染物等造成了水体污染,产生了一系列的危害。只有了解了水体污染的种类,才能对症下药,减少水体污染对人类的危害。
【变式训练1】(2014·兰州高二检测)某地有甲、乙两工厂排放污水,污水中各含有下列8种离子中的4种(两厂不含相同离子):Ag+、Ba2+、Fe3+、Na+、Cl-、 、 、OH-。两厂单独排放都会造成严重的水污染,如将两厂的污水按一定的比例混合,沉淀后污水便变得无色澄清,只含硝酸钠,污染程度会大大降低。关于污染源的分析,你认为正确的是( )A. 和 可能来自同一工厂B.Cl-和 一定在不同的工厂C.Ag+和Na+可能在同一工厂D.Na+和 来自同一工厂
【解析】选B。本题是和工业生产相联系的,考查的本质是离子共存。根据题目中所给信息分析出,Ag+、Cl-;Ba2+、 ;Fe3+、OH-三组离子是不共存的,同时Ag+和 、OH-也不共存,因此Ag+只能和阴离子 处于同一溶液, 、Cl-、OH-只能处于同一溶液中。甲、乙两厂污水各含4种且不相同离子,则Ba2+、Fe3+必须和Ag+、 自来同一工厂,而 、Cl-、OH-、Na+来自另一工厂。根据判断可知只有B选项符合题意。
【变式训练2】(2013·临沂高二检测)我国纪念2013年“世界水日”和“中国水周”活动的宣传主题为“节约保护水资源,大力建设生态文明”。下列说法或做法不符合这一主题的是( )A.科学使用农药、化肥,减少水体污染B.工业废水和城市生活污水需净化处理,坚持达标排放C.为了节约生产成本,可将造纸厂、化工厂建在水源的上游D.合理开发水资源,建设水资源节约型和环境友好型经济
【解析】选C。造纸厂、化工厂排出的废水具有很强的污染性,如果将此类工厂建在水源的上游会污染饮用水,故C项错。
类型二 污水的处理【示范题3】如图是某市污水处理的工艺流程示意图:
(1)污水处理的主要方法有:①中和法;②化学沉淀法;③氧化还原法;④混凝法。其中属于化学方法的有______。A.①②③ B.①②④ C.②③④ D.①②③④(2)常用的混凝剂可以是________(任填一种混凝剂的名称)。(3)加入熟石灰的目的是_________,写出相关的化学方程式__________________________。(4)加入Na2S的作用是__________________。
【解题指南】解答本题应注意以下两点:(1)了解常见污水处理方法的原理。(2)能够根据污水中污染物的不同选择合适的处理方法。
【解析】四种方法都属于化学方法。根据污水中的成分选择处理方法和所用试剂。水处理过程中常用的混凝剂有硫酸铝[Al2(SO4)3]、明矾[KAl(SO4)2·12H2O]、聚羟基氯化铝、聚丙烯酰胺等。该污水中含有H+和Hg2+,加入熟石灰目的是中和酸性废水,加入Na2S目的是将Hg2+转化成HgS。答案:(1)D (2)明矾(其他合理答案亦可)(3)中和酸性废水Ca(OH)2+2HCl====CaCl2+2H2O (4)除去Hg2+
【示范题4】(2014·大连高二检测)水体污染物有:Ⅰ.含盐酸的酸性废水,Ⅱ.油类、氰化物、硫化物,Ⅲ.重金属离子;污水处理的化学方法有:a.中和法,b.沉淀法,c.氧化还原法。所采用的方法对水体污染物处理不正确的是( )A.Ⅰ,a B.Ⅱ,cC.Ⅰ,b D.Ⅲ,b【解析】选C。Ⅰ含盐酸的酸性废水用中和法处理,Ⅱ含油类、氰化物、硫化物的废水用氧化还原法处理,Ⅲ含重金属离子的废水用沉淀法处理,故C不正确。
【方法规律】污水处理方法(1)物理法:物理或机械的分离过程,如过滤、沉淀、离心等。(2)化学法:加入化学物质与污水中的有害物质发生化学反应的过程。①沉淀法:适合于处理含重金属离子的污水;②中和法:适合于处理酸性(或碱性)废水;③混凝法:适合于除去细小的悬浮颗粒。(3)生物法:微生物在污水中对有害物质进行氧化、分解的新陈代谢过程。
【变式训练3】近期发现一种不需要外加能源而能除去废水中的卤代烃(对人体健康有害)的方法,即把铁粉放在废水中,一段时间后卤代烃消失。有人提出该过程的机理为Fe+RCH2X+H+→RCH3+X-+Fe2+(X为卤素)。下列说法不正确的是( )A.处理后废水的pH增大B.反应过程中RCH2X是氧化剂C.该反应是置换反应D.处理含卤代烃1 ml的废水时,转移2 ml电子
【解析】选C。因反应消耗H+,所以处理后废水的pH增大,A项正确;反应中Fe的化合价升高,H的化合价未变,所以RCH2X必是氧化剂,B项正确;反应物为三种,不可能是置换反应,C项错误;每反应掉1 ml卤代烃,消耗1 ml Fe,变为Fe2+,转移的电子数为2 ml,D项正确。
【变式训练4】目前,城市污水处理厂多采用活性污泥法二级处理工艺来进行污水处理。该工艺的一级处理是在沉淀池中通过过滤除去污水中的固体沉淀物和悬浮物,再加入一定量的化学试剂中和酸性或碱性物质。二级处理是采用空气曝气活性污泥法,利用细菌等微生物除去废水中的有机污染物。(1)在这种污水处理工艺中,采用的污水处理方法有_______(从下列选项选择,用符号填空)。A.化学法 B.生物法 C.物理法
(2)在这种污水处理工艺的二级处理中要进行“曝气”,其主要目的是________________________________________。(3)采用这种工艺处理过的水可回收再利用,它_________(填“可以”或“不可以”)直接用作生活饮用水,其原因是___________________________________________________________________________________________________________________________________________________________。
【解析】(1)由题干中“过滤”“加入一定量的化学试剂”“利用细菌等微生物”的字眼即可作答。(2)“曝气”的含义是使水暴露在空气中,使水与空气接触的面积增大,增加水中的含氧量,以加速水中有机物的分解。(3)该工艺所采用的方法对污水的处理不是很彻底,如未涉及重金属离子的除去等。
相关课件
这是一份高二化学选修1-1 4.3垃圾资源化课件及练习题含答案详解,共46页。PPT课件主要包含了无害化,资源化,卫生填埋法,堆肥法,焚烧法,自然资源,可持续发展,Hg或Hg的化合物,低汞化,无汞化等内容,欢迎下载使用。
这是一份高二化学选修1-1 4.2爱护水资源课件及练习题含答案详解,共11页。
这是一份高二化学3.1合金课件及练习题含答案详解,共8页。








