
还剩23页未读,
继续阅读
高中化学第2节 有机化合物结构的测定习题
展开
这是一份高中化学第2节 有机化合物结构的测定习题,共26页。试卷主要包含了单选题,填空题,实验探究题等内容,欢迎下载使用。
一、单选题
1.柑橘类水果中含有柠檬酸,其结构简式如图。下列关于柠檬酸的说法不正确的是
A.分子式是C6H8O7
B.是可溶于水的有机化合物
C.与浓硫酸共热可发生消去反应
D.有三种化学环境不同的氢原子
2.下列说法正确的是
A.核磁共振氢谱图上可以推知有机物分子中几种不同类型的氢原子及它们的数目之比
B.红外光谱是用高能电子流等轰击样品分子,使分子失去电子变成分子离子或碎片离子
C.质谱法可以确定有机物中的化学键和官能团
D.根据碳、氢元素的质量分数一定可以确定该烃的分子式
3.关于下列两种物质的说法,正确的是
A.都有3种化学环境相同的氢原子
B.都不能发生消去反应
C.都能与Na反应生成H2
D.都能在Cu作催化剂时发生氧化反应
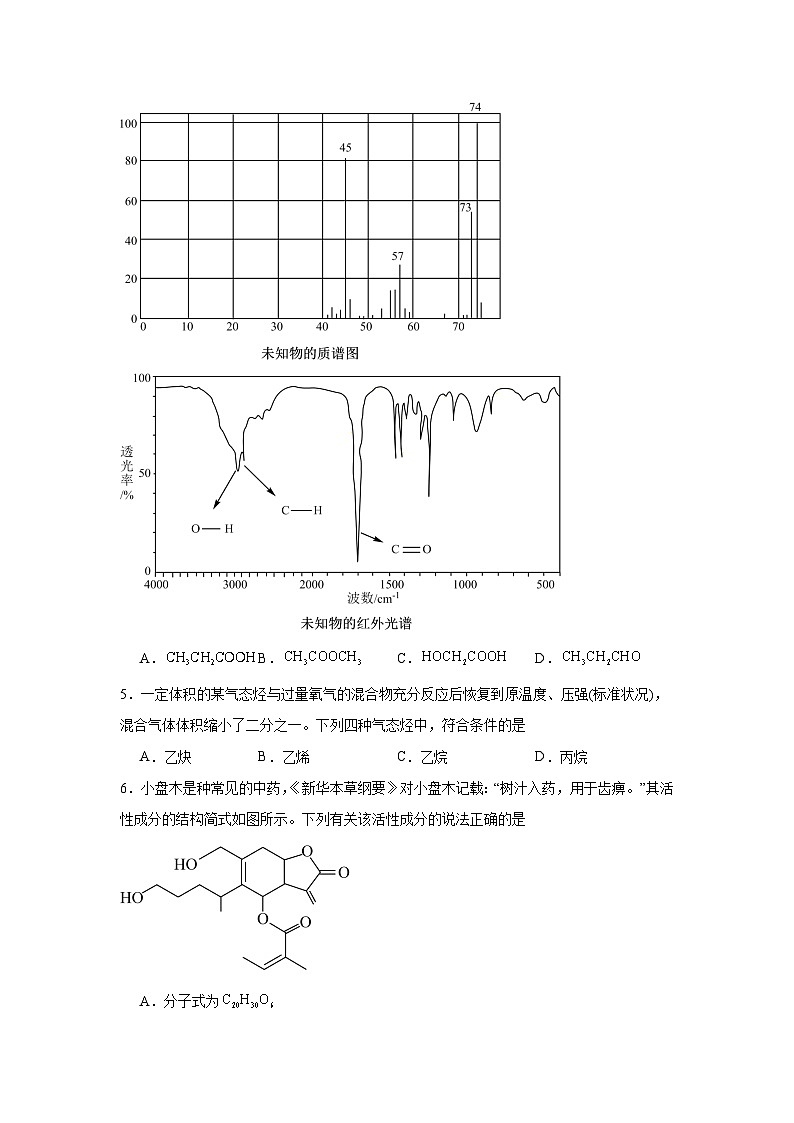
4.对某化合物进行结构分析,其质谱和红外光谱分别如下所示。则该化合物可能是
A.B.C.D.
5.一定体积的某气态烃与过量氧气的混合物充分反应后恢复到原温度、压强(标准状况),混合气体体积缩小了二分之一。下列四种气态烃中,符合条件的是
A.乙炔B.乙烯C.乙烷D.丙烷
6.小盘木是种常见的中药,《新华本草纲要》对小盘木记载:“树汁入药,用于齿痹。”其活性成分的结构简式如图所示。下列有关该活性成分的说法正确的是
A.分子式为
B.分子中含有四种官能团
C.使酸性溶液和溴水褪色时反应类型相同
D.1ml该活性成分消耗Na、NaOH的物质的量之比为1∶1
7.下列说法正确的是
A.碳化硅的分子式:SiC
B.的一溴代物有3种
C.乙醇的核磁共振氢谱图:
D.CH3CH2OH和具有相同的官能团,互为同系物
8.现有由过氧乙酸(CH3COOOH)、环己烷、戊烯组成的混合物,其中氧的质量分数为16%,则氢的质量分数是
A.6%B.12%C.18%D.24%
9.两种气态烃以任意比例混合,在105 ℃时1L该混合烃与9L氧气混合,充分燃烧后恢复到原状态,所得到气体体积是11L。下列各组混合烃符合此条件的是
A.C4H10、C3H6B.C4H8、C3H8C.C4H10、C2H4D.CH4、C3H8
10.全氟丙烷是重要的眼科手术材料,其产品质量与安全性是维护患者健康的重要前提。近期,一些眼科患者因使用了有问题的全氟丙烷气体而在术后导致不同程度的视网膜损害,甚至失明。下列说法中,正确的是
A.全氟丙烷的分子式为C3F6
B.全氟丙烷的沸点比丙烷低
C.全氟丙烷分子有两个同分异构体
D.使用合格的全氟丙烷气体,在手术后可能引起的并发症是高眼压
二、填空题
11.0.2ml某烃A在氧气中充分燃烧后,生成化合物B、C各1.2ml。请回答下列问题:
(1)烃A的分子式为 。
(2)若烃A不能使溴水褪色,但在一定条件下,能与氯气发生取代反应,其一氯代物只有一种,则烃A的结构简式为 。
(3)若烃A可与HBr加成,与HBr加成后只能得到一种产物,且烃A的一氯代物只有一种。
①A的结构简式为 ;名称是 。
②A在一定条件下能发生加聚反应,写出该反应的化学方程式 。
(4)若核磁共振氢谱显示链烃A中有三组峰,峰面积比为3∶2∶1,且无顺反异构。写出A的结构简式: 。
(5)比A少两个碳原子的A的烯烃同系物的同分异构体共有 种(不考虑顺反异构),其中只含有一个甲基的结构简式为 。
12.某有机化合物A经李比希法测得其中含碳为70.59%、含氢为 5.88%,其余含有氧。现用下列方法测定该有机化合物的相对分子质量和分子结构。
方法一:用质谱法分析得知A的质谱如图:
方法二:核磁共振仪测出A的核磁共振氢谱有4个峰,其面积之比为1∶2∶2∶3。
方法三:利用红外光谱仪测得A分子的红外光谱,如图:
(1)分子中共有 种化学环境不同的氢原子。
(2)A的分子式为 。
(3)该物质属于哪一类有机物 。
(4)A的分子中只含一个甲基的依据是 (填序号)。
a A的相对分子质量 b A的分子式
c A的核磁共振氢谱图 d A分子的红外光谱图
(5)A的结构简式为 。
13.I.某烃类化合物A的质谱图表明其相对分子质量为84,红外光谱表明分子中含有碳碳双键,核磁共振氢谱表明分子中只有一种类型的氢原子。
(1)A的结构简式为 。
(2)A中的碳原子是否都处于同一平面? (填“是”或“不是”)。是否存在顺反异构? (填“存在”或“不存在”)。
(3)A与发生反应的方程式为 。
(4)A发生加聚反应生成的产物结构简式为 。
Ⅱ.请按要求作答:
(5)的官能团的名称为 ,的官能团的名称为 。
14.(1)某有机物A的结构简式为,请回答下列问题:
①A中所含官能团的名称是 、 。
②A可能发生的反应有 填序号。
a.取代反应 b.消去反应 c.酯化反应 d.氧化反应
(2)给下列有机物命名:
① ;
② ;
③ ;
(3)A和B两种有机物可以互溶,其有关性质如下表所示:
①要除去A和B的混合物中的少量A,可采用 (填序号)方法。
A.蒸馏 B.重结晶 C.萃取 D.加水充分振荡,分液
②若B的分子式为,核磁共振氢谱表明其分子中有三种不同化学环境的氢原子,强度之比为则B的结构简式为 。
③若质谱图显示A的相对分子质量为74,红外光谱如图所示,则A的结构简式为 。
15.开链烷烃的分子通式为CnH2n+2(n为正整数),分子中每减少2个碳氢键必然同时增加1个碳碳键,可能形成双键或三键也可能是环状烃,但都称之为增加一个不饱和度。例如:CH3C≡CCH2CH=CH2其不饱和度为3。如图所示篮烷的结构,其分子式为 ,其不饱和度为 。
16.回答下列问题:
(1)完全燃烧下列烃①丙烷(C3H8)、②丁烯(C4H8)、③乙烯(C2H4)、④己烷(C6H14),等物质的量的上述四种烃,耗氧量最小的为 (填写序号,下同);等质量时,则耗氧量最大的为 ;
(2)二甲苯苯环上的一溴代物有六种同分异构体,用还原法制得三种二甲苯,它们的熔点分别如下表:
熔点为234℃分子的结构简式 ;
(3)0.2ml某烃A在氧气中完全燃烧后,生成CO2和H2O各1.2ml.试回答:
①若烃A不能使溴水褪色,但在一定条件下能与氯气发生取代反应,其一氯取代物只有一种,则烃A的结构简式为 ;
②若烃A能使溴水褪色,在催化剂作用下,与H2加成反应后生成2,2-二甲基丁烷,则烃A的名称是 ;
(4)组成符合CnH2n-2的某种烃,分子结构中没有支链或侧链。它完全燃烧时所消耗的O2的体积是同状况下该烃蒸气体积的7倍,由此分析回答:
①若该烃为二烯烃,并且与等物质的量的Br2加成后只能得到单一产物,则该烃的结构简式为 ;
②若该烃只能与等物质的量的Br2发生加成反应,则其结构简式为 (填任一种)。
17.
(1)某单烯烃A碳原子数小于8,与HBr加成产物只有一种结构.且A与H2加成后,所得烷烃的一卤代物的同分异构体有3种,则A的结构简式为 .
(2)丙烯是三大合成材料的基本原料,可用于合成应用广泛的DAP树脂单体和双酚等有机物,具有重要的工业用途.
①写出丙烯在一定条件下发生聚合反应的化学方程式 .
②丙烯在乙酸作用下与O2反应生成有机物A,其蒸气密度是相同状况下甲烷密度的6.25倍,元素的质量分数为:碳60%、氧32%.A的分子式为 .
(3)某烯烃与H2发生加成反应后得到的产物是CH3﹣CH(CH3)2.
①该产物的名称是 ;
②写出原来的烯烃使溴的四氯化碳溶液褪色的化学反应方程式: .
18.(1)按系统命名法填写下列有机物的名称:的名称是 。
(2)2,6二甲基4乙基辛烷的结构简式是 ,1 ml该烃完全燃烧需要消耗氧气 ml。
(3)在烃的分子结构中,若每减少2个氢原子,则相当于碳碳间增加1对共用电子。试完成下列问题:
①分子式为CnH2n+2的烃分子中碳碳间共用电子对数为 。
②有n对共用电子对的单烯烃的分子式为 。
(4)如图是由4个碳原子结合成的6种有机物(氢原子没有画出)
①写出有机物(a)的系统命名法的名称 。
②有机物(a)有一种同分异构体,试写出其结构简式 。
③上述有机物中与(c)互为同分异构体的是 (填代号)。
④与(e)互为同系物的最简单有机物的结构简式为: 。
⑤上述有机物中不能与溴水反应使其褪色的有 (填代号)。
⑥(a)(b)(c)(d)(e)五种物质中,4个碳原子一定处于同一平面的有 (填代号)。
19.某有机物A(含苯环)是烃的含氧衍生物,为测定其组成有如下实验结果:
①在一定温度和压强下将A汽化,其质量是同温、同压下氢气质量的76倍;
②称取7.6g有机物A,在过量氧气中完全燃烧.将反应后的混合气体通过足量浓H2SO4后体积变为10.64L,浓硫酸增重3.6g.再将余下的气体通过盛有足量碱石灰的干燥管,气体体积减少至1.68L(气体体积均在标准状况下测定).
(1)确定A的分子式 ;
(2)若A物质遇FeCl3溶液无显色反应,lmlA只能与lmlNaOH反应,1mlA与足量金属钠反应可生成1mlH2,试确定A的结构简式 (写一种即可)
20.燃烧法是测定有机物分子式的一种重要方法。完全燃烧 0.1ml 某烃后,测得生成的二氧化碳为 11.2 L(标准状况),生成的水为 10.8g。请完成下面的填空:
(1)该烃的分子式为 。
(2)写出它可能存在的全部物质的的结构简式 : 。
三、实验探究题
21.已知青蒿素是一种仅含有C、H、O三种元素的化合物,为进一步确定其化学式,进行了如图实验:
实验步骤:
①连接装置,检查装置气密性;
②称量E、F中仪器及药品的质量;
③取14.10 g青蒿素放入C的硬质玻璃管中,点燃C、D中的酒精灯加热,充分反应;
④实验结束后冷却至室温,称量反应后E、F中仪器及药品的质量。
(1)装置E、F应分别装入的药品为 、 。
(2)实验测得:
通过质谱法测得青蒿素的相对分子质量为282,结合上述数据,得出青蒿素的分子式为 。
(3)若使用上述方法会产生较大实验误差,你的改进方法是 。
22.卤代烃A(C2H5X)是一种无色液体,为探究A的性质,设计如下实验方案。
方案一:往A中加入硝酸银溶液,充分振荡,静置。
方案二:往A中加过量NaOH水溶液,充分振荡,静置,待液体分层后,取“水层”溶液少许,滴加硝酸银溶液。
方案三:往A中加入过量NaOH乙醇溶液,共热,充分反应后,取溶液少许,依次加入试剂B、硝酸银溶液,得浅黄色沉淀。
根据以上信息回答问题。
(1)C2H5X中的X是 。 (写化学式)
(2)方案一中可观察到溶液分层,设计简便方法,判断何为“水层” 。
(3)有人认为方案二达不到检验X-的实验目的,理由是 。
(4)方案三中,试剂B是 。写出方案三中可能发生反应的化学方程式 。
(5)将A与过量NaOH乙醇溶液共热生成的气体通入溴的四氯化碳溶液中,溶液褪色,原因是 。
23.某化学小组对卤代烷在不同溶剂中发生反应的情况进行实验探究。
[实验1]取一支试管,滴入15滴溴乙烷,加入5%的溶液,振荡后放入盛有热水的烧杯中水浴加热。片刻后,取分层后的上层水溶液,滴入另一支盛有稀硝酸的试管中,再加入2滴溶液。溶液出现浑浊。
[实验2]向圆底烧瓶中加入和无水乙醇,搅拌,再加入1-溴丁烷和几片碎瓷片,微热(液体沸腾后,移开酒精灯),产生的气体通过试管A后,再通入盛有酸性溶液的B试管。紫红色逐渐褪去。
请回答:
(1)实验1中,溴乙烷发生水解反应的化学方程式是 。
(2)已知:溴乙烷的沸点:38.4℃,1-溴丁烷的沸点:101.6℃
①由微粒间作用解释溴乙烷和1-溴丁烷沸点差异的原因是 。
②有同学用溴乙烷代替1-溴丁烷进行实验2,发现酸性溶液不褪色。由已知沸点差异分析实验失败的可能原因: 。
(3)对比实验1和实验2所用试剂,有利于消去反应发生的外部条件,除了碱性试剂外,还要求 (填“强极性”或“弱极性”)试剂。
(4)实验2检验出反应产物有丁烯,仍不能说明该条件下没有发生取代反应。若进一步检验是否生成1-丁醇,可采用的如下方法是 (填序号)。
a.对产物进行红外光谱分析
b.对产物进行核磁共振氢谱分析
c.使反应混合物与金属钠反应
(5)研究表明,除了外部条件,卤代烷的自身结构特点也决定了反应的趋向。伯卤代烷()优先发生取代反应,叔卤代烷()优先发生消去反应。写出2-溴-2-甲基丙烷发生消去反应的化学方程式: 。
参考答案:
1.D
【详解】A. 由柠檬酸的结构简式为:可知,其分子式是C6H8O7,故A正确;
B. 由柠檬酸的结构简式为:,含有羧基和羟基,为亲水基,所以它是可溶于水的有机化合物,故B正确;
C. 由柠檬酸的结构简式为:可知,羟基在浓硫酸共热条件下可发生消去反应,故C正确;
D. 由柠檬酸的结构简式为:可知,有四种化学环境不同的氢原子,故D错误;
故答案:D。
2.A
【详解】A.核磁共振H谱,有几个峰,就有几种H,峰的面积之比,就是H原子数之比,则由核磁共振氢谱图可以推知该有机物分子中有几种不同类型的氢原子及它们的数目,A正确;
B.质谱图是用高能电子流等轰击样品分子,使分子失去电子变成分子离子或碎片离子,B错误;
C.质谱法用于测定有机物的相对分子质量,不能测定出有机物的化学键和官能团,C错误;
D.根据碳、氢元素的质量分数可以确定该烃的实验式,通常无法确定分子式,D错误;
故选A。
3.C
【详解】A.根据等效氢原理可知, 有3种化学环境相同的氢原子,而有4种化学环境相同的氢原子,A错误;
B. 分子中醇羟基的领碳原子无氢原子,故不能发生消去反应,但 分子中醇羟基的领碳原子有氢原子,故能发生消去反应,B错误;
C. 和 中都含有醇羟基,则都能与Na反应生成H2,C正确;
D. 中与羟基相连的碳原子上还有氢原子,能在Cu作催化剂时发生氧化反应,而 中与羟基相连的碳原子上没有氢原子,不能在Cu作催化剂时发生氧化反应,D错误;
故答案为:C。
4.A
【分析】由未知的质谱图可知该化合物的相对分子质量为74,由未知物的红外光谱可知该化合物中含有O-H、C-H、C=O。
【详解】A.分子的相对分子质量为74,且含有O-H、C-H、C=O,A正确;
B.分子中不含有O-H,B错误;
C.分子的相对分子质量为76,C错误;
D.分子中不含有O-H,D错误;
故答案为:A
5.C
【详解】气态烃完全燃烧时有: ,
根据烃的燃烧通式可知,烃完全燃烧后气体体积变化为,当该气体烃与氧气恰好反应时,则一定满足:反应后二氧化碳的体积等于反应前气体总体积的一半,即:2x=1+x+ ,解得:y=4x-4;烃中含氢量越大,燃烧后气体体积减小则越大;由于氧气过量,烃不足,若反应后混合气体体积缩小,则该烃中氢原子数目必须满足:y>4x-4,当x=2时,则y>4x-4=4,即:如果该烃含有2个C,则氢原子数目一定大于4,满足条件的只有乙烷,AB错误,C正确;当x=3时,则y=4×3-4=8,碳原子为3的烃中,饱和烃丙烷才含有8个H,含有的氢原子数目不可能大于8,D错误;
答案选C。
6.D
【详解】A.由结构简式可知分子中含20个C,6个O,不饱和度为7,故H个数=20×2+2-7×2=28,分子式为,A错误;
B.分子中含羟基、碳碳双键、酯基共3种官能团,B错误;
C.使酸性溶液褪色是发生氧化反应,使溴水褪色是发生加成反应,反应类型不相同,C错误;
D.该分子中羟基与Na按1:1反应,1ml该物质最多消耗2mlNa,该分子中酯基与NaOH按1:1反应,1ml该物质最多消耗2mlNaOH,故1ml该活性成分消耗Na、NaOH的物质的量之比为1∶1,D正确;
答案选D。
7.B
【详解】A.碳化硅为共价晶体,不存在分子,其化学式为:SiC,故A错误;
B.该结构对称,苯环上有3种氢原子,则一溴代物有3种,故B正确;
C.乙醇中有3种氢,核磁共振氢谱中有3种信号,故C错误;
D.两者官能团个数不同,分子组成不相差若干个CH2,不互为同系物,故D错误;
故选:B。
8.B
【详解】混合物中只有过氧乙酸中含有氧,氧的质量分数为16%,则碳、氢的总质量分数为84%,混合物中各物质的碳、氢原子个数比均为1:2,即混合物中碳、氢的质量比始终是6:1,因此氢的质量分数为84%×= 12%,B项符合题意。
9.B
【详解】设有机物的平均分子式为CxHy,则有:CxHy+(x+)O2→xCO2+H2O,105 ℃时,H2O为气体,则有关系式CxHy+(x+)O2→xCO2+H2O~(),即CxHy~(),烃的体积为1L,有机物燃烧前后体积增大(11-1-9)L=1L,则有 ,解得y=8,即混合气中平均含有H原子数为8,即两种气态烃以任意比例混合后H的平均个数均为8,则混合烃种每一种烃的H个数都为8,B符合题意;
选B。
10.D
【解析】略
11. C6H12 2,3-二甲基-2-丁烯 n (CH3)2C=C(CH3)2→ (CH3CH2)2C=CH2 3种 CH2=CHCH2CH3
【分析】(1)0.2ml烃A在氧气的充分燃烧后生成化合物B,C各1.2ml,即生成CO2、H2O各1.2ml,则1ml烃中含有6mlC,12mlH原子,A分子式为C6H12;(2)若烃A不能使溴水褪色,说明有机物中不含碳碳双键,但在一定条件下,能与氯气发生取代反应,其一氯代物只有一种,应为环己烷;若烃A可与HBr加成,与HBr加成后只能得到一种产物,且烃A的一氯代物只有一种。说明该烯烃结构对称,分子中只有一种氢原子,根据题给条件来分析(4)、(5)题。
【详解】(1)烃含有C、H两种元素,0.2ml烃A在氧气的充分燃烧后生成化合物B,C各1.2ml,即生成CO2、H2O各1.2ml,根据原子守恒可知1ml烃中含有6mlC,12mlH原子,则A的分子式为C6H12,故答案为:C6H12;
(2)若烃A不能使溴水褪色,说明有机物中不含碳碳双键,但在一定条件下,能与氯气发生取代反应,其一氯代物只有一种,应为环己烷,结构简式为,故答案为:;
(3) 若烃A可与HBr加成,说明分子内含有双键,与HBr加成后只能得到一种产物,且烃A的一氯代物只有一种,说明结构对称,只有一种氢原子,①则其结构简式为,其名称为2,3-二甲基-2-丁烯
②A在一定条件下能发生加聚反应,其化学方程式为 n(CH3)2C=C(CH3)2→,故答案为 2,3-二甲基-2-丁烯 n(CH3)2C=C(CH3)2→;
(4) 若核磁共振氢谱显示链烃A中有三组峰,峰面积比为3∶2∶1,且无顺反异构。写出A的结构简式:CH3CH2CH=CHCH2CH3或(CH3CH2)2C=CH2,故答案为:(CH3CH2)2C=CH2;
(5) 比A少两个碳原子的A的烯烃同系物是丁烯,其同分异构体共有3种,其结构简式为CH2=CHCH2CH3, CH3CH=CHCH3,CH2=C(CH3) 2,不考虑顺反异构),其中只含有一个甲基的结构简式为CH2=CHCH2CH3,故答案为 3 CH2=CHCH2CH3
12. 4 C8H8O2 酯类 bc
【分析】(1)核磁共振氢谱可知A有4个峰;
(2)N(C):N(H):N(O)=:=4:4:1,A的相对分子质量为136;
(3)从红外光谱可知;
(4)由A的核磁共振氢谱有4个峰,其面积之比为1∶2∶2∶3,A的分子式为C8H8O2;
(5)会从质谱法中得到分子的相对分子质量,会分析核磁共振图谱得知有机物分子中氢的环境,会分析红外光谱仪确定分子中所含基团,结合起来可得A的结构简式。
【详解】(1)由核磁共振氢谱可知A有4个峰,所以A分子中共有4种化学环境不同的氢原子;
(2)已知A中含碳为70.59%、含氢为 5.88%,含氧23.53%,列式计算N(C):N(H):N(O)=:=4:4:1,求得A的实验式为C4H4O,设A的分子式为(C4H4O)n ,又由A的相对分子质量为136,可得n=2,分子式为C8H8O2;
(3)从红外光谱可知8个碳原子中有6个C在苯环中,还有C=O、C—O—C、C—H这些基团,可推测含有的官能团为酯基,所以A是酯类;
(4)由A的核磁共振氢谱有4个峰,其面积之比为1∶2∶2∶3,A的分子式为C8H8O2,可知A分子中只含一个甲基,因为甲基上的氢原子有3个,答案选bc;
(5)根据以上分析可知,A的结构简式为: 。
【点睛】本题考查测定该有机化合物的相对分子质量和分子结构方法,会从质谱法中得到分子的相对分子质量,会分析核磁共振图谱得知有机物分子中氢的环境,会分析红外光谱仪确定分子中所含基团,综合计算可以得到有机物的分子式和结构。
13.(1)
(2) 是 不存在
(3)+H2O
(4)
(5) 酮羰基 溴原子或碳溴键
【分析】Ⅰ.红外光谱表明分子中含有碳碳双键,其相对分子质量为84,根据烯烃的通式CnH2n,可以得出n=6,即为己烯,核磁共振氢谱表明分子中只有一种类型的氢原子,所有的氢原子是完全对称等效的,即结构简式为:,以此解答该题。
【详解】(1)根据分析可知,A的结构简式为:;
(2)含有碳碳双键,为平面形结构,与碳碳双键直接相连的原子在同一个平面上,则所有的碳原子均是共面的,由于连接双键的碳原子连接相同的原子团,不具有顺反异构;
(3)与H2O发生加成反应,反应的方程式为+H2O;
(4)含有碳碳双键,可发生加聚反应,产物结构简式为;
(5)的官能团为酮羰基,的官能团为溴原子或碳溴键。
14. 溴原子(或碳溴键) 羟基 abcd 2,2,4,5-四甲基己烷 3-甲基-1-丁烯 2,3,3-三甲基-2-丁醇 A CH3CH2OH CH3CH2OCH2CH3
【详解】(1)①根据A的结构简式,可知A中所含官能团是羟基和碳溴键。
②A分子中有羟基,可以和羧酸发生酯化反应,酯化反应也是取代反应,可以在浓硫酸作用下发生可以消去反应,可以被氧气或酸性高锰酸钾氧化,发生氧化反应。分子中有溴原子,具有卤代烃的性质,可以发生消去反应和取代反应,故选abcd。
(2)①是烷烃,根据烷烃的系统命名法,选择最长的碳链为主链,从离支链最近的一端给主链编号,若支链离两端距离相同,则使取代基位次之和最小,则应从左向右编号,所以该有机物的名称为2,2,4,5-四甲基己烷;
②是烯烃,选择包含碳碳双键碳原子在内的最长碳链为主链,从离碳碳双键最近的一端给主链编号,定名时先说取代基的名称,则该有机物的名称为3-甲基-1-丁烯;
③是醇,选择包含连接羟基的碳原子在内的最长碳链为主链,从离羟基最近的一端给主链编号,定名时先写取代基的名称,然后再写羟基的位置,最后为“某醇”,则该有机物的名称为2,3,3-三甲基-2-丁醇;
(3)①A和B两种有机物可以互溶,且沸点不同,要除去A和B的混合物中的少量A,可采用蒸馏的方法,故选A。
②B的分子式为 C2H6O ,核磁共振氢谱表明其分子中有三种不同化学环境的氢原子,强度之比为 3:2:1,说明B中有1个甲基、1个CH2,另一个氢原子为羟基,则B的结构简式为CH3CH2OH。
③质谱图显示A的相对分子质量为74,从红外光谱图可知,A中有对称的甲基、对称的CH2,还有C-O-C结构,则A的结构简式为CH3CH2OCH2CH3。
15. C10H12 5
【详解】在用链线式表示有机物时,每条短线的端点和拐点都表示一个碳原子,图中共有10个拐点,故含有10个碳原子。再根据每个碳原子成四条共价键,因此分子式为C10H12;如果是含有十个碳原子的饱和烷烃的分子式为C10H22,因为分子中每减少2个碳氢键必然同时增加1个碳碳键,(22-12)÷2=5,所以其不饱和度为5。
16.(1) ③ ①
(2)
(3) 3,3-二甲基-1-丁烯
(4) CH2=CH—CH2—CH=CH2
【详解】(1)同温同压同体积时,各烃(CxHy)的物质的量相等,则:C3H8的(x+)=5、C2H4的(x+)=3,C4H8的(x+)=6,C6H14的(x+)=9.5,完全燃烧耗氧量取决于(x+)值,该值越大,耗氧量越多,故同温同压同体积时,完全燃烧耗O2的量最小的是C2H4,①C3H8、②C4H8、③C2H4、④C6H14中C、H原子数目之比分别为1:2.7、1:2、1:2、1:2.3,故氢元素质量分数:①C3H8>④C6H14>②C4H8=③C2H4,质量相同时,分子中H元素的质量分数越大,完全燃烧时消耗O2越多,故完全燃烧时消耗O2的量最多的是C3H8;
(2)二甲苯有三种同分异构体,分别为对二甲苯、间二甲苯和邻二甲苯.其一溴代物分别有1种、3种和2种.根据表中对应二甲苯的熔点可判断,熔点为13℃的二甲苯只有一种一溴代物,熔点为-54℃的二甲苯有3种一溴代物,而熔点为-27℃的二甲苯有2种一溴代物.因此熔点为13℃的二甲苯是对二甲苯,熔点为-54℃的二甲苯是间二甲苯,熔点为-27℃的二甲苯是邻二甲苯,故:熔点为234℃的一溴二甲苯所对应的二甲苯是13℃的二甲苯,该一溴代物为;
(3)0.2ml某烃A在氧气中完全燃烧后,生成CO2和H2O各1.2ml,由原子守恒可知A的分子式为C6H12;
①若烃A不能使溴水褪色,但在一定条件下能与氯气发生取代反应,其一氯取代物只有一种,则烃A为环己烷,结构简式为;
②若烃A能使溴水褪色,在催化剂作用下,与H2加成反应后生成2,2-二甲基丁烷,则A为CH2=CHC(CH3)3,名称为:3,3-二甲基-1-丁烯;
(4)由燃烧通式可知,n+=7,解得n=5,故该烃分子式为C5H8;
①该烃为链状烯烃,饱和度为=2,则为二烯烃,且与等物质的量的Br2加成后只能得到单一产物,则该二烯烃为对称结构,分子结构中没有支链或侧链,且碳碳双键在1、4位,故为1,4-丁二烯,该烃的结构简式为CH2=CH-CH2-CH=CH2;
②该烃只能与等物质的量的Br2发生加成反应,则该烃只有1个双键,剩下的不饱和度是成环导致,故还含有一个环,分子结构中没有支链或侧链,故该烃的结构为 。
17.(1)CH3CH2CH=CHCH2CH3
(2) C5H8O2
(3) 2﹣甲基丙烷 CH2=C(CH3)2+Br2→CH2Br﹣CBr(CH3)2
【详解】(1)对称烯烃与不对称分子加成后产物只有1种,所以碳原子数小于8的某单烯烃与HBr反应,其加成产物只有一结构,符合此条件的单烯烃有CH2=CH2、CH3CH=CHCH3、CH3CH2CH=CHCH2CH3、C(CH3)2=C(CH3)2,共4种,在这些单烯烃中,若与H2加成后,产物分别为CH3CH3、CH3CH2CH2CH3、CH3CH2CH2CH2CH2CH3、(CH3)2CHCH(CH3)2,氢原子的种类分别为1、2、3、2,烷烃的一卤代物的同分异构体分别为1种、2种、3种;2种,所以所得烷烃的一卤代物的同分异构体有3种,则A的结构简式为CH3CH2CH=CHCH2CH3;
(2)①丙烯中含有双键能发生聚合反应,反应方程式为:;
②元素的质量分数为:碳60%、氧32%,则原子个数之比:C︰O︰H=︰︰=5︰28,有机物A蒸气密度是相同状况下甲烷密度的6.25倍,可以计算其相对分子质量为:16×6.25=100,分子式为:C5H8O2;
(3)①CH3-CH(CH3)2正确命名为:2-甲基丙烷;
②根据烯烃与H2加成反应的原理,推知该烷烃分子中相邻碳原子上均带氢原子的碳原子间是对应烯烃存在碳碳双键的位置,因此相应烯烃分子中存在碳碳双键的位置只有1种,结构简式为:CH2=C(CH3)2;CH2=C(CH3)2使溴的四氯化碳溶液褪色是该烃中的不饱和键断裂,断键原子分别与溴原子相结合,生成新的化合物CH2Br-CBr(CH3)2,方程式为:CH2=C(CH3)2+Br2→CH2Br-CBr(CH3)。
18. 3,4-二甲基辛烷
3,4-二甲基辛烷 18.5 n-1 CnH2n 2-甲基丙烷 CH3CH2CH2CH3 b CH≡CH af bc
【分析】(1)烷烃命名时,要选最长的碳链为主链,从离支链近的一端给主链上碳原子编号,据此分析;
(2)根据烷烃的命名原则写出该有机物的结构简式;根据该有机物的结构简式形成分子式,然后计算出完全燃烧消耗的氧气的物质的量;
(3)每个碳原子有4个价键,对于烃CxHy分子,除了氢原子之外就是碳与碳之间的共用电子对,由于每两个碳共用这些电子对,因此碳与碳之间的共用电子对数为,利用此公式代入即可求解本题;
(4)根据图示可知,a为2-甲基丁烷,b为2-甲基-1-丙烯,c为2-丁烯,d为1,3-丁二烯,e为1-丁炔,f为环丁烷;
①有机物(a)的最长碳链含有3号C,为烷烃,根据烷烃的命名进行解答;
②与a互为同分异构体的为正丁烷;
③c为2-丁烯,根据同分异构体的定义进行判断;
④e为丁炔,根据同系物的定义分析;
⑤含有C=C双键、C≡C三键的烃能与溴水发生加成反应,烷烃和环丁烷不与溴水反应;
⑥根据乙烯为平面机构、甲烷为正四面体结构判断(a)(b)(c)(d)四种物质中,4个碳原子一定处于同一平面情况。
【详解】(1)烷烃命名时,要选最长的碳链为主链,故主链上有8个碳原子,为辛烷,从离支链近的一端给主链上碳原子编号,故在3号和4号碳原子上各有一个甲基,故名称为3,4-二甲基辛烷;
(2)2,6-二甲基-4-乙基辛烷,主链为辛烷,在2、6号C各含有1个甲基,在4号C含有1个乙基,该有机物结构简式为:;根据其结构简式可知该有机物分子式为:C12H26,1ml该有机物完全燃烧消耗的氧气的物质的量为:(12+)ml=18.5ml;(3)①碳与碳之间的共用电子对数为==n-1;
②单烯烃比相应烷烃少了2个氢原子,烷烃通式为:CnH2n+2,所以单烯烃通式为:CnH2n;
(4)①由图示可知a为烷烃,含有4个C原子,主链含有3个C,甲基在2号C,该有机物名称为:2-甲基丙烷;
②含有4个碳原子的烷烃有CH3CH(CH3)CH3和CH3CH2CH2CH3,a为CH3CH(CH3)CH3,则其同分异构体为:CH3CH2CH2CH3;
③c为2-丁烯,与2-丁烯分子式相同,结构不通过的为b,即:b、c互为同分异构体,故答案为b;
④e为丁炔,CH≡CH等炔烃与丁炔互为同系物;
⑤上述五种物质中,b、c含有C=C双键、d、e含有C≡C三键能与溴水发生加成反应,使溴水褪色,而a烷烃、f环丁烷不与溴水反应,故答案为af;
⑥a为烷烃,甲烷为正四面体结构,则异丁烷中4个碳原子一定不共平面,故a错误;b为2-甲基-1-丙烯,可以看作两个甲基取代了乙烯中的一个C上的两个氢原子,乙烯为平面结构,则2-甲基-1-丙烯一定共平面,故b正确;c为2-丁烯,可以看作两个甲基分别取代了乙烯中两个C上的1个H,根据乙烯共平面可知,2-丁烯一定共平面,故c正确;d为1,3丁二烯,由于两个碳碳双键之间的碳碳键可以旋转,所以4个C原子不一定共平面,故d错误;故答案为bc。
19. C8H8O3
【详解】试题分析:(1)Mr(A)=76×Mr(H2)=76×2=152,浓硫酸增重3.6g,则反应中生成的水的质量是3.6g,
n(H)=(3.6g×2)÷18g/ml=0.4ml,再将余下的气体通过盛有足量碱石灰的干燥管,气体体积减少至1.68L(气体体积均在标准状况下测定).所以反应中生成的CO2是10.64L-1.68L=8.96L,n(C)=(10.64L−1.68L) ÷22.4L/ml=0.4ml,则根据原子守恒可知,n(O)=(7.6g−0.4ml×1g/ml−0.4ml×12g/ml) ÷16g/ml= 0.15ml,n(C):n(H):n(O)=0.4ml:0.4ml:0.15ml=8:8:3,A的实验式是C8H8O3,式量为152,即实验式就是分子式,即分子式为C8H8O3;(2)若A物质遇FeCl3溶液无显色反应,说明分子中无酚羟基,1mlA只能与1mlNaOH反应,1mlA与足量金属钠反应可生成1mlH2,说明分子中含醇羟基和羧基,可能的结构有、、、。
考点:考查有机物的推断,包括化学式、结构简式确定及有关计算的知识。
20. C5H12 CH3CH2CH2CH2CH3;(CH3)2CHCH2CH3;(CH3)4C
【详解】(1)根据题干信息,完全燃烧0.1ml某烃生成的二氧化碳为11.2L(标准状况),则,生成的水为10.8g,则,根据原子守恒可知,1ml该烃分子中含有5mlC原子,12mlH原子,则该烃的分子式为:C5H12;
(2)由(1)可知,该烃的分子式为C5H12,分子的不饱和度为0,属于烷烃,分子中有5个C原子,为戊烷,戊烷有正戊烷、异戊烷、新戊烷三种结构,其结构简式分别为:CH3CH2CH2CH2CH3;(CH3)2CHCH2CH3;(CH3)4C。
21.(1) 无水氯化钙或五氧化二磷 碱石灰
(2)C15H22O5
(3)在装置C的左侧增加除去空气中二氧化碳、水蒸气的除杂装置,同时在装置F右侧增加防止空气中二氧化碳、水蒸气进入装置F的装置
【分析】由图可知,装置C中青蒿素在通入的空气中完全燃烧产生的水蒸气、一氧化碳和二氧化碳,装置D中氧化铜将反应生成的一氧化碳氧化为二氧化碳,装置E中盛有的无水氯化钙或五氧化二磷用于吸收和测定反应生成水蒸气的量,装置F中碱石灰用于吸收测定反应生成二氧化碳的量,该实验的缺陷是空气中的二氧化碳和水蒸气会导致测得水蒸气和二氧化碳的量偏大,应在装置C的左侧增加除去空气中二氧化碳、水蒸气的除杂装置,同时在装置F右侧增加防止空气中二氧化碳、水蒸气进入装置F的装置。
【详解】(1)由分析可知,装置E中盛有的无水氯化钙或五氧化二磷用于吸收和测定反应生成水蒸气的量,装置F中碱石灰用于吸收测定反应生成二氧化碳的量,故答案为:无水氯化钙或五氧化二磷;碱石灰;
(2)由题意可知,青蒿素的物质的量为=0.05ml由表格数据可知,反应E中测得反应生成水的质量为(33.90—24.00)g=9.90g,装置F中测得二氧化碳的质量为(133.00—100.00)g=33.00g,由原子个数守恒可知,青蒿素中氢原子的物质的量为×2=1.1ml,碳原子的物质的量为=0.75ml,氧原子的物质的量为=0.25ml,由n:n(C) :n(H) :n(O)=0.05ml:0.75ml:1.1ml:0.25ml=1:15:22:5可知,青蒿素的分子式为C15H22O5,故答案为:C15H22O5;
(3)由分析可知,反应装置空气未经净化通入,会有空气中的水蒸气及二氧化碳混入青蒿素燃烧产物,从而干扰定量实验准确性,另实验装置末尾未加装一干燥装置,这样外界水蒸气和二氧化碳有可能进入F装置被碱石灰吸收,从而影响实验中二氧化碳的测定准确性,所以实验时应在装置C的左侧增加除去空气中二氧化碳、水蒸气的除杂装置,同时在装置F右侧增加防止空气中二氧化碳、水蒸气进入装置F的装置,故答案为:在装置C的左侧增加除去空气中二氧化碳、水蒸气的除杂装置,同时在装置F右侧增加防止空气中二氧化碳、水蒸气进入装置F的装置。
【点睛】”
22. Br 任取一层液体,加水,充分振荡,静置,若不分层,该层为“水层”,反之为“油层” 过量的NaOH溶液会与硝酸银溶液反应,最终生成沉淀(AgOH或Ag2O),从而干扰X-的检验 稀硝酸 CH3CH2Br+NaOHCH2=CH2↑+NaBr+H2O、HNO3+NaOH=NaNO3+H2O、 NaBr+AgNO3=AgBr↓+NaNO3 溴乙烷在氢氧化钠的乙醇溶液中发生消去反应,生成乙烯,乙烯能和溴水发生加成反应,而使其褪色
【分析】方案一:向C2H5X中加入硝酸银溶液,充分振荡后静置,两者不能直接反应,则液体分为两层,均为无色溶液;方案二:往A中加过量NaOH水溶液,充分振荡,静置,待液体分层后,取“水层”溶液少许,滴加硝酸银溶液,由于过量的NaOH溶液也会与硝酸银溶液反应生成沉淀(AgOH或Ag2O),从而干扰X-的检验;方案三:往A中加入过量NaOH乙醇溶液,共热,会发生消去反应,充分反应后,依然为碱性,所以再加入硝酸银溶液之前,应该首先加入硝酸酸化,得浅黄色沉淀,说明X为溴原子,据此分析作答。
【详解】(1)浅黄色沉淀是溴化银,所以X是Br,故答案为:Br;
(2)由于水层一定是和水互溶的,据此可以鉴别,即任取一层液体,加水,充分振荡,静置,若不分层,该层为“水层”,反之为“油层”,故答案为:任取一层液体,加水,充分振荡,静置,若不分层,该层为“水层”,反之为“油层”;
(3)由于过量的NaOH溶液也会与硝酸银溶液反应生成沉淀(AgOH或Ag2O),从而干扰X-的检验,故答案为:过量的NaOH溶液会与硝酸银溶液反应,最终生成沉淀(AgOH或Ag2O),从而干扰X-的检验;
(4)由于卤代烃的消去反应是在碱性条件下进行的,所以再加入硝酸银溶液之前,应该首先加入硝酸酸化,即B是稀硝酸;有关反应的方程式是:CH3CH2Br+NaOHCH2=CH2↑+NaBr+H2O、HNO3+NaOH=NaNO3+H2O、 NaBr+AgNO3=AgBr↓+NaNO3,故答案为:稀硝酸;CH3CH2Br+NaOHCH2=CH2↑+NaBr+H2O、HNO3+NaOH=NaNO3+H2O、 NaBr+AgNO3=AgBr↓+NaNO3;
(5)溴乙烷在氢氧化钠的乙醇溶液中发生消去反应,生成乙烯,乙烯能和溴水发生加成反应,而使其褪色,故答案为:溴乙烷在氢氧化钠的乙醇溶液中发生消去反应,生成乙烯,乙烯能和溴水发生加成反应,而使其褪色。
23. 1-溴丁烷的分子间作用力强于溴乙烷 溴乙烷沸点低,加热时没有充分反应就挥发出去 弱极性 a b NaOH+NaBr+H2O+
【分析】本题考查卤代烃的取代和消去反应的竞争,通过实验可以发现反应时溶剂不同对反应的产物是有很大影响的,所以要注意反应时的条件的不同,另外当反应的溶剂为乙醇时还要注意,乙醇对反应产物检验的干扰。
【详解】(1)通过实验发现溴乙烷水解后上层溶液中含有溴原子,结合卤代烃水解的知识可以知道,该反应的化学方程式是:;
(2)①溴乙烷和1-溴丁烷都是分子构成的物质,分子量越大熔沸点越高,所以1-溴丁烷沸点高的原因是:1-溴丁烷的分子间作用力强于溴乙烷;
②该反应需要加热,可能是溴乙烷沸点低挥发的问题,所以实验失败的可能原因:溴乙烷沸点低,加热时没有充分反应就挥发出去;
(3)对比实验1和实验2所用试剂可以发现,试剂是无水乙醇时利于发生反应,而乙醇极性较弱,所以除了碱性试剂外,还要求弱极性试剂;
(4)a.1-丁醇和丁烯官能团不同,所以可通过红外光谱进行分析,a正确;
b.1-丁醇和丁烯等效氢个数不同,所以可通过核磁共振氢谱分析,b正确;
c.在反应过程中使用了无水乙醇,而乙醇也可以和钠反应,c错误;
故选ab;
(5)2-溴-2-甲基丙烷发生消去反应会生成烯烃,其对应的化学方程式:NaOH+NaBr+H2O+。
密度
熔点
沸点
溶解性
A
不溶于水
B
与水以任意比混溶
六种一溴二甲苯的熔点
234℃
206℃
213.8℃
204℃
214.5℃
205
对应还原二甲苯的熔点
-13℃
-54℃
-27℃
-54℃
-27℃
-54℃
装置
实验前
实验后
E
24.00 g
33.90 g
F
100.00 g
133.00 g
一、单选题
1.柑橘类水果中含有柠檬酸,其结构简式如图。下列关于柠檬酸的说法不正确的是
A.分子式是C6H8O7
B.是可溶于水的有机化合物
C.与浓硫酸共热可发生消去反应
D.有三种化学环境不同的氢原子
2.下列说法正确的是
A.核磁共振氢谱图上可以推知有机物分子中几种不同类型的氢原子及它们的数目之比
B.红外光谱是用高能电子流等轰击样品分子,使分子失去电子变成分子离子或碎片离子
C.质谱法可以确定有机物中的化学键和官能团
D.根据碳、氢元素的质量分数一定可以确定该烃的分子式
3.关于下列两种物质的说法,正确的是
A.都有3种化学环境相同的氢原子
B.都不能发生消去反应
C.都能与Na反应生成H2
D.都能在Cu作催化剂时发生氧化反应
4.对某化合物进行结构分析,其质谱和红外光谱分别如下所示。则该化合物可能是
A.B.C.D.
5.一定体积的某气态烃与过量氧气的混合物充分反应后恢复到原温度、压强(标准状况),混合气体体积缩小了二分之一。下列四种气态烃中,符合条件的是
A.乙炔B.乙烯C.乙烷D.丙烷
6.小盘木是种常见的中药,《新华本草纲要》对小盘木记载:“树汁入药,用于齿痹。”其活性成分的结构简式如图所示。下列有关该活性成分的说法正确的是
A.分子式为
B.分子中含有四种官能团
C.使酸性溶液和溴水褪色时反应类型相同
D.1ml该活性成分消耗Na、NaOH的物质的量之比为1∶1
7.下列说法正确的是
A.碳化硅的分子式:SiC
B.的一溴代物有3种
C.乙醇的核磁共振氢谱图:
D.CH3CH2OH和具有相同的官能团,互为同系物
8.现有由过氧乙酸(CH3COOOH)、环己烷、戊烯组成的混合物,其中氧的质量分数为16%,则氢的质量分数是
A.6%B.12%C.18%D.24%
9.两种气态烃以任意比例混合,在105 ℃时1L该混合烃与9L氧气混合,充分燃烧后恢复到原状态,所得到气体体积是11L。下列各组混合烃符合此条件的是
A.C4H10、C3H6B.C4H8、C3H8C.C4H10、C2H4D.CH4、C3H8
10.全氟丙烷是重要的眼科手术材料,其产品质量与安全性是维护患者健康的重要前提。近期,一些眼科患者因使用了有问题的全氟丙烷气体而在术后导致不同程度的视网膜损害,甚至失明。下列说法中,正确的是
A.全氟丙烷的分子式为C3F6
B.全氟丙烷的沸点比丙烷低
C.全氟丙烷分子有两个同分异构体
D.使用合格的全氟丙烷气体,在手术后可能引起的并发症是高眼压
二、填空题
11.0.2ml某烃A在氧气中充分燃烧后,生成化合物B、C各1.2ml。请回答下列问题:
(1)烃A的分子式为 。
(2)若烃A不能使溴水褪色,但在一定条件下,能与氯气发生取代反应,其一氯代物只有一种,则烃A的结构简式为 。
(3)若烃A可与HBr加成,与HBr加成后只能得到一种产物,且烃A的一氯代物只有一种。
①A的结构简式为 ;名称是 。
②A在一定条件下能发生加聚反应,写出该反应的化学方程式 。
(4)若核磁共振氢谱显示链烃A中有三组峰,峰面积比为3∶2∶1,且无顺反异构。写出A的结构简式: 。
(5)比A少两个碳原子的A的烯烃同系物的同分异构体共有 种(不考虑顺反异构),其中只含有一个甲基的结构简式为 。
12.某有机化合物A经李比希法测得其中含碳为70.59%、含氢为 5.88%,其余含有氧。现用下列方法测定该有机化合物的相对分子质量和分子结构。
方法一:用质谱法分析得知A的质谱如图:
方法二:核磁共振仪测出A的核磁共振氢谱有4个峰,其面积之比为1∶2∶2∶3。
方法三:利用红外光谱仪测得A分子的红外光谱,如图:
(1)分子中共有 种化学环境不同的氢原子。
(2)A的分子式为 。
(3)该物质属于哪一类有机物 。
(4)A的分子中只含一个甲基的依据是 (填序号)。
a A的相对分子质量 b A的分子式
c A的核磁共振氢谱图 d A分子的红外光谱图
(5)A的结构简式为 。
13.I.某烃类化合物A的质谱图表明其相对分子质量为84,红外光谱表明分子中含有碳碳双键,核磁共振氢谱表明分子中只有一种类型的氢原子。
(1)A的结构简式为 。
(2)A中的碳原子是否都处于同一平面? (填“是”或“不是”)。是否存在顺反异构? (填“存在”或“不存在”)。
(3)A与发生反应的方程式为 。
(4)A发生加聚反应生成的产物结构简式为 。
Ⅱ.请按要求作答:
(5)的官能团的名称为 ,的官能团的名称为 。
14.(1)某有机物A的结构简式为,请回答下列问题:
①A中所含官能团的名称是 、 。
②A可能发生的反应有 填序号。
a.取代反应 b.消去反应 c.酯化反应 d.氧化反应
(2)给下列有机物命名:
① ;
② ;
③ ;
(3)A和B两种有机物可以互溶,其有关性质如下表所示:
①要除去A和B的混合物中的少量A,可采用 (填序号)方法。
A.蒸馏 B.重结晶 C.萃取 D.加水充分振荡,分液
②若B的分子式为,核磁共振氢谱表明其分子中有三种不同化学环境的氢原子,强度之比为则B的结构简式为 。
③若质谱图显示A的相对分子质量为74,红外光谱如图所示,则A的结构简式为 。
15.开链烷烃的分子通式为CnH2n+2(n为正整数),分子中每减少2个碳氢键必然同时增加1个碳碳键,可能形成双键或三键也可能是环状烃,但都称之为增加一个不饱和度。例如:CH3C≡CCH2CH=CH2其不饱和度为3。如图所示篮烷的结构,其分子式为 ,其不饱和度为 。
16.回答下列问题:
(1)完全燃烧下列烃①丙烷(C3H8)、②丁烯(C4H8)、③乙烯(C2H4)、④己烷(C6H14),等物质的量的上述四种烃,耗氧量最小的为 (填写序号,下同);等质量时,则耗氧量最大的为 ;
(2)二甲苯苯环上的一溴代物有六种同分异构体,用还原法制得三种二甲苯,它们的熔点分别如下表:
熔点为234℃分子的结构简式 ;
(3)0.2ml某烃A在氧气中完全燃烧后,生成CO2和H2O各1.2ml.试回答:
①若烃A不能使溴水褪色,但在一定条件下能与氯气发生取代反应,其一氯取代物只有一种,则烃A的结构简式为 ;
②若烃A能使溴水褪色,在催化剂作用下,与H2加成反应后生成2,2-二甲基丁烷,则烃A的名称是 ;
(4)组成符合CnH2n-2的某种烃,分子结构中没有支链或侧链。它完全燃烧时所消耗的O2的体积是同状况下该烃蒸气体积的7倍,由此分析回答:
①若该烃为二烯烃,并且与等物质的量的Br2加成后只能得到单一产物,则该烃的结构简式为 ;
②若该烃只能与等物质的量的Br2发生加成反应,则其结构简式为 (填任一种)。
17.
(1)某单烯烃A碳原子数小于8,与HBr加成产物只有一种结构.且A与H2加成后,所得烷烃的一卤代物的同分异构体有3种,则A的结构简式为 .
(2)丙烯是三大合成材料的基本原料,可用于合成应用广泛的DAP树脂单体和双酚等有机物,具有重要的工业用途.
①写出丙烯在一定条件下发生聚合反应的化学方程式 .
②丙烯在乙酸作用下与O2反应生成有机物A,其蒸气密度是相同状况下甲烷密度的6.25倍,元素的质量分数为:碳60%、氧32%.A的分子式为 .
(3)某烯烃与H2发生加成反应后得到的产物是CH3﹣CH(CH3)2.
①该产物的名称是 ;
②写出原来的烯烃使溴的四氯化碳溶液褪色的化学反应方程式: .
18.(1)按系统命名法填写下列有机物的名称:的名称是 。
(2)2,6二甲基4乙基辛烷的结构简式是 ,1 ml该烃完全燃烧需要消耗氧气 ml。
(3)在烃的分子结构中,若每减少2个氢原子,则相当于碳碳间增加1对共用电子。试完成下列问题:
①分子式为CnH2n+2的烃分子中碳碳间共用电子对数为 。
②有n对共用电子对的单烯烃的分子式为 。
(4)如图是由4个碳原子结合成的6种有机物(氢原子没有画出)
①写出有机物(a)的系统命名法的名称 。
②有机物(a)有一种同分异构体,试写出其结构简式 。
③上述有机物中与(c)互为同分异构体的是 (填代号)。
④与(e)互为同系物的最简单有机物的结构简式为: 。
⑤上述有机物中不能与溴水反应使其褪色的有 (填代号)。
⑥(a)(b)(c)(d)(e)五种物质中,4个碳原子一定处于同一平面的有 (填代号)。
19.某有机物A(含苯环)是烃的含氧衍生物,为测定其组成有如下实验结果:
①在一定温度和压强下将A汽化,其质量是同温、同压下氢气质量的76倍;
②称取7.6g有机物A,在过量氧气中完全燃烧.将反应后的混合气体通过足量浓H2SO4后体积变为10.64L,浓硫酸增重3.6g.再将余下的气体通过盛有足量碱石灰的干燥管,气体体积减少至1.68L(气体体积均在标准状况下测定).
(1)确定A的分子式 ;
(2)若A物质遇FeCl3溶液无显色反应,lmlA只能与lmlNaOH反应,1mlA与足量金属钠反应可生成1mlH2,试确定A的结构简式 (写一种即可)
20.燃烧法是测定有机物分子式的一种重要方法。完全燃烧 0.1ml 某烃后,测得生成的二氧化碳为 11.2 L(标准状况),生成的水为 10.8g。请完成下面的填空:
(1)该烃的分子式为 。
(2)写出它可能存在的全部物质的的结构简式 : 。
三、实验探究题
21.已知青蒿素是一种仅含有C、H、O三种元素的化合物,为进一步确定其化学式,进行了如图实验:
实验步骤:
①连接装置,检查装置气密性;
②称量E、F中仪器及药品的质量;
③取14.10 g青蒿素放入C的硬质玻璃管中,点燃C、D中的酒精灯加热,充分反应;
④实验结束后冷却至室温,称量反应后E、F中仪器及药品的质量。
(1)装置E、F应分别装入的药品为 、 。
(2)实验测得:
通过质谱法测得青蒿素的相对分子质量为282,结合上述数据,得出青蒿素的分子式为 。
(3)若使用上述方法会产生较大实验误差,你的改进方法是 。
22.卤代烃A(C2H5X)是一种无色液体,为探究A的性质,设计如下实验方案。
方案一:往A中加入硝酸银溶液,充分振荡,静置。
方案二:往A中加过量NaOH水溶液,充分振荡,静置,待液体分层后,取“水层”溶液少许,滴加硝酸银溶液。
方案三:往A中加入过量NaOH乙醇溶液,共热,充分反应后,取溶液少许,依次加入试剂B、硝酸银溶液,得浅黄色沉淀。
根据以上信息回答问题。
(1)C2H5X中的X是 。 (写化学式)
(2)方案一中可观察到溶液分层,设计简便方法,判断何为“水层” 。
(3)有人认为方案二达不到检验X-的实验目的,理由是 。
(4)方案三中,试剂B是 。写出方案三中可能发生反应的化学方程式 。
(5)将A与过量NaOH乙醇溶液共热生成的气体通入溴的四氯化碳溶液中,溶液褪色,原因是 。
23.某化学小组对卤代烷在不同溶剂中发生反应的情况进行实验探究。
[实验1]取一支试管,滴入15滴溴乙烷,加入5%的溶液,振荡后放入盛有热水的烧杯中水浴加热。片刻后,取分层后的上层水溶液,滴入另一支盛有稀硝酸的试管中,再加入2滴溶液。溶液出现浑浊。
[实验2]向圆底烧瓶中加入和无水乙醇,搅拌,再加入1-溴丁烷和几片碎瓷片,微热(液体沸腾后,移开酒精灯),产生的气体通过试管A后,再通入盛有酸性溶液的B试管。紫红色逐渐褪去。
请回答:
(1)实验1中,溴乙烷发生水解反应的化学方程式是 。
(2)已知:溴乙烷的沸点:38.4℃,1-溴丁烷的沸点:101.6℃
①由微粒间作用解释溴乙烷和1-溴丁烷沸点差异的原因是 。
②有同学用溴乙烷代替1-溴丁烷进行实验2,发现酸性溶液不褪色。由已知沸点差异分析实验失败的可能原因: 。
(3)对比实验1和实验2所用试剂,有利于消去反应发生的外部条件,除了碱性试剂外,还要求 (填“强极性”或“弱极性”)试剂。
(4)实验2检验出反应产物有丁烯,仍不能说明该条件下没有发生取代反应。若进一步检验是否生成1-丁醇,可采用的如下方法是 (填序号)。
a.对产物进行红外光谱分析
b.对产物进行核磁共振氢谱分析
c.使反应混合物与金属钠反应
(5)研究表明,除了外部条件,卤代烷的自身结构特点也决定了反应的趋向。伯卤代烷()优先发生取代反应,叔卤代烷()优先发生消去反应。写出2-溴-2-甲基丙烷发生消去反应的化学方程式: 。
参考答案:
1.D
【详解】A. 由柠檬酸的结构简式为:可知,其分子式是C6H8O7,故A正确;
B. 由柠檬酸的结构简式为:,含有羧基和羟基,为亲水基,所以它是可溶于水的有机化合物,故B正确;
C. 由柠檬酸的结构简式为:可知,羟基在浓硫酸共热条件下可发生消去反应,故C正确;
D. 由柠檬酸的结构简式为:可知,有四种化学环境不同的氢原子,故D错误;
故答案:D。
2.A
【详解】A.核磁共振H谱,有几个峰,就有几种H,峰的面积之比,就是H原子数之比,则由核磁共振氢谱图可以推知该有机物分子中有几种不同类型的氢原子及它们的数目,A正确;
B.质谱图是用高能电子流等轰击样品分子,使分子失去电子变成分子离子或碎片离子,B错误;
C.质谱法用于测定有机物的相对分子质量,不能测定出有机物的化学键和官能团,C错误;
D.根据碳、氢元素的质量分数可以确定该烃的实验式,通常无法确定分子式,D错误;
故选A。
3.C
【详解】A.根据等效氢原理可知, 有3种化学环境相同的氢原子,而有4种化学环境相同的氢原子,A错误;
B. 分子中醇羟基的领碳原子无氢原子,故不能发生消去反应,但 分子中醇羟基的领碳原子有氢原子,故能发生消去反应,B错误;
C. 和 中都含有醇羟基,则都能与Na反应生成H2,C正确;
D. 中与羟基相连的碳原子上还有氢原子,能在Cu作催化剂时发生氧化反应,而 中与羟基相连的碳原子上没有氢原子,不能在Cu作催化剂时发生氧化反应,D错误;
故答案为:C。
4.A
【分析】由未知的质谱图可知该化合物的相对分子质量为74,由未知物的红外光谱可知该化合物中含有O-H、C-H、C=O。
【详解】A.分子的相对分子质量为74,且含有O-H、C-H、C=O,A正确;
B.分子中不含有O-H,B错误;
C.分子的相对分子质量为76,C错误;
D.分子中不含有O-H,D错误;
故答案为:A
5.C
【详解】气态烃完全燃烧时有: ,
根据烃的燃烧通式可知,烃完全燃烧后气体体积变化为,当该气体烃与氧气恰好反应时,则一定满足:反应后二氧化碳的体积等于反应前气体总体积的一半,即:2x=1+x+ ,解得:y=4x-4;烃中含氢量越大,燃烧后气体体积减小则越大;由于氧气过量,烃不足,若反应后混合气体体积缩小,则该烃中氢原子数目必须满足:y>4x-4,当x=2时,则y>4x-4=4,即:如果该烃含有2个C,则氢原子数目一定大于4,满足条件的只有乙烷,AB错误,C正确;当x=3时,则y=4×3-4=8,碳原子为3的烃中,饱和烃丙烷才含有8个H,含有的氢原子数目不可能大于8,D错误;
答案选C。
6.D
【详解】A.由结构简式可知分子中含20个C,6个O,不饱和度为7,故H个数=20×2+2-7×2=28,分子式为,A错误;
B.分子中含羟基、碳碳双键、酯基共3种官能团,B错误;
C.使酸性溶液褪色是发生氧化反应,使溴水褪色是发生加成反应,反应类型不相同,C错误;
D.该分子中羟基与Na按1:1反应,1ml该物质最多消耗2mlNa,该分子中酯基与NaOH按1:1反应,1ml该物质最多消耗2mlNaOH,故1ml该活性成分消耗Na、NaOH的物质的量之比为1∶1,D正确;
答案选D。
7.B
【详解】A.碳化硅为共价晶体,不存在分子,其化学式为:SiC,故A错误;
B.该结构对称,苯环上有3种氢原子,则一溴代物有3种,故B正确;
C.乙醇中有3种氢,核磁共振氢谱中有3种信号,故C错误;
D.两者官能团个数不同,分子组成不相差若干个CH2,不互为同系物,故D错误;
故选:B。
8.B
【详解】混合物中只有过氧乙酸中含有氧,氧的质量分数为16%,则碳、氢的总质量分数为84%,混合物中各物质的碳、氢原子个数比均为1:2,即混合物中碳、氢的质量比始终是6:1,因此氢的质量分数为84%×= 12%,B项符合题意。
9.B
【详解】设有机物的平均分子式为CxHy,则有:CxHy+(x+)O2→xCO2+H2O,105 ℃时,H2O为气体,则有关系式CxHy+(x+)O2→xCO2+H2O~(),即CxHy~(),烃的体积为1L,有机物燃烧前后体积增大(11-1-9)L=1L,则有 ,解得y=8,即混合气中平均含有H原子数为8,即两种气态烃以任意比例混合后H的平均个数均为8,则混合烃种每一种烃的H个数都为8,B符合题意;
选B。
10.D
【解析】略
11. C6H12 2,3-二甲基-2-丁烯 n (CH3)2C=C(CH3)2→ (CH3CH2)2C=CH2 3种 CH2=CHCH2CH3
【分析】(1)0.2ml烃A在氧气的充分燃烧后生成化合物B,C各1.2ml,即生成CO2、H2O各1.2ml,则1ml烃中含有6mlC,12mlH原子,A分子式为C6H12;(2)若烃A不能使溴水褪色,说明有机物中不含碳碳双键,但在一定条件下,能与氯气发生取代反应,其一氯代物只有一种,应为环己烷;若烃A可与HBr加成,与HBr加成后只能得到一种产物,且烃A的一氯代物只有一种。说明该烯烃结构对称,分子中只有一种氢原子,根据题给条件来分析(4)、(5)题。
【详解】(1)烃含有C、H两种元素,0.2ml烃A在氧气的充分燃烧后生成化合物B,C各1.2ml,即生成CO2、H2O各1.2ml,根据原子守恒可知1ml烃中含有6mlC,12mlH原子,则A的分子式为C6H12,故答案为:C6H12;
(2)若烃A不能使溴水褪色,说明有机物中不含碳碳双键,但在一定条件下,能与氯气发生取代反应,其一氯代物只有一种,应为环己烷,结构简式为,故答案为:;
(3) 若烃A可与HBr加成,说明分子内含有双键,与HBr加成后只能得到一种产物,且烃A的一氯代物只有一种,说明结构对称,只有一种氢原子,①则其结构简式为,其名称为2,3-二甲基-2-丁烯
②A在一定条件下能发生加聚反应,其化学方程式为 n(CH3)2C=C(CH3)2→,故答案为 2,3-二甲基-2-丁烯 n(CH3)2C=C(CH3)2→;
(4) 若核磁共振氢谱显示链烃A中有三组峰,峰面积比为3∶2∶1,且无顺反异构。写出A的结构简式:CH3CH2CH=CHCH2CH3或(CH3CH2)2C=CH2,故答案为:(CH3CH2)2C=CH2;
(5) 比A少两个碳原子的A的烯烃同系物是丁烯,其同分异构体共有3种,其结构简式为CH2=CHCH2CH3, CH3CH=CHCH3,CH2=C(CH3) 2,不考虑顺反异构),其中只含有一个甲基的结构简式为CH2=CHCH2CH3,故答案为 3 CH2=CHCH2CH3
12. 4 C8H8O2 酯类 bc
【分析】(1)核磁共振氢谱可知A有4个峰;
(2)N(C):N(H):N(O)=:=4:4:1,A的相对分子质量为136;
(3)从红外光谱可知;
(4)由A的核磁共振氢谱有4个峰,其面积之比为1∶2∶2∶3,A的分子式为C8H8O2;
(5)会从质谱法中得到分子的相对分子质量,会分析核磁共振图谱得知有机物分子中氢的环境,会分析红外光谱仪确定分子中所含基团,结合起来可得A的结构简式。
【详解】(1)由核磁共振氢谱可知A有4个峰,所以A分子中共有4种化学环境不同的氢原子;
(2)已知A中含碳为70.59%、含氢为 5.88%,含氧23.53%,列式计算N(C):N(H):N(O)=:=4:4:1,求得A的实验式为C4H4O,设A的分子式为(C4H4O)n ,又由A的相对分子质量为136,可得n=2,分子式为C8H8O2;
(3)从红外光谱可知8个碳原子中有6个C在苯环中,还有C=O、C—O—C、C—H这些基团,可推测含有的官能团为酯基,所以A是酯类;
(4)由A的核磁共振氢谱有4个峰,其面积之比为1∶2∶2∶3,A的分子式为C8H8O2,可知A分子中只含一个甲基,因为甲基上的氢原子有3个,答案选bc;
(5)根据以上分析可知,A的结构简式为: 。
【点睛】本题考查测定该有机化合物的相对分子质量和分子结构方法,会从质谱法中得到分子的相对分子质量,会分析核磁共振图谱得知有机物分子中氢的环境,会分析红外光谱仪确定分子中所含基团,综合计算可以得到有机物的分子式和结构。
13.(1)
(2) 是 不存在
(3)+H2O
(4)
(5) 酮羰基 溴原子或碳溴键
【分析】Ⅰ.红外光谱表明分子中含有碳碳双键,其相对分子质量为84,根据烯烃的通式CnH2n,可以得出n=6,即为己烯,核磁共振氢谱表明分子中只有一种类型的氢原子,所有的氢原子是完全对称等效的,即结构简式为:,以此解答该题。
【详解】(1)根据分析可知,A的结构简式为:;
(2)含有碳碳双键,为平面形结构,与碳碳双键直接相连的原子在同一个平面上,则所有的碳原子均是共面的,由于连接双键的碳原子连接相同的原子团,不具有顺反异构;
(3)与H2O发生加成反应,反应的方程式为+H2O;
(4)含有碳碳双键,可发生加聚反应,产物结构简式为;
(5)的官能团为酮羰基,的官能团为溴原子或碳溴键。
14. 溴原子(或碳溴键) 羟基 abcd 2,2,4,5-四甲基己烷 3-甲基-1-丁烯 2,3,3-三甲基-2-丁醇 A CH3CH2OH CH3CH2OCH2CH3
【详解】(1)①根据A的结构简式,可知A中所含官能团是羟基和碳溴键。
②A分子中有羟基,可以和羧酸发生酯化反应,酯化反应也是取代反应,可以在浓硫酸作用下发生可以消去反应,可以被氧气或酸性高锰酸钾氧化,发生氧化反应。分子中有溴原子,具有卤代烃的性质,可以发生消去反应和取代反应,故选abcd。
(2)①是烷烃,根据烷烃的系统命名法,选择最长的碳链为主链,从离支链最近的一端给主链编号,若支链离两端距离相同,则使取代基位次之和最小,则应从左向右编号,所以该有机物的名称为2,2,4,5-四甲基己烷;
②是烯烃,选择包含碳碳双键碳原子在内的最长碳链为主链,从离碳碳双键最近的一端给主链编号,定名时先说取代基的名称,则该有机物的名称为3-甲基-1-丁烯;
③是醇,选择包含连接羟基的碳原子在内的最长碳链为主链,从离羟基最近的一端给主链编号,定名时先写取代基的名称,然后再写羟基的位置,最后为“某醇”,则该有机物的名称为2,3,3-三甲基-2-丁醇;
(3)①A和B两种有机物可以互溶,且沸点不同,要除去A和B的混合物中的少量A,可采用蒸馏的方法,故选A。
②B的分子式为 C2H6O ,核磁共振氢谱表明其分子中有三种不同化学环境的氢原子,强度之比为 3:2:1,说明B中有1个甲基、1个CH2,另一个氢原子为羟基,则B的结构简式为CH3CH2OH。
③质谱图显示A的相对分子质量为74,从红外光谱图可知,A中有对称的甲基、对称的CH2,还有C-O-C结构,则A的结构简式为CH3CH2OCH2CH3。
15. C10H12 5
【详解】在用链线式表示有机物时,每条短线的端点和拐点都表示一个碳原子,图中共有10个拐点,故含有10个碳原子。再根据每个碳原子成四条共价键,因此分子式为C10H12;如果是含有十个碳原子的饱和烷烃的分子式为C10H22,因为分子中每减少2个碳氢键必然同时增加1个碳碳键,(22-12)÷2=5,所以其不饱和度为5。
16.(1) ③ ①
(2)
(3) 3,3-二甲基-1-丁烯
(4) CH2=CH—CH2—CH=CH2
【详解】(1)同温同压同体积时,各烃(CxHy)的物质的量相等,则:C3H8的(x+)=5、C2H4的(x+)=3,C4H8的(x+)=6,C6H14的(x+)=9.5,完全燃烧耗氧量取决于(x+)值,该值越大,耗氧量越多,故同温同压同体积时,完全燃烧耗O2的量最小的是C2H4,①C3H8、②C4H8、③C2H4、④C6H14中C、H原子数目之比分别为1:2.7、1:2、1:2、1:2.3,故氢元素质量分数:①C3H8>④C6H14>②C4H8=③C2H4,质量相同时,分子中H元素的质量分数越大,完全燃烧时消耗O2越多,故完全燃烧时消耗O2的量最多的是C3H8;
(2)二甲苯有三种同分异构体,分别为对二甲苯、间二甲苯和邻二甲苯.其一溴代物分别有1种、3种和2种.根据表中对应二甲苯的熔点可判断,熔点为13℃的二甲苯只有一种一溴代物,熔点为-54℃的二甲苯有3种一溴代物,而熔点为-27℃的二甲苯有2种一溴代物.因此熔点为13℃的二甲苯是对二甲苯,熔点为-54℃的二甲苯是间二甲苯,熔点为-27℃的二甲苯是邻二甲苯,故:熔点为234℃的一溴二甲苯所对应的二甲苯是13℃的二甲苯,该一溴代物为;
(3)0.2ml某烃A在氧气中完全燃烧后,生成CO2和H2O各1.2ml,由原子守恒可知A的分子式为C6H12;
①若烃A不能使溴水褪色,但在一定条件下能与氯气发生取代反应,其一氯取代物只有一种,则烃A为环己烷,结构简式为;
②若烃A能使溴水褪色,在催化剂作用下,与H2加成反应后生成2,2-二甲基丁烷,则A为CH2=CHC(CH3)3,名称为:3,3-二甲基-1-丁烯;
(4)由燃烧通式可知,n+=7,解得n=5,故该烃分子式为C5H8;
①该烃为链状烯烃,饱和度为=2,则为二烯烃,且与等物质的量的Br2加成后只能得到单一产物,则该二烯烃为对称结构,分子结构中没有支链或侧链,且碳碳双键在1、4位,故为1,4-丁二烯,该烃的结构简式为CH2=CH-CH2-CH=CH2;
②该烃只能与等物质的量的Br2发生加成反应,则该烃只有1个双键,剩下的不饱和度是成环导致,故还含有一个环,分子结构中没有支链或侧链,故该烃的结构为 。
17.(1)CH3CH2CH=CHCH2CH3
(2) C5H8O2
(3) 2﹣甲基丙烷 CH2=C(CH3)2+Br2→CH2Br﹣CBr(CH3)2
【详解】(1)对称烯烃与不对称分子加成后产物只有1种,所以碳原子数小于8的某单烯烃与HBr反应,其加成产物只有一结构,符合此条件的单烯烃有CH2=CH2、CH3CH=CHCH3、CH3CH2CH=CHCH2CH3、C(CH3)2=C(CH3)2,共4种,在这些单烯烃中,若与H2加成后,产物分别为CH3CH3、CH3CH2CH2CH3、CH3CH2CH2CH2CH2CH3、(CH3)2CHCH(CH3)2,氢原子的种类分别为1、2、3、2,烷烃的一卤代物的同分异构体分别为1种、2种、3种;2种,所以所得烷烃的一卤代物的同分异构体有3种,则A的结构简式为CH3CH2CH=CHCH2CH3;
(2)①丙烯中含有双键能发生聚合反应,反应方程式为:;
②元素的质量分数为:碳60%、氧32%,则原子个数之比:C︰O︰H=︰︰=5︰28,有机物A蒸气密度是相同状况下甲烷密度的6.25倍,可以计算其相对分子质量为:16×6.25=100,分子式为:C5H8O2;
(3)①CH3-CH(CH3)2正确命名为:2-甲基丙烷;
②根据烯烃与H2加成反应的原理,推知该烷烃分子中相邻碳原子上均带氢原子的碳原子间是对应烯烃存在碳碳双键的位置,因此相应烯烃分子中存在碳碳双键的位置只有1种,结构简式为:CH2=C(CH3)2;CH2=C(CH3)2使溴的四氯化碳溶液褪色是该烃中的不饱和键断裂,断键原子分别与溴原子相结合,生成新的化合物CH2Br-CBr(CH3)2,方程式为:CH2=C(CH3)2+Br2→CH2Br-CBr(CH3)。
18. 3,4-二甲基辛烷
3,4-二甲基辛烷 18.5 n-1 CnH2n 2-甲基丙烷 CH3CH2CH2CH3 b CH≡CH af bc
【分析】(1)烷烃命名时,要选最长的碳链为主链,从离支链近的一端给主链上碳原子编号,据此分析;
(2)根据烷烃的命名原则写出该有机物的结构简式;根据该有机物的结构简式形成分子式,然后计算出完全燃烧消耗的氧气的物质的量;
(3)每个碳原子有4个价键,对于烃CxHy分子,除了氢原子之外就是碳与碳之间的共用电子对,由于每两个碳共用这些电子对,因此碳与碳之间的共用电子对数为,利用此公式代入即可求解本题;
(4)根据图示可知,a为2-甲基丁烷,b为2-甲基-1-丙烯,c为2-丁烯,d为1,3-丁二烯,e为1-丁炔,f为环丁烷;
①有机物(a)的最长碳链含有3号C,为烷烃,根据烷烃的命名进行解答;
②与a互为同分异构体的为正丁烷;
③c为2-丁烯,根据同分异构体的定义进行判断;
④e为丁炔,根据同系物的定义分析;
⑤含有C=C双键、C≡C三键的烃能与溴水发生加成反应,烷烃和环丁烷不与溴水反应;
⑥根据乙烯为平面机构、甲烷为正四面体结构判断(a)(b)(c)(d)四种物质中,4个碳原子一定处于同一平面情况。
【详解】(1)烷烃命名时,要选最长的碳链为主链,故主链上有8个碳原子,为辛烷,从离支链近的一端给主链上碳原子编号,故在3号和4号碳原子上各有一个甲基,故名称为3,4-二甲基辛烷;
(2)2,6-二甲基-4-乙基辛烷,主链为辛烷,在2、6号C各含有1个甲基,在4号C含有1个乙基,该有机物结构简式为:;根据其结构简式可知该有机物分子式为:C12H26,1ml该有机物完全燃烧消耗的氧气的物质的量为:(12+)ml=18.5ml;(3)①碳与碳之间的共用电子对数为==n-1;
②单烯烃比相应烷烃少了2个氢原子,烷烃通式为:CnH2n+2,所以单烯烃通式为:CnH2n;
(4)①由图示可知a为烷烃,含有4个C原子,主链含有3个C,甲基在2号C,该有机物名称为:2-甲基丙烷;
②含有4个碳原子的烷烃有CH3CH(CH3)CH3和CH3CH2CH2CH3,a为CH3CH(CH3)CH3,则其同分异构体为:CH3CH2CH2CH3;
③c为2-丁烯,与2-丁烯分子式相同,结构不通过的为b,即:b、c互为同分异构体,故答案为b;
④e为丁炔,CH≡CH等炔烃与丁炔互为同系物;
⑤上述五种物质中,b、c含有C=C双键、d、e含有C≡C三键能与溴水发生加成反应,使溴水褪色,而a烷烃、f环丁烷不与溴水反应,故答案为af;
⑥a为烷烃,甲烷为正四面体结构,则异丁烷中4个碳原子一定不共平面,故a错误;b为2-甲基-1-丙烯,可以看作两个甲基取代了乙烯中的一个C上的两个氢原子,乙烯为平面结构,则2-甲基-1-丙烯一定共平面,故b正确;c为2-丁烯,可以看作两个甲基分别取代了乙烯中两个C上的1个H,根据乙烯共平面可知,2-丁烯一定共平面,故c正确;d为1,3丁二烯,由于两个碳碳双键之间的碳碳键可以旋转,所以4个C原子不一定共平面,故d错误;故答案为bc。
19. C8H8O3
【详解】试题分析:(1)Mr(A)=76×Mr(H2)=76×2=152,浓硫酸增重3.6g,则反应中生成的水的质量是3.6g,
n(H)=(3.6g×2)÷18g/ml=0.4ml,再将余下的气体通过盛有足量碱石灰的干燥管,气体体积减少至1.68L(气体体积均在标准状况下测定).所以反应中生成的CO2是10.64L-1.68L=8.96L,n(C)=(10.64L−1.68L) ÷22.4L/ml=0.4ml,则根据原子守恒可知,n(O)=(7.6g−0.4ml×1g/ml−0.4ml×12g/ml) ÷16g/ml= 0.15ml,n(C):n(H):n(O)=0.4ml:0.4ml:0.15ml=8:8:3,A的实验式是C8H8O3,式量为152,即实验式就是分子式,即分子式为C8H8O3;(2)若A物质遇FeCl3溶液无显色反应,说明分子中无酚羟基,1mlA只能与1mlNaOH反应,1mlA与足量金属钠反应可生成1mlH2,说明分子中含醇羟基和羧基,可能的结构有、、、。
考点:考查有机物的推断,包括化学式、结构简式确定及有关计算的知识。
20. C5H12 CH3CH2CH2CH2CH3;(CH3)2CHCH2CH3;(CH3)4C
【详解】(1)根据题干信息,完全燃烧0.1ml某烃生成的二氧化碳为11.2L(标准状况),则,生成的水为10.8g,则,根据原子守恒可知,1ml该烃分子中含有5mlC原子,12mlH原子,则该烃的分子式为:C5H12;
(2)由(1)可知,该烃的分子式为C5H12,分子的不饱和度为0,属于烷烃,分子中有5个C原子,为戊烷,戊烷有正戊烷、异戊烷、新戊烷三种结构,其结构简式分别为:CH3CH2CH2CH2CH3;(CH3)2CHCH2CH3;(CH3)4C。
21.(1) 无水氯化钙或五氧化二磷 碱石灰
(2)C15H22O5
(3)在装置C的左侧增加除去空气中二氧化碳、水蒸气的除杂装置,同时在装置F右侧增加防止空气中二氧化碳、水蒸气进入装置F的装置
【分析】由图可知,装置C中青蒿素在通入的空气中完全燃烧产生的水蒸气、一氧化碳和二氧化碳,装置D中氧化铜将反应生成的一氧化碳氧化为二氧化碳,装置E中盛有的无水氯化钙或五氧化二磷用于吸收和测定反应生成水蒸气的量,装置F中碱石灰用于吸收测定反应生成二氧化碳的量,该实验的缺陷是空气中的二氧化碳和水蒸气会导致测得水蒸气和二氧化碳的量偏大,应在装置C的左侧增加除去空气中二氧化碳、水蒸气的除杂装置,同时在装置F右侧增加防止空气中二氧化碳、水蒸气进入装置F的装置。
【详解】(1)由分析可知,装置E中盛有的无水氯化钙或五氧化二磷用于吸收和测定反应生成水蒸气的量,装置F中碱石灰用于吸收测定反应生成二氧化碳的量,故答案为:无水氯化钙或五氧化二磷;碱石灰;
(2)由题意可知,青蒿素的物质的量为=0.05ml由表格数据可知,反应E中测得反应生成水的质量为(33.90—24.00)g=9.90g,装置F中测得二氧化碳的质量为(133.00—100.00)g=33.00g,由原子个数守恒可知,青蒿素中氢原子的物质的量为×2=1.1ml,碳原子的物质的量为=0.75ml,氧原子的物质的量为=0.25ml,由n:n(C) :n(H) :n(O)=0.05ml:0.75ml:1.1ml:0.25ml=1:15:22:5可知,青蒿素的分子式为C15H22O5,故答案为:C15H22O5;
(3)由分析可知,反应装置空气未经净化通入,会有空气中的水蒸气及二氧化碳混入青蒿素燃烧产物,从而干扰定量实验准确性,另实验装置末尾未加装一干燥装置,这样外界水蒸气和二氧化碳有可能进入F装置被碱石灰吸收,从而影响实验中二氧化碳的测定准确性,所以实验时应在装置C的左侧增加除去空气中二氧化碳、水蒸气的除杂装置,同时在装置F右侧增加防止空气中二氧化碳、水蒸气进入装置F的装置,故答案为:在装置C的左侧增加除去空气中二氧化碳、水蒸气的除杂装置,同时在装置F右侧增加防止空气中二氧化碳、水蒸气进入装置F的装置。
【点睛】”
22. Br 任取一层液体,加水,充分振荡,静置,若不分层,该层为“水层”,反之为“油层” 过量的NaOH溶液会与硝酸银溶液反应,最终生成沉淀(AgOH或Ag2O),从而干扰X-的检验 稀硝酸 CH3CH2Br+NaOHCH2=CH2↑+NaBr+H2O、HNO3+NaOH=NaNO3+H2O、 NaBr+AgNO3=AgBr↓+NaNO3 溴乙烷在氢氧化钠的乙醇溶液中发生消去反应,生成乙烯,乙烯能和溴水发生加成反应,而使其褪色
【分析】方案一:向C2H5X中加入硝酸银溶液,充分振荡后静置,两者不能直接反应,则液体分为两层,均为无色溶液;方案二:往A中加过量NaOH水溶液,充分振荡,静置,待液体分层后,取“水层”溶液少许,滴加硝酸银溶液,由于过量的NaOH溶液也会与硝酸银溶液反应生成沉淀(AgOH或Ag2O),从而干扰X-的检验;方案三:往A中加入过量NaOH乙醇溶液,共热,会发生消去反应,充分反应后,依然为碱性,所以再加入硝酸银溶液之前,应该首先加入硝酸酸化,得浅黄色沉淀,说明X为溴原子,据此分析作答。
【详解】(1)浅黄色沉淀是溴化银,所以X是Br,故答案为:Br;
(2)由于水层一定是和水互溶的,据此可以鉴别,即任取一层液体,加水,充分振荡,静置,若不分层,该层为“水层”,反之为“油层”,故答案为:任取一层液体,加水,充分振荡,静置,若不分层,该层为“水层”,反之为“油层”;
(3)由于过量的NaOH溶液也会与硝酸银溶液反应生成沉淀(AgOH或Ag2O),从而干扰X-的检验,故答案为:过量的NaOH溶液会与硝酸银溶液反应,最终生成沉淀(AgOH或Ag2O),从而干扰X-的检验;
(4)由于卤代烃的消去反应是在碱性条件下进行的,所以再加入硝酸银溶液之前,应该首先加入硝酸酸化,即B是稀硝酸;有关反应的方程式是:CH3CH2Br+NaOHCH2=CH2↑+NaBr+H2O、HNO3+NaOH=NaNO3+H2O、 NaBr+AgNO3=AgBr↓+NaNO3,故答案为:稀硝酸;CH3CH2Br+NaOHCH2=CH2↑+NaBr+H2O、HNO3+NaOH=NaNO3+H2O、 NaBr+AgNO3=AgBr↓+NaNO3;
(5)溴乙烷在氢氧化钠的乙醇溶液中发生消去反应,生成乙烯,乙烯能和溴水发生加成反应,而使其褪色,故答案为:溴乙烷在氢氧化钠的乙醇溶液中发生消去反应,生成乙烯,乙烯能和溴水发生加成反应,而使其褪色。
23. 1-溴丁烷的分子间作用力强于溴乙烷 溴乙烷沸点低,加热时没有充分反应就挥发出去 弱极性 a b NaOH+NaBr+H2O+
【分析】本题考查卤代烃的取代和消去反应的竞争,通过实验可以发现反应时溶剂不同对反应的产物是有很大影响的,所以要注意反应时的条件的不同,另外当反应的溶剂为乙醇时还要注意,乙醇对反应产物检验的干扰。
【详解】(1)通过实验发现溴乙烷水解后上层溶液中含有溴原子,结合卤代烃水解的知识可以知道,该反应的化学方程式是:;
(2)①溴乙烷和1-溴丁烷都是分子构成的物质,分子量越大熔沸点越高,所以1-溴丁烷沸点高的原因是:1-溴丁烷的分子间作用力强于溴乙烷;
②该反应需要加热,可能是溴乙烷沸点低挥发的问题,所以实验失败的可能原因:溴乙烷沸点低,加热时没有充分反应就挥发出去;
(3)对比实验1和实验2所用试剂可以发现,试剂是无水乙醇时利于发生反应,而乙醇极性较弱,所以除了碱性试剂外,还要求弱极性试剂;
(4)a.1-丁醇和丁烯官能团不同,所以可通过红外光谱进行分析,a正确;
b.1-丁醇和丁烯等效氢个数不同,所以可通过核磁共振氢谱分析,b正确;
c.在反应过程中使用了无水乙醇,而乙醇也可以和钠反应,c错误;
故选ab;
(5)2-溴-2-甲基丙烷发生消去反应会生成烯烃,其对应的化学方程式:NaOH+NaBr+H2O+。
密度
熔点
沸点
溶解性
A
不溶于水
B
与水以任意比混溶
六种一溴二甲苯的熔点
234℃
206℃
213.8℃
204℃
214.5℃
205
对应还原二甲苯的熔点
-13℃
-54℃
-27℃
-54℃
-27℃
-54℃
装置
实验前
实验后
E
24.00 g
33.90 g
F
100.00 g
133.00 g













