

河南省洛阳市2023-2024学年高二上期期中考试化学试题
展开注意事项:
1、答卷前,考生务必将自己的姓名、考号填写在答题卡上。
2、考试结束、将答题卡交回。
本试卷可能用到的相对原子质量:
H 1 C 12 O 16 Na 23 Cl35.5 Ti48
一、选择题(本题包括15小题,每小题3分,共45分。每小题只有一个选项符合题意)
1、在下列生活涉及的反应中、反应物总能量低于生成物总能量的是
A.“暖宝宝”的保暖过程
B、“自热米饭”的自热过程
C、胃酸过多可适量饮用苏打水
D.利用天然气烧菜做饭
2.酸碱中和滴定实验中不需要的仪器是
3.在2A(g) +B(s) =3C(g) +4D(g)反应中,表示反应速率最快的是
A.vΛ=0.5ml⋅L⁻¹⋅min⁻¹ B.vB=0.4ml⋅L⁻¹⋅mm⁻¹
C.νC=0.9ml⋅L⁻¹⋅min⁻¹ D.vD=0.1ml⋅L−1⋯−1
4.常温下,将 0.2ml⋅L⁻¹NaOH溶液与 0.09ml⋅L⁻¹H₂SO₄溶液等体积混合(忽略溶液体积变化)进行反应,恢复至室温后溶液的pH为
A.2 B、5 C、9 D、12
5.下列变化过程中△H>0、ΔS>0的是
A.H2Og=H₂O1
B.Ag+aq+Cl−aq=AgCls
C.Na₂Os+CO2g=Na₂CO3s
D. NH4Cl(s) =NH₃(R) +HCl(g)
6.对下列现象或事实解释正确的是
A. A B. B C. C D. D
7.25℃时,在下列给定条件的溶液中,一定能大量共存的离子组是
A. pH=l的溶液中: Fe2+,NO3−,SO42−,Na+
B.在含有大量 Fe³⁺的溶液中:1 NH4+,Na+、Cl−,HCO3−
C.cH⁺/cOH⁻=10¹²的溶液中: NH4+,Al3+、NO3−、Cl−
D.由水电离出的 cOH⁻=1×10⁻¹⁴ml⋅L⁻¹的溶液中: Ca2+、K+,Cl−、HCO3−
8.2SO₂g+O₂g=2SO₃g ΔH=−196kJ⋅ml⁻¹在 V₂O₅存在时,该反应机理为: ①V₂O₅+SO₂→2VO₂+SO₃(快) ΔH₁=a kJ·ml⁻';②4VO₂+O₂→2V₂O₅(慢) △H₂。下列说法正确的是
A.ΔH₂=−196+2akJ⋅ml⁻¹
B.该总反应逆反应的活化能小于 196kJ⋅ml⁻¹
C.总反应的快慢主要由第①步反应决定
D.由反应机理可知, V₂O₅和 VO₂都是该反应的催化剂
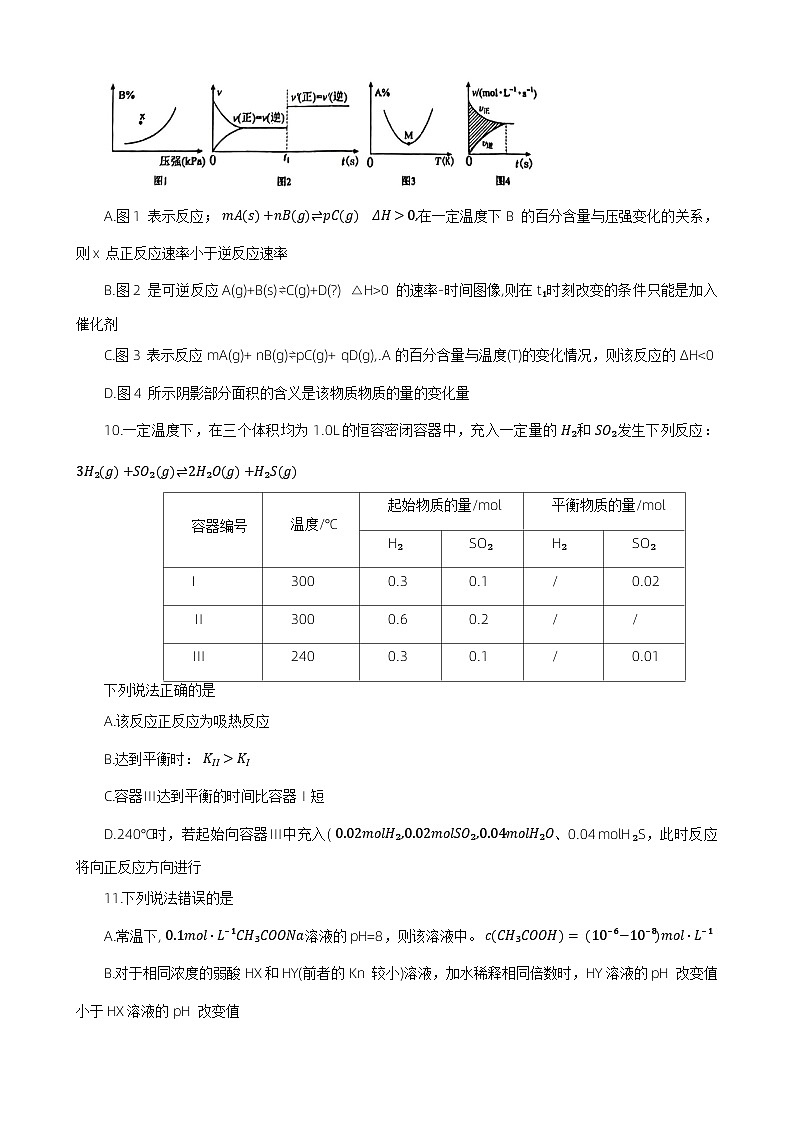
9.下列图示与对应的叙述相符的是
A.图1表示反应; mAs+nBg⇌pCg ΔH>0,在一定温度下B的百分含量与压强变化的关系,则x点正反应速率小于逆反应速率
B.图2是可逆反应A(g)+B(s)⇌C(g)+D(?) △H>0的速率-时间图像,则在t₁时刻改变的条件只能是加入催化剂
C.图3表示反应mA(g)+ nB(g)⇌pC(g)+ qD(g),.A 的百分含量与温度(T)的变化情况,则该反应的ΔH<0
D.图4所示阴影部分面积的含义是该物质物质的量的变化量
10.一定温度下,在三个体积均为1.0L 的恒容密闭容器中,充入一定量的 H₂和 SO₂发生下列反应: 3H₂g+SO₂g⇌2H₂Og+H₂Sg
下列说法正确的是
A.该反应正反应为吸热反应
B.达到平衡时: KII>KI
C.容器Ⅲ达到平衡的时间比容器Ⅰ短
D.240℃时,若起始向容器Ⅲ中充入( 0.02mlH₂,0.02mlSO₂,0.04mlH₂O、0.04 mlH₂S,此时反应将向正反应方向进行
11.下列说法错误的是
A.常温下, 0.1ml⋅L⁻¹CH₃COONa溶液的 pH=8,则该溶液中。 cCH₃COOH= 10⁻⁶−10⁻⁸ml⋅L⁻¹
B.对于相同浓度的弱酸HX 和HY(前者的Kn较小)溶液,加水稀释相同倍数时,HY 溶液的pH改变值小于 HX 溶液的pH改变值
C.硫酸钡 Ksp=1.1×10−10固体在水中存在以下平衡 BaSO₄s⇒Ba2+aq+ SO42−aq,,当加入饱和碳酸钠溶液时可以生成 BgCO3Ksp=2.6×10−9沉淀
D.常温下, aml⋅L⁻¹的 CH₃COOH 溶液与0.01ml⋅L⁻¹NaOH溶液等体积混合后溶液呈中性,此温度下醋酸的 Ka=10−9a−0.01
12、我国科学院化学研究所报道了化合物1催化CO2氢化机理。由化合物1(固体)→化合物2(固体)过程的机理和相对能量曲线如下图所示(已知 1kcal=4.19kJ)。下列说法错误的是
A.化合物l→化合物2的过程中包含两个基元反应
B.降低温度有利于提高l₁₋₂的平衡转化率.
C.图中化合物l和CO₂的总能量大于化合物2的总能量
D.过程①的热化学方程式为: 1s+CO₂g=1₁₋₂sΔH=+2.08kJ⋅ml⁻¹
13.缓冲溶液可以抗御少量酸碱对溶液 pH 的影响。人体血液里存在 H2CO3/HCO3−缓冲体系,可使血液的 pH 稳定在7.4左右,当血液 pH 低于7.2或高于7.5时,会发生酸中毒或碱中毒。 H2CO3/HCO3−缓冲体系的缓冲作用可用下列平衡表示:
H+aq+HCO3−aqH2CO3aq=CO2g+H2Ol已知 H₂CO₃的 Ka1=4.5 ×10⁻⁷,Ka2=4.7×10⁻¹¹。下列说法正确的是
A.人体发生碱中毒时注射NaHCO₃溶液可以缓解症状
B.1ml⋅L⁻¹NaHCO₃溶液中 Na⁺的个数约为6.02×10²³
C. pH =7.00的血液中, cH2CO3
14.第19届杭州亚运会上,“零碳”甲醇火炬彩显了“绿色亚运”的精神。“零碳”甲醇是利用焦炉气副产物 H₂和工业尾气中的CO₂合成,涉及以下反应: ①CO₂g+H₂(g)=CO(g)+H₂O(g) ΔHₗ=+4l.2 kJ·ml⁻';②CO(g) +2H₂(g)=CH₃OH(g)Δ Hz=−90.5kJ⋅ml−1;③CO2g+3H2g=CH3OHg+H2Og ∆H3。下列叙述错误的是
A,依据盖斯定律,可计算得出: △H₃=−49.3kJ⋅ml⁻¹
B.增大压强,会增大反应②的平衡常数
C.适当提高氢碳比,有利于提高 CH₃OH 的平衡产率
D.适当升高温度,反应①②③的速率均会增大
15、亚磷酸(H₃PO₃)是一种二元弱酸,常温下,向一定浓度的 NaOH溶液中逐滴滴加H₃PO₃溶液,含磷各微粒的分布分数X(平衡时某微粒的浓度占各微粒浓度之和的分数)与pOH[pOH=-lgc(OH-)]的关系如图所示。下列说法正确的是
A.曲线b代表 XHPO32−
B. H₂PO₃的 Ka=1×10−6.7
C.反应主要产物为 Na₂HPO₃和 NaH₂PO₃两种酸式盐
D.在NaH₂PO₃溶液中: Na+>cH2PO3−>cHPO32−>cOH−>cH+
二、非选择题(本题包括4小题,共55分)
16.(12分)(1)等浓度的盐酸、氨水中,由水电离出的 H⁺浓度前者 后者(填“大于”“小于”或“等于”)。在25 ℃下,将 aml⋅L⁻ˡ的氨水与0 .01ml⋅L⁻¹的盐酸等体积混合充分反应后溶液呈中性,则反应后溶液中离子浓度的大小关系为 。
(2)下列方法中可以使 0.10ml⋅L⁻¹CH₃COOH的电离程度增大的是 (填字母)。
a.加入少量0. 10 ml·L⁻¹的稀盐酸 b.加热该 CH₃COOH 溶液
c.加入少量冰醋酸 d.加水稀释至0.010ml⋅L⁻¹
e.加入少量0,10 ml·L⁻¹的 NaOH 溶液
(3)2023年10月15日8时54分,长征二号丁运载火箭在酒泉卫星发射中心点火升空,将云海一号04星送入预定轨道,此次任务是长征二号丁运载火箭2023年度的第10次发射,实现了十战十捷。
①全箭主动力采用四氧化二氮(N₂O₄)和偏二甲肼(C₂H₈N₂)推进剂:
已知: N2g+202g=N2OA1 ΔH1=xkJ⋅ml−1
C₂H₈ N21+402g=N2g+2CO2g+4H2Og ΔH₂=ykJ⋅ml⁻¹
则 C₂H₈N₂1+2N₂O₄1=3N₂g+2CO₂g+4H₂Og的 ΔH= 。
②火箭和导弹表面的薄层是耐高温物质。下列反应可制得该材料: 4Al+3TiO₂+3C= 2Al₂O₃+3TiC,,已知反应物和生成物均为固体,该反应过程中每转移1 ml电子放出的热量为98 kJ,写出该反应的热化学方程式 。
(4)反应 H₂Saq+Cu²⁺aq=CuSs+2H⁺aq的平衡常数为 (保留小数点后一位)。[已知 KₛₚCuS=6.0×10⁻³⁶,H₂S的 Ka1=1.0×10⁻⁷,Ka2=1.0×10⁻¹³]
17.(13分)我们在研究物质时,常常需要对物质进行定量分析。某兴趣小组用含少量杂质(杂质不与盐酸反应)的固体烧碱样品进行以下实验:
Ⅰ.用酸碱中和滴定法测定该烧碱样品的纯度。
将1.70 g上述样品配制成200 mL 溶液,向锥形瓶中滴入20.00 mL 待测溶液,再向其中滴加2滴酚酞溶液,用( 0.2000ml⋅L⁻¹盐酸标准液滴定该待测溶液。
(1)滴定终点的判断方法是 。
(2)三次平行测定的数据如下表。分别计算出三次实验标准溶液的用量,针对该滴定数据,应采取的措施是 。
(3)结合表中数据计算,烧碱样品的纯度为 (保留小数点后两位)。
(4)本实验中,如果滴定管用蒸馏水洗后未用盐酸标准液润洗,则测定结果 (填“偏高”、“偏低”或“无影响”)。
Ⅱ.测定中和反应的反应热,其数值Q可通过量热装置测量反应前后体系温度变化,用公式 Q=cρV总⋅∆t计算获得。
(5)取上述NaOH溶液和盐酸各50 mL,用简易量热计进行实验,图中仪器a的名称为 。
(6)该实验要测定盐酸的温度(t1)、NaOH 溶液的温度(t₂)和反应后体系的温度(t₂),反应前体系的温度t₃为 (用t₁、t₂、t₃表示);该过程放出的热量为 J(c和ρ分别取4.18 J·g⁻¹,℃⁻¹和 1.0g⋅mI⁻¹,忽略水以外各物质吸收的热量)。
(7)以上两个实验方案都出现了图标和,前者提示实验中应开启排风扇,后者要求实验者 (填防护措施)。
18.(14分)某实验小组在不同温度下,用2%H₂O₂溶液与不同试剂混合,利用氧气传感器测定氧气全部放出所需时间,来探究影响H₂O₂分解的化学反应速率的因素,设计如下实验:
回答下列问题:
(1)从实验1、2、3可以得出, (填离子符号)促进 H₂O₂,分解生成氧气;催化剂能增大化学反应速率的原因是 。
(2)实验1设计的目的是 。
(3)实验 (填实验序号)探究温度对 H₂O₂,分解的影响。
(4)由上述实验可知,酸 (填“抑制”或“促进”)H₂O₂分解。
(5)对于H₂O₂分解反应, Cu²⁺也有一定的催化作用。为比较 Fe³⁺和( Cu²⁺对 H₂O₂分解的催化效果,研究小组设计了如图所示的实验。请回答相关问题:
①可通过观察 ,比较得出结论。
②若反应速率a>b,有同学提出该实验不能说明 Fe³⁺对 H₂O₂分解的催化效果一定比 Cu²⁺好。结合上表中的实验,你认为将 溶液改为 溶液更为合理。
19.(16分)磁选后的炼铁高钛炉渣,主要成分有 TiO₂、SiO₂、Al₂O₃、MgO、CaO 以及少量的 Fe₂O₃。为节约和充分利用资源,通过如下工艺流程回收钛、铝、镁等。
该工艺条件下,有关金属离子开始沉淀和沉淀完全的pH见下表:
回答下列问题:
Ⅰ.(1)提高“酸溶”速率的措施有 (任写一点即可)。
(2)“水浸”后“滤液”的pH 约为2.0,在“分步沉淀”时用氨水逐步调节pH 至11.6,依次析出的金属离子是 。
(3)“水解”操作中,TiO²⁺转化为TiO₂⋅xH₂O)的离子方程式是 。分析化学上,测定 TiO²⁺酸性溶液中钛元素的含量通常涉及两步反应:①用A l粉 还原TiO²⁺得到 Ti³⁺;②用FeCl₃溶液滴定, Fe3++Ti3++H2O=Fe2++TiO2++2H+.反应②的滴定实验可选用 (填化学式)溶液作指示剂。
Ⅱ.金属钛(Ti)在工业领域有着重要用途。目前生产钛的方法之一是先将 TiO₂转化为 TiCl₄,,再进一步还原得到钛。工业上将 TiO₂转化为 TiCl₄的方法为:碳氯化法。600℃, TiO₂s与C(s)、Cl₂充分反应后,混合气体中各组分的分压如下表:
4TiO₂与C、Cl₂反应的化学方程式为 。
(5)平衡常数表达式 K= _________ ;恒温恒容时,下列叙述一定能说明该反应达到平衡状态的是 。
A.混合气体的压强保持不变 B.2vKCl2=v或TiCl4
C.混合气体的密度保持不变 D. Cl₂和CO 物质的量相等
(6)若反应容器的容积为2 L,4m in后测得固体的质量减少了47.2g ,则Cl₂的平均反应速率为 。选项
现象或事实
解释
A
用热的纯碱溶液洗去油污
Na₂CO₃可直接和油污反应
B
漂白粉在空气中久置变质
漂白粉中的 CaCl₂与空气中的 CO₂反应生成CaCO₃
C
施肥时,草木灰不能与 NH₄Cl 混合使用
CO3²⁻与NH₄⁺相互促进水解,生成氨气会降低肥效
D
FeCl₃溶液可与覆铜板制作印刷电路板
Cu 能从含有 Fe³⁺ 的溶液中置换出 Fe
容器编号
温度/℃
起始物质的量/ml
平衡物质的量/ml
H₂
SO₂
H₂
SO₂
I
300
0.3
0.1
/
0.02
Ⅱ
300
0.6
0.2
/
/
Ⅲ
240
0.3
0.1
/
0.01
滴定序号
待测液体积(mL)
消耗盐酸标准液的体积(mL)
滴定前
滴定后
1
20.00
0.50
20.60
2
20.00
3.00
22.90
3
20.00
0.00
22.10
实验序号
温度/℃
2%H₂O₂溶液的体积/mL
3 mL l ml·L⁻1的试剂
时间/s
1
25
20.00
KCl
几乎不分解
2
25
20.00
KI
82
3
25
20.00
FeCl₃
202
4
100
20.00
Kl
65
5
25
20.00
Kl 中通 HCl 气体,使其 pH=1
几乎不分解
6
25
20.00
KI 中加入 KOH 固体,使其pH=7.5
75
金属离子
Fe³⁺
Al³⁺
Mg²⁺
Ca²⁺
开始沉淀的 pH
2.2
3.5
9.5
12.4
沉淀完全( c =1.0×10⁻⁵ ml·L⁻¹)的 pH
3.2
4.7
11.1
13.8
物质
TiCl₄
CO
CO₂
Cl₂
分压(MPa)
4.59×10⁻²
1.84×10⁻²
3.70×10⁻²
5.98×10⁻⁹
河南省洛阳市强基联盟2023-2024学年高二上学期10月联考化学试题: 这是一份河南省洛阳市强基联盟2023-2024学年高二上学期10月联考化学试题,共10页。试卷主要包含了本试卷分选择题和非选择题两部分,答题前,考生务必用直径0,本卷命题范围,可能用到的相对原子质量,与反应生成的热化学方程式为等内容,欢迎下载使用。
河南省洛阳市2021-2022学年高二上学期期末化学试题 Word版含解析: 这是一份河南省洛阳市2021-2022学年高二上学期期末化学试题 Word版含解析,共36页。试卷主要包含了考试结束,将答题卡交回, 下列叙述中,正确的是, 结合图判断,下列叙述正确的是等内容,欢迎下载使用。
河南省洛阳市2022-2023学年高二上学期期中考试化学试题(Word版含答案): 这是一份河南省洛阳市2022-2023学年高二上学期期中考试化学试题(Word版含答案),共12页。试卷主要包含了选择题,填空题等内容,欢迎下载使用。












