

2024杭州高三上学期11月期中考试(一模)化学无答案
展开考生须知:
1.本试卷分试题卷和答题卷,满分100分,考试时间90分钟。
2.答题前,在答题卷密封区内填写学校、班级和姓名。
3.所有答案必须写在答题卷上,写在试卷上无效。
4.考试结束,只需上交答题卷。
可能用到的相对原子质量:H-1,C-12,O-16,N-14, Mg-24,S-32, Cl-35.5, C-59
一、选择题(本大题共16 小题,每小题3分,共48分。每小题列出的四个备选项中只有一个是符合题目要求的,不选、多选、错选均不得分)
1. 材料是人类赖以生存和发展的物质基础,下列属于新型无机非金属材料的是
A.水泥 B.碳化硅 C.橡胶 D.塑料
2. 下列化学用语表示正确的是
A.中子数为76 的碘原子:
B.乙烷的球棍模型:
C.2—丁烯的结构简式: CH₂=CHCH=CH₂
D. 用电子式表示 Na₂O 的形成过程:
3. 硫化氢是一种气体信号分子,人体中微量的 H₂S能有效预防心脏病。下列有关说法不正确的是
A. H₂S 属于弱电解质
B. H₂S可以使稀酸性高锰酸钾溶液褪色
C. H₂S 通入 CuSO₄溶液中无明显现象
D.人体内 H₂S 可由含硫蛋白质通过复杂反应产生
4. 物质的性质决定用途,下列两者对应关系正确的是
A. SO₂具有杀菌作用,用作葡萄酒中的抗氧化剂
B. SiO₂具有导电性,用于制造光导纤维
C.碳酸氢钠能与碱反应,用作食品的膨松剂
D. Na能与水反应,用作乙醚的除水剂
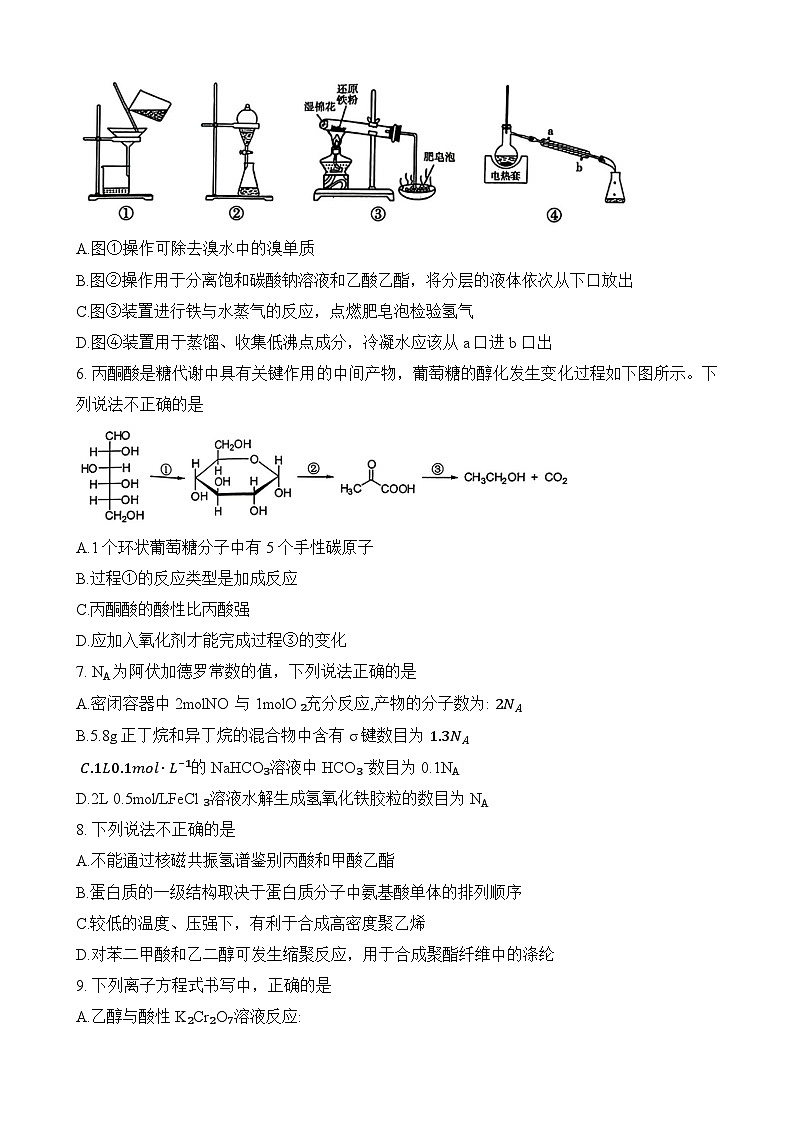
5. 下列实验能达到实验目的的是
A.图①操作可除去溴水中的溴单质
B.图②操作用于分离饱和碳酸钠溶液和乙酸乙酯,将分层的液体依次从下口放出
C.图③装置进行铁与水蒸气的反应,点燃肥皂泡检验氢气
D.图④装置用于蒸馏、收集低沸点成分,冷凝水应该从 a口进b口出
6. 丙酮酸是糖代谢中具有关键作用的中间产物,葡萄糖的醇化发生变化过程如下图所示。下列说法不正确的是
A.1个环状葡萄糖分子中有5个手性碳原子
B.过程①的反应类型是加成反应
C.丙酮酸的酸性比丙酸强
D.应加入氧化剂才能完成过程③的变化
7. NA为阿伏加德罗常数的值,下列说法正确的是
A.密闭容器中2mlNO 与1mlO₂充分反应,产物的分子数为: 2NA
正丁烷和异丁烷的混合物中含有σ键数目为 1.3NA
⋅L⁻¹的 NaHCO₃溶液中 HCO₃⁻数目为0.1NA
D.2L 0.5ml/LFeCl₃溶液水解生成氢氧化铁胶粒的数目为 NA
8. 下列说法不正确的是
A.不能通过核磁共振氢谱鉴别丙酸和甲酸乙酯
B.蛋白质的一级结构取决于蛋白质分子中氨基酸单体的排列顺序
C.较低的温度、压强下,有利于合成高密度聚乙烯
D.对苯二甲酸和乙二醇可发生缩聚反应,用于合成聚酯纤维中的涤纶
9. 下列离子方程式书写中,正确的是
A.乙醇与酸性K₂Cr₂O₇溶液反应:
CH3CH2OH+2Cr2O72−+16H+=3CH3COOH+4Cr3++11H2C
B.用氧氧化钠溶液吸收二氧化氮: 3NO2+2OH−=2NO3−+NO+H2O
C. NaHCO₃溶液与少量 Ba(OH)₂溶液混合: HCO3−+Ba2++OH−=BaCO3↓+H2O
D.Na₂S₂O₃溶液与浓硝酸溶液混合: S2O32−+2H+=S↓+SO2↑+H2O
10. 肉桂醛可利用苯甲醛、乙醛通过如下途径合成。下列说法不正确的是
A.上述反应依次经历了加成、消去的过程
B.肉桂醛与足量溴水反应生成
C.产物中可能存在副产物CH₃-CH=CH-CHO
D.肉桂醛分子的碳原子具有相同的杂化方式
11. 已知A、B、C、D是周期表中前三周期元素,且原子序数依次增大,其中A、B、C为同周期的非金属元素,且B、C原子中均有两个未成对电子,D元素s能级与p能级电子数相等,下列说法正确的是
A.原子半径:A>B>C>D B.第一电离能:A
已知: KₛₚBaCO₃=5.1×10⁻⁹,KₛₚBaSO₄=1.1×10⁻¹⁰,下列说法不正确的是
A.操作I中依据 NaCl 的溶解度估算加水量
B.操作Ⅱ和Ⅳ煮沸增大沉淀的颗粒直径,利于后续过滤
C.为了节约过滤时间,操作Ⅲ和Ⅴ可以合并进行
D. 操作Ⅵ可以借助 pH计精确控制加入盐酸的用量
13. 难溶电解质的溶度积Ksp难以被直接测量,根据溶液中相关离子浓度会对电池的电动势产生影响,可通过设计原电池将Ksp测出。某研究小组设计了下图所示的电池装置,已知该电池的电动势 E=0.0592×lgcAg+正极cAg+负极=0.34V,100.74≈5.5
下列说法不正确的是
A.电流方向是由 B→A
B.该离子交换膜是阴离子交换膜
C.KₛₚAgCl≈1.82×10⁻⁹
D.增大 AgNO₃溶液浓度会增大电池的电动势
14. 已知 NO₂g+COg⇌NOg+CO₂g在低温时分两步完成: NO₂g+NO₂g⇌ NO₃g+NOg(慢反应)、 NO₃g+COg ⇌NO₂g+CO₂g(快反应),依据该过程,下列说法错误的是:
A.反应相同时间,快反应的平均速率不一定比慢反应大
B.提高 CO 的浓度,化学反应速率将显著增大
C.该反应只有 NO₃是中间产物
D.达到平衡时,通入少量 NO₂,再次达到平衡时 NO₂的转化率降低
15. 当 25℃时,向 10mL 某浓度新制氯水中滴入 0.1ml⋅L⁻¹的 NaOH溶液,滴定曲线如图所示。已知次氯酸的电离常数为 Kₐ=2.5×10⁻⁸,下列说法正确的是
A.甲到乙发生的离子反应为:
Cl₂+2OH⁻=H₂O+ClO⁻+Cl⁻
B.乙到丁的过程中,水的电离程度一直增大
C.丙点溶液中:
cNa⁺>cClO⁻>cCl⁻>cH⁺
D.氯水中存在平衡:
Cl2ag+H2Ol⇌H+aq+Cl−aq+HClOaq该反应的平衡常数K约为 10⁻⁵
16. 探究铁单质及其化合物的性质,由操作、现象能得出正确结论的是
二、非选择题(本大题共5 小题,共52分)
17. (10分)铝是常见金属,其合金、化合物在生产生活中有重要应用。请回答:
(1)能量最低的激发态 Al³⁺的核外电子排布式是 ▲ 。
(2)铝能与H、C、N、F、Cl 等元素形成多种化合物
①下列说法不正确的是 ▲ 。
A.NaAlH₄中A l原子的杂化方式是sp²
B.化学键中离子键成分的百分数: AlF₃>AlBr₃
C.AlNH₆分子中有6对共用电子对
D.Na₃AlF₆中所有原子或离子满足8 电子稳定结构
②常温下 AlCl₃在四氯化碳中的溶解度大于 MgCl₂,,理由是 ▲ 。
③三乙基铝是一种金属有机物,结构简式为 Al、,可做高能火箭燃料,原因是 ▲ 。
(3)AlP 晶胞结构如下图所示:
①磷化铝晶胞沿着 y轴的投影图为 ▲ (填选项字母)。
②若磷化铝的晶胞边长为 apm,NA表示阿伏加德罗常数的值,则 AlP晶体的密度为 g/cm³(1pm=1.0×10⁻¹²m,用含 NA、a 的最简代数式表示)。
18. (10分)硫酸是一种重要的大宗工业化学品,应用广泛,可实现下列转化:
(1)过程Ⅰ的化学方程式为 ▲ 。
(2)已知硫酸分子结构为,过程Ⅱ生成了焦硫酸钠 Na₂S₂O₇,,画出其阴离子
的结构式 ▲ ;推测焦硫酸钠水溶液呈 ▲ (填“酸性”、“中性”或“碱性”),用离子方程式表明原因 ▲ 。
3Na₂S₂O₇,高温下具有强氧化性,受热分解产生SO3气体。过程Ⅲ是将过量Na₂S₂O₇固体与磁铁矿熔融反应,产生了混合气体。
①写出检验混合气体成分的方案 ▲ 。
②写出Na₂S₂O₇只与磁铁矿发生反应的总化学方程式 ▲ 。
(4)过量的焦硫酸 H₂S₂O₇和苯在加热条件下反应得到苯磺酸,写出反应的化学方程式 ▲ 。
19. (10分)在“碳达峰、碳中和”的明确目标下,利用CO、CO₂的甲烷化制备人造天然气既可以避免碳排放造成的资源浪费和环境污染,又可以缩短碳循环获得清洁能源。甲烷化工艺中主要涉及到如下反应:
甲烷化反应i.COg+3H2g⇌CH4g+H2Og △H1=−206.3kJ/ml
甲烷化反应 = 2 \* rman ii. NO2g+4H2g⇌CH4g+2H2Og △H2=−164.9kJ/ml
副反应iii. CO2g+H2g⇌COg+H2Og △H₃
副反应 iv.CH₄g⇌Cs+2H₂g △H₄=+74.8kJ/ml
(1)计算 △H₃= kJ/ml。
(2)为了研究Ni/TiO₂在光热和热催化过程中CO 转化率和 CH₄选择性随温度的变化,将 CO合成气(含23%CO、69%H₂和8%N₂)通入反应器,在恒压及一定时间内进行反应,测得以下数据:[α表示转化率,S(CH₄)表示得到甲烷物质的量与消耗CO 的物质的量之比]
光热催化时CO甲烷化的活化能Ea ▲ 热催化 CO 甲烷化的活化能Ea (填“大于”或者“小于”)。
②当温度高于400℃时,热催化下CO转化率降低的原因是 ▲ 。
(3)某温度下,恒容容器中充入 1ml/LCO₂和 4ml/LH₂,,若只发生反应 = 2 \* rman ii, = 3 \* rman iii,平衡时测得α(CO₂)为50%、S(CH₄)为90%,反应iii的平衡常数为 ▲ 。 [SCH₄表示得到甲烷物质的量与消耗 CO₂ 的物质的量之比]。
(4)为了进一步研究 CO₂的甲烷化反应,科学家研究催化剂 M/TiO₂(M 表示 Ni 或Ru)在 300°C光照的条件下进行反应,催化反应的核心过程表示如下:
①关于核心反应过程,下列说法正确的是 ▲ 。
A.步骤I中生成了非极性键
B.步骤Ⅲ发生的反应为 ∙ COOH→ ∙ CO+ ∙ OH( ∙ X代表吸附态中间体)
C.步骤Ⅳ中碳元素发生还原反应
D.整个反应过程中只有金属M起到催化作用
②研究发现,光诱导电子从TiO₂转移到M,富电子的M表面可以促进H₂的解离和 CO₂的活化,从而提高反应效率。已知Ni 和Ru 的电负性分别为1.91和2.20,使用 Ru/TiO₂催化剂的反应效率 ▲ (填“高于”或“低于”)使用 Ni/TiO₂作催化剂的反应效率。
20. (10分)某研究小组欲制备 CNH₃₅ClCl₂(相对分子质量为250.5),按如下流程开展实验:
(1)取用6.0mL浓氨水的仪器是 ▲ 。
(2)写出第三步的离子反应方程式 ▲ 。
(3)下列说法正确的是 ▲ 。
A.步骤Ⅰ中加入 NH₄Cl是为了控制溶液的pH处于合适范围
B.步骤Ⅱ中,为了加速反应,应一次性加入 H₂O₂
C.步骤Ⅳ中,可以通过搅拌加快过滤速度
D.步骤Ⅴ中,用浓盐酸洗涤粗产品比用水洗更适宜
(4)在步骤I、III中使用了带塞子的锥形瓶(如图所示)可提高产率,原因是 ▲ 。
(5)测定产品纯度:称取0.8350g样品,配置成250mL溶液,移取25.00mL溶液于锥形瓶中,加指示剂 K₂CrO₄用 0.01000ml/LAgNO₃标准溶液滴定至砖红色(有 Ag₂CrO₄沉淀),消耗AgNO₃标准溶液体积V₁的平均值为42.90mL;再向溶液中加适量浓 HNO₃,砖红色褪去,继续用上述 AgNO₃标准溶液滴定至砖红色(有 Ag₂CrO₄沉淀),消耗 AgNO₃标准溶液体积V₂的平均值为21.20mL。
①应该选择 ▲ (填“V₁”或“V₂”)计算产品的纯度,理由是 ▲ 。
②产品的纯度为 ▲ 。
21. (12分)化合物 G是一种生物拮抗剂的前体,它的合成路线如下所示:
请回答:
(1)A的官能团名称是 ▲ 。
(2)下列说法正确的是 ▲ 。
A.化合物B、C 都具有碱性
B. C→D 的反应类型是还原反应
C.已知用甲酸乙酯代替) HCOC₂H₅₃和D反应生成E,推测其限度相对较小
D.化合物G 的分子式是 C₉H₈ClN₄
(3)化合物 F的结构简式是 ▲ 。
(4)已知D→E的反应生成三个相同的小分子,写出化学方程式 ▲ 。
(5)写出同时符合下列条件E的同分异构的结构简式 ▲ 。
①分子中只含一个苯环、不含其它环
②可以发生银镜反应③核磁共振氢谱表明分子中有3 种不同化学环境的氢原子
完成以F为原料合成G的路线(用流程图表示,无机试剂任选) ▲ .选项
操作
现象
结论
A
向2mL 0.1ml·L⁻¹FeCl₃溶液加入 2mL 0.01ml·L⁻¹KI溶液,再滴入数滴AgNO₃溶液
出现黄色混浊
证明 FeCl₃和 KI反应存在限度
B
将Fe粉与S粉混合在惰性气体中加热,再将反应后的产物溶于稀硫酸
得到黑色固体,该固体溶于稀硫酸后得浅绿色溶液
证明Fe与S生成了FeS
C
向2mL 0.01ml·L⁻¹Fe(SCN)₃溶液加入少量 Fe粉,振荡后静置
溶液的血红色变浅
证明Fe 粉与]Fe³⁺反应,降低Fe³⁺浓度,使生成Fe(SCN)₃平衡逆向移动
D
将SO₂气体通入 Fe(NO₃)₃和BaCl₂的混合溶液
溶液的棕黄色变浅、产生白色沉淀
白色沉淀为 BaSO₃
条件 类型
温度/℃
光热催化
热催化
α(CO)
S(CH₄)
α(CO)
S(CH₄)
250
90%
85%
0%
0%
300
92%
82%
88%
78%
350
96%
84%
89%
79%
400
95%
83%
92%
78%
450
92%
82%
91%
79%
2024连云港高三上学期第一次调研考试(一模)化学无答案: 这是一份2024连云港高三上学期第一次调研考试(一模)化学无答案,共10页。试卷主要包含了下列有关说法正确的是,下列化学反应表示正确的是,硫及其化合物的转化具有重要应用等内容,欢迎下载使用。
2024南通高三上学期第一次调研测试(一模)化学PDF版无答案: 这是一份2024南通高三上学期第一次调研测试(一模)化学PDF版无答案,共6页。
化学-浙江省杭州市2023-2024学年高三上学期期中教学质量检测(一模)试题和答案: 这是一份化学-浙江省杭州市2023-2024学年高三上学期期中教学质量检测(一模)试题和答案,共10页。












