


中考化学一轮复习基本过关练习课件第9讲 常见酸、碱、盐(含解析)
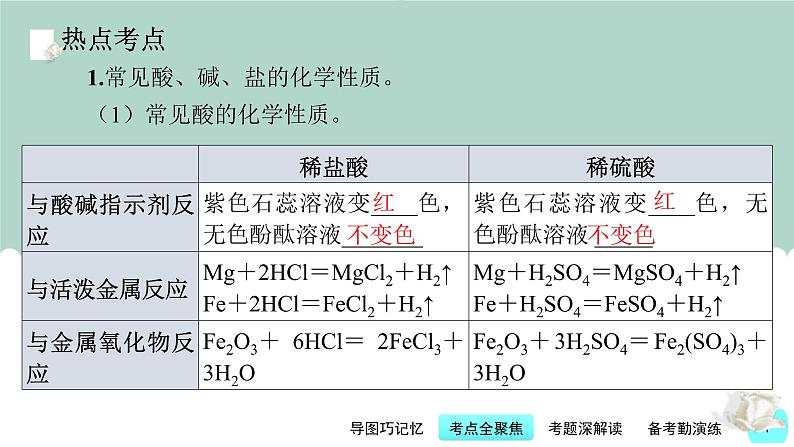
展开1.常见酸、碱、盐的化学性质。(1)常见酸的化学性质。
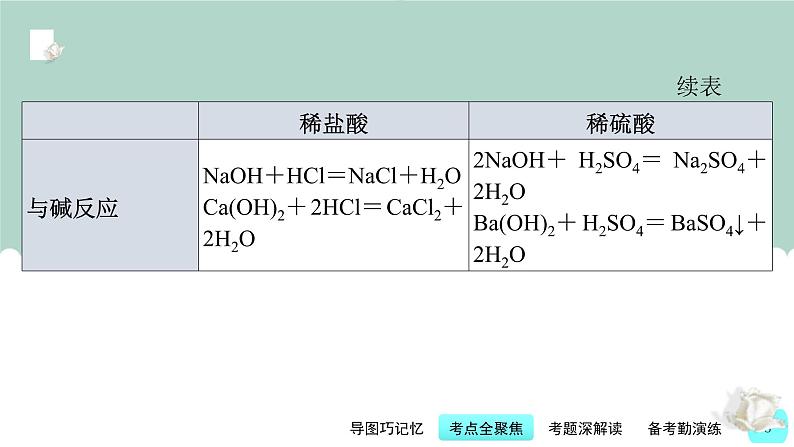
(2)常见碱的化学性质。
(3)生活中常见盐的化学性质。
(1)含义:_______跟_______作用生成盐和水的反应,叫做中和反应。(2)微观过程:氢氧化钠与盐酸反应的微观过程如图1-9-1所示。(3)应用:改变土壤的酸碱性;处理工厂废水;用于医疗,如用含氢氧化铝的药物治疗胃酸过多,用含碱性物质的溶液涂抹蚊虫叮咬处来减轻痛痒等。
【特别提示】中和反应生成盐和水,但生成盐和水的反应不一定是中和反应,只有酸跟碱反应才叫中和反应。
3.溶液的酸碱性与pH。(1)溶液的酸碱性与酸碱指示剂的变色。常用的酸碱指示剂如紫色石蕊溶液、无色酚酞溶液,在酸、碱溶液中显示的颜色如下表。
(2)溶液的酸碱性与pH的关系。溶液的酸碱性强弱程度,即酸碱度常用pH表示,pH的范围在0~14之间。当pH<7时,溶液显_______,且pH越小,酸性越强;当pH=7时,溶液显_______;当pH>7时,溶液显_______,且pH越大,碱性越强。
【特别提示】酸溶液的pH<7,能使紫色石蕊溶液变红色,不能使无色酚酞溶液变色;碱溶液的pH>7,能使紫色石蕊溶液变蓝色,无色酚酞溶液变红色。要注意的是,能使紫色石蕊溶液变红色、pH<7的溶液不一定是酸溶液,但一定是酸性溶液;同理,能使紫色石蕊溶液变蓝色、无色酚酞溶液变红色、pH>7的溶液不一定是碱溶液,但一定是碱性溶液。如碳酸钠溶液的pH>7,能使紫色石蕊溶液变蓝色,无色酚酞溶液变红色,但它不是碱溶液而是盐溶液。
重要考点4.常见酸、碱、盐的主要用途。
5.浓硫酸的稀释。浓硫酸溶于水会放出大量的热,因此,稀释浓硫酸一定要把_______沿着容器壁慢慢注入_______里,并用玻璃棒不断搅拌。6.溶液的酸碱性与人体健康和农作物生长的关系。(1)人的体液必须维持在一定的酸碱度范围内,否则就可能导致疾病。不同酸碱度体液的人可选择食用合适酸碱性的食物,来调节体液的酸碱度。(2)不同农作物适宜生长的土壤酸碱度各不相同,有的适宜偏酸性,有的适宜偏碱性,大多数适宜生长在接近中性的土壤里。可通过施用不同酸碱性的物质或肥料来调节土壤的酸碱度,使之适合农作物生长。
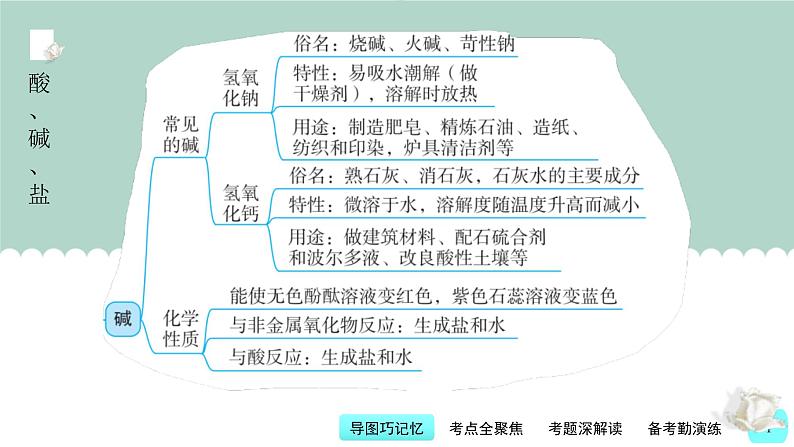
8.NaOH、Ca(OH)2的俗名和主要物理性质。
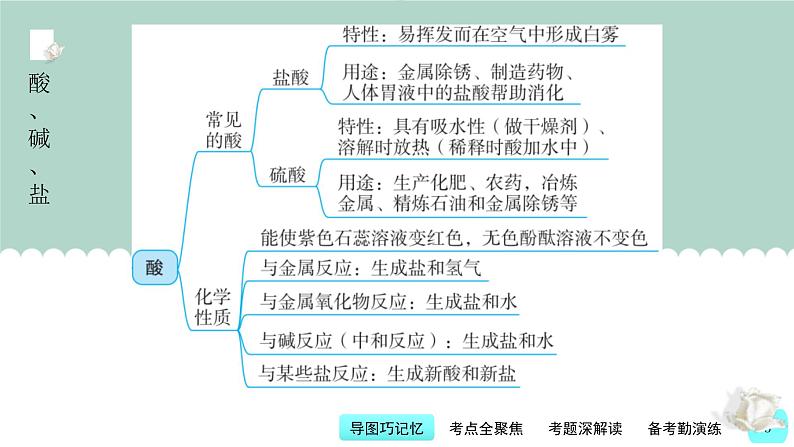
9.盐酸、硫酸的物理特性。(1)浓盐酸:易挥发,打开试剂瓶塞,瓶口出现大量白雾。(2)浓硫酸的特性。①强腐蚀性:能夺取纸张、木材、布料、皮肤里的水分,生成黑色的炭,所以使用时要十分小心。②强吸水性:能吸收空气、气体中的水分但不发生反应。
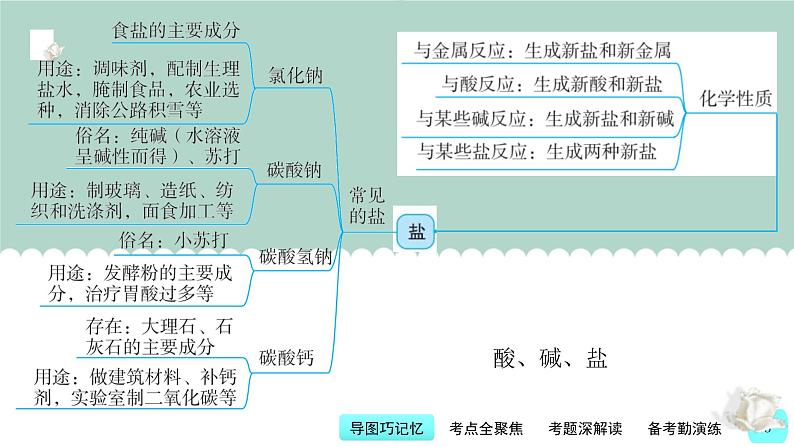
10.几种常见盐的比较。
11.酸或碱具有相似化学性质的原因。(1)酸:不同的酸溶液中都含有相同的H+。(2)碱:不同的碱溶液中都含有相同的OH-。【误区警示】酸溶液中都含有相同的H+,但含有H+的溶液不一定是酸溶液,只有阳离子全部是H+的溶液才是酸溶液;同理,碱溶液中都含有相同的OH-,但含有OH-的溶液不一定是碱溶液,只有阴离子全部是OH-的溶液才是碱溶液。
12.溶液的导电性。溶液能导电的原因是溶质溶于水时解离出自由移动的离子。
考点2 常见的酸及其性质和用途
考点3 常见的碱及其性质与用途
考点4 中和反应及其应用
考点5 常见的盐及其性质和用途
考点6 常见物质或离子在溶液中的共存
考点1 酸碱性与pH[2022年柳州13、桂林37、百色15、玉林12;2021年桂林11、河池24(2)]典型真题1(2022年云南省中考题)天宫课堂中,宇航员通过实验呈现了“奥运五环”。该实验中使用了指示剂——溴百里酚蓝,溴百里酚蓝溶液在不同环境中的显色情况如下表:下列溶液能使绿色溴百里酚蓝溶液变黄色的是( )。A.氯化钠溶液B.醋酸溶液C.氢氧化钾溶液D.碳酸钠溶液
【名师精讲】 根据溴百里酚蓝溶液在不同酸碱性溶液中的显色情况可知,绿色溴百里酚蓝溶液遇酸性溶液可变为黄色。氯化钠溶液显中性,不能使绿色溴百里酚蓝溶液变色;醋酸溶液显酸性,能使绿色溴百里酚蓝溶液变黄色;氢氧化钾溶液显碱性,使绿色溴百里酚蓝溶液变蓝色;碳酸钠溶液显碱性,使绿色溴百里酚蓝溶液变蓝色。【思维点拨】中考中还考查溶液pH的测定、变化、调节,酸碱性对农作物生长、人体健康的影响等。
考点2 常见的酸及其性质和用途[2022年北部湾20(2)、柳州18、河池14;2021年北部湾15、河池7]典型真题2(2022年江苏省泰州市中考题)硫酸是重要的化工原料。下列有关硫酸的说法错误的是( )。A.浓硫酸具有吸水性B.稀硫酸能与纯碱反应C.浓硫酸稀释时温度降低D.稀硫酸可用于金属表面除锈
【名师精讲】 浓硫酸具有吸水性,在实验室常用作干燥剂;纯碱是碳酸钠的俗名,碳酸钠能与稀硫酸反应生成硫酸钠、水和二氧化碳;浓硫酸能溶于水,与水混合时,放出大量的热,溶液温度会升高;铁锈的主要成分是氧化铁,能与稀硫酸反应生成硫酸铁和水,所以稀硫酸能用来去除铁锈。【思维点拨】浓硫酸、浓盐酸的物理特性,稀硫酸、稀盐酸的化学性质与用途都是各地中考考查的重点,但这些知识点大多分散在各种题型的题目中进行考查,集中考查的题目较少。
考点3 常见的碱及其性质与用途[2022年柳州11和18、桂林17(6)、梧州3;2021年百色23(5)、梧州13]典型真题3(2022年辽宁省盘锦市中考题)下列关于氢氧化钠的描述错误的是( )。A.易与空气中某些成分反应而变质B.蚊虫叮咬后涂抹NaOH溶液可减轻痛痒C.能去除油污,可做炉具清洁剂D.氢氧化钠溶液能使紫色石蕊溶液变蓝色
【名师精讲】 氢氧化钠易与空气中的二氧化碳反应生成碳酸钠和水;蚊虫叮咬后会在皮肤上留下蚁酸,可涂肥皂水或稀碳酸氢钠溶液减轻痛痒,不能涂抹氢氧化钠溶液,因为氢氧化钠溶液具有强腐蚀性;氢氧化钠能与油脂反应,在生活中可用于配制炉具清洁剂;氢氧化钠溶液显碱性,能使紫色石蕊溶液变蓝色。【思维点拨】一些碱溶液与某些非金属氧化物(如氢氧化钠溶液与二氧化碳)、酸(如氢氧化钠、氢氧化钙与盐酸)反应时没有明显的实验现象,对于这样的反应,可采用加酸碱指示剂或检验反应产物的方法来证明这些反应的发生。
考点4 中和反应及其应用(2022年百色15、贵港10;2021年百色17)典型真题4(2022年广西贵港市中考题)图1-9-2是氢氧化钾溶液与稀盐酸反应的微观示意图,下列有关该反应的说法错误的是( )。
A.生成的氯化钾由离子构成B.反应前后氯离子的数目不变C.反应的实质是OH-与H+结合生成H2OD.反应后溶液中存在的粒子只有K+、Cl-
【名师精讲】 由氢氧化钾溶液与稀盐酸反应的微观示意图可以看出:反应前溶液中存在K+、OH-、H+、Cl-四种离子及水分子,反应后生成了K+、Cl-、H2O三种粒子,因此,生成的氯化钾由K+、Cl-构成,反应前后K+、Cl-的数目不变,反应的实质是OH-与H+结合生成H2O。【思维点拨】中和反应的现象、反应过程中溶液的pH变化及其曲线都是中考考查的热点,此类题常要求根据pH曲线分析中和反应的实验操作、反应过程和溶液中溶质的变化等。pH逐渐增大是将碱溶液加入酸溶液中,溶质的变化是酸→酸、盐→盐→盐、碱;pH逐渐减小则是将酸溶液加入碱溶液中,溶质的变化是碱→碱、盐→盐→盐、酸。
考点5 常见的盐及其性质和用途[2022年柳州11、桂林17(5)、河池22(5)、贺州12;2021年桂林17(1)(6)、贵港5与21、河池15与22(5)]典型真题5(2022年江苏省扬州市中考题)石灰石的主要成分是 CaCO3。下列说法不正确的是( )。A.CaCO3属于碳酸盐B.贝壳和珍珠中含有CaCO3C.CaCO3易溶于水D.CaCO3可用作补钙剂
【思维点拨】各地中考对常见盐的性质和用途的考查主要集中在氯化钠、碳酸钠、碳酸氢钠、碳酸钙的重要化学性质和用途上,如氯化钠用作调味品、配制生理盐水,碳酸钠溶液与石灰水反应制取少量氢氧化钠溶液,碳酸钙与稀盐酸反应制取二氧化碳等。
【思维点拨】离子能否共存,其实质就是离子间能否结合生成沉淀、气体或水,离子间能结合生成沉淀、气体或水则不能共存;否则能共存。中考中除考查离子共存外,也考查物质共存问题。物质在溶液中能否共存,取决于物质之间会不会发生反应生成气体、沉淀或水,若不会则能共存。溶液无色是指溶液中不含显示特殊颜色的离子,中考中常见具有特殊颜色的离子有Cu2+显蓝色,Fe2+显浅绿色,Fe3+显黄色等。
1.(2022年柳州,基础达标)化学课堂上老师给同学们变“魔术”:往浸过酚酞溶液的白色纸花上喷某种无色溶液,白色纸花瞬间变成了红色。老师喷的溶液可能是( )。A.水B.稀盐酸C.氨水D.氯化钠溶液
2.(2022年玉林,基础达标)下面是一些日用品的近似pH,其中呈酸性的是( )。A.洗手液pH≈7.0B.肥皂pH≈10.5C.牙膏pH≈9.0D.高效洁厕剂pH≈2.0
3.(2022年潍坊,基础达标)下列溶液的pH最大的是( )。A.使石蕊溶液显红色的溶液B.使酚酞溶液显红色的溶液C.使石蕊溶液显紫色的溶液D.使酚酞溶液显无色的溶液
4.(2021年南京,基础达标)某同学想用pH试纸测定一些物质的pH,下列做法能达到实验目的的是( )。A.用干燥的pH试纸测定白醋的pHB.用干燥的pH试纸测定二氧化碳气体的pHC.用干燥的pH试纸测定98%的浓硫酸的pHD.用湿润的pH试纸测定0.4%的氢氧化钠溶液的pH
5.(2022年聊城,能力提升)图1-9-3是几种常见物质溶于水后发生解离的微观示意图,其中能使紫色石蕊溶液变红色的是( )。
6.(2020年贺州,能力提升)某同学在家做实验,将自制的黄色花汁分别滴入不同液体中,记录的现象如下表。下列说法错误的是( )。A.该花汁可作酸碱指示剂 B.该花汁滴入碳酸氢钠溶液中变黄色C.常温下该花汁的pH可能是7 D.该花汁滴入稀盐酸中变红色
7.(2022年河池,基础达标)浓硫酸是一种常用的气体干燥剂。下列气体不能用浓硫酸干燥的是( )。A.二氧化碳B.氧气C.一氧化碳D.氨气
8.(2022年娄底,基础达标)下列物质不能与盐酸反应的是( )。A.CO2D.NaOH
9.(2022年长沙,基础达标)“酸”对我们来说一定不陌生。下列说法正确的是( )。A.稀盐酸不能用于除铁锈B.浓硫酸具有腐蚀性C.浓盐酸没有挥发性D.稀盐酸能使无色酚酞溶液变红色
11.(2022年陕西,能力提升)如图1-9-4所示,稀硫酸能与相连的物质发生化学反应。(1)稀硫酸与BaCl2溶液反应的现象是____________。(2)写出稀硫酸与CuO反应的化学方程式:____________________。(3)若X可用作钾肥,其化学式为________。
CuO+H2SO4=CuSO4+H2O
12.(2022年福建,能力提升)某兴趣小组的同学用稀盐酸清洗铁夹表面的铁锈(主要成分为氧化铁),并进行保护实验。(1)除铁锈的反应属于____________(填基本反应类型)。(2)铁夹在稀盐酸中浸泡较长时间有气体产生。产生气体的化学方程式为________________________。(3)将清洗过的铁夹进行发蓝处理,可在其表面形成致密的氧化物保护膜,该保护膜的主要成分与铁在氧气中燃烧的产物相同,该氧化物的化学式为______。(4)验证该实验的废液显酸性,可选用的一种试剂或用品是____________________________________。
Fe+2HCl=FeCl2+H2↑
pH试纸(或紫色石蕊溶液,合理即可)
(5)用氢氧化钠中和废液中的盐酸,反应的化学方程式为________ _____________________________。
HCl+NaOH=NaCl+H2O
13.(2021年邵阳,基础达标)下列关于氢氧化钠的描述错误的是( )。A.对皮肤有强烈的腐蚀作用B.其水溶液能使石蕊溶液变红色C.能去除油污,可作炉具清洁剂D.易溶于水,溶解时放出热量
14.(2022年吉林,基础达标)下列NaOH和Ca(OH)2的用途错误的是( )。A.用Ca(OH)2制波尔多液B.用Ca(OH)2改良酸性土壤C.用NaOH溶液检验CO2D.用NaOH固体干燥某些气体
15.(2022年舟山,基础达标)一瓶存放较长时间的石灰水,瓶内壁附有一层白膜。下列有关说法错误的是( )。A.白膜的成分是氢氧化钙B.白膜的形成与二氧化碳有关C.白膜可用盐酸除去D.试剂使用后应及时盖上瓶塞
16.(2022年杭州,能力提升)如图1-9-5所示,分别向四支试管中加入饱和石灰水,使其与试管内的溶液充分反应。无论加入多少饱和石灰水,反应后试管内的溶液一定呈碱性的是( )。A.①B.②C.③D.④
(1)反应①中,若把酚酞溶液滴加到氢氧化钠溶液中,观察到的现象是___________________。
17.(2022年新疆,能力提升)归纳总结是学习化学的重要方法,小明用思维导图总结了NaOH的四条化学性质(如图1-9-6甲所示),即NaOH能与四类物质发生化学反应。请回答:
(3)反应③可以选用的盐是______(填序号),你的选择依据是____________________________________________。A.NaNO3D.KNO3
(2)写出一个符合反应②的化学方程式:______________________________________。小红将某稀酸溶液逐滴滴入一定量的稀氢氧化钠溶液中,用温度传感器对反应过程中溶液的温度进行实时测定,得到的曲线如图1-9-6乙所示,根据图像可知该反应是______(填“吸热”或“放热”)反应。
2NaOH+H2SO4=Na2SO4+2H2O(合理即可)
发生复分解反应要有气体、沉淀或水生成
(4)二氧化碳和一氧化碳都是非金属氧化物,二氧化碳能和氢氧化钠反应,一氧化碳却不能,造成此性质差异的微观原因是_____________ ______________________________。
18.(2022年永州,能力提升)某化学兴趣小组的同学探究氢氧化钙的性质。Ⅰ.查阅资料:①氢氧化钙是白色粉末状固体;②氢氧化钙的溶解度曲线如图1-9-7所示。
Ⅱ.实验探究过程如图1-9-8所示。
请回答下列问题:(1)甲、乙两名同学各取1 g Ca(OH)2粉末放入试管中,再加入3 mL水,振荡后,都可观察到试管内呈现______色悬浊液。(2)甲同学:将悬浊液静置后,取上层清液于另一支试管中,通入CO2,观察到溶液变白色浑浊,该白色浑浊物是______(填化学式)。
(3)乙同学:①向悬浊液中滴入2滴酚酞溶液,振荡、静置后,观察到上层溶液呈红色,下层悬浊物呈粉红色;然后向试管中逐滴加入稀盐酸,观察到上层红色溶液逐渐变为无色,发生反应的化学方程式是_______________________________。②再将试管振荡、静置后,观察到试管上层清液又呈现________色,其原因是_________________________ ___________________________________。
Ca(OH)2 +2HCl=CaCl2 +2H2O
温度降低,Ca(OH)2溶解度增大,溶液呈碱性
19.(2022年铜仁,基础达标)从不同的角度认识NaOH+HCl = NaCl+H2O,下列说法正确的是( )。A.基本反应类型:中和反应B.反应实质:氢离子与氧氧根离子结合生成水C.反应物:氢氧化钠可以用来治疗胃酸过多D.读法:氢氧化钠加氯化氢完全反应生成氯化钠加水
20.(2020年河池,基础达标)下列应用利用了中和反应原理的是( )。A.用稀盐酸除去铁钉表面的铁锈B.用纯碱除去面团发酵时产生的酸C.用硫酸处理工业废水中的碱D.用石灰乳与硫酸铜溶液配制波尔多液
21.(2022年湘潭,能力提升)向一定量的氢氧化钠溶液中逐滴加入稀硫酸至过量。水的质量、氢氧化钠的质量、硫酸钠的质量随稀硫酸质量变化的关系如图1-9-9所示。下列说法错误的是( )。
A.丙代表硫酸钠的质量B.加入m g稀硫酸时,两者恰好完全反应C.a点对应的溶液中溶质有三种D.b点对应的溶液能使紫色石蕊溶液变红色
22.(2022年泰安,能力提升)将氢氧化钾溶液与稀硫酸混合,观察不到明显现象,为证明氢氧化钾溶液与稀硫酸发生了反应,某化学兴趣小组的同学进行了以下实验:
(1)测溶液pH变化。甲同学在实验过程中测得溶液的pH变化如图1-9-10甲所示,则该同学的操作是_______(填序号)。A.将氢氧化钾溶液滴入稀硫酸中B.将稀硫酸滴入氢氧化钾溶液中
(2)测溶液的温度变化。乙同学在实验过程中测得反应混合溶液的温度变化如图1-9-10乙所示,说明稀硫酸与氢氧化钾溶液发生的反应是________(填“放热”或“吸热”)反应。图1-9-10乙中B点的含义是_________________________。
KOH和H2SO4恰好完全反应
(3)借助酸碱指示剂判断。丙同学进行图1-9-10丙所示实验,他观察到的现象是______________________________________________________________________________,也证明氢氧化钾溶液与稀硫酸发生了化学反应,反应的化学方程式为_________________________________。
向烧杯中滴加酚酞溶液后,溶液由无色变为红色;再滴加稀硫酸,溶液由红色变成无色
2KOH+H2SO4=K2SO4+2H2O
23.(2021年河池,基础达标)制作包子、蛋糕所用的发酵粉的主要成分为碳酸氢钠。碳酸氢钠的俗称是( )。A.小苏打B.苏打C.苛性钠D.火碱
24.(2022年海南,基础达标)航天员王亚平在中国空间站表演“五环魔术”,她往碳酸钠溶液中加入溴百里酚蓝试剂,溶液呈现鲜亮的蓝色。若将溴百里酚蓝加入盐酸中,则溶液呈现黄色。下列有关说法错误的是( )。A.溴百里酚蓝可作为酸碱指示剂B.碳酸钠的化学式为Na2CO3C.碳酸钠溶液呈碱性D.碳酸钠属于碱
25.(2021年扬州,基础达标)氯化钠是一种常见的化学物质。下列说法不正确的是( )。A.氯化钠是常见的食品调味剂B.氯化钠可用于生产氯气、烧碱C.蒸发海水即可获得纯净的氯化钠固体D.氯化钠可用于腌制食品
26.(2022年重庆,能力提升)侯氏制碱法的原理为NaCl+H2O+NH3+CO2=NaHCO3↓+ NH4Cl。下列说法不正确的是( )。A.两种产物均属于盐B.反应后的溶液中不含碳酸氢钠C.常温下NaCl溶液的pH=7D.该反应消耗CO2,体现了碳中和
27.(2021年临沂,能力提升)图1-9-11是“盐的化学性质”思维导图,下表是部分物质的溶解性表(室温)。利用图表提供的信息回答下列问题:
(1)如果反应①中的金属为铝,选用的盐是________(填化学式)。(2)若反应②③属于复分解反应,发生反应的实质是____________ _______________________。(3)写出一个符合反应④的化学方程式:______________________。
两种物质相互交换成分,有沉淀生成
CaCO3+2HCl=CaCl2+CO2↑+H2O(或Na2CO3+2HCl=2NaCl+H2O+CO2↑)
29.(2022年百色,能力提升)下列各组物质在水中能大量共存,且形成无色透明溶液的是( )。A.Cu(NO3)2、KCl、HClB.K2SO4、NaOH、NH4ClC.HNO3、NaCl、Ca(OH)2D.KNO3、Na2SO4、NaCl
1.下列物质名称与化学式的对应关系错误的是( )。A.烧碱——NaOHB.纯碱——Na2CO3C.小苏打——NaHCO3D.熟石灰——CaO
2.打开存放下列物质的试剂瓶瓶塞,能观察到瓶口有白雾生成的是( )。A.氢氧化钠B.浓盐酸C.生石灰D.浓硫酸
3.化学就在我们身边。下列做法合理的是( )。A.用熟石灰改良酸性土壤B.用氢氧化钠溶液治疗胃酸过多C.用浓硫酸作食品干燥剂D.用自来水除去铁制品表面的铁锈
4.了解溶液的酸碱性,对于生活、生产以及人类的生命活动具有重要的意义。下表列出了一些物质在常温下的近似pH,下列有关说法正确的是( )。 A.患有胃病的人应多喝柠檬水B.蚊虫叮咬人时,会在人的皮肤内分泌出蚁酸,使叮咬处肿大、痛痒,可用肥皂水涂抹,减轻痛痒C.用炉具清洁剂去除厨具上的油污和用洗涤剂洗掉衣服、餐具上的油污原理相同D.常温下将牛奶加水稀释,其pH大于7
5.图1-9-12甲为稀盐酸和氢氧化钠溶液反应的实验操作示意图,图1-9-12乙为反应过程中烧杯内溶液pH的变化曲线。下列说法不正确的是( )。
A.胶头滴管中的溶液为氢氧化钠溶液B.b点表示溶液中氢氧化钠和盐酸恰好完全反应C.a点对应的溶液能使酚酞溶液变红D.c点对应的溶液中溶质是NaCl和HCl
7.化学兴趣小组的同学在验证硫酸的性质时,进行了图1-9-13所示实验:
(1)实验一:浓硫酸稀释过程中的能量变化。
实验中,观察到用石蜡固定在铜片下的乒乓球脱落,此现象说明浓硫酸溶于水______(填“吸热”或“放热”)。(2)实验二:浓度对硫酸化学性质的影响。实验中,观察到滤纸______(填“A”
或“B”)很快变黑,由此可知,硫酸的浓度不同,腐蚀性不同。
Zn+H2SO4=ZnSO4+H2↑
固体逐渐溶解,溶液由无色变为黄色
(3)实验三:稀硫酸的化学性质。①试管1中发生反应的化学方程式为______________________________。②试管2中可观察到的现象是________________________________________。③向试管3中滴加足量稀硫酸仍无明显
现象,要证明二者已经发生反应,可选用________(填序号)继续进行实验,以达到实验目的。A.酚酞溶液B.氯化钡溶液C.硫酸铜溶液
8.某化学兴趣小组的同学设计实验探究氢氧化钠的性质,请你参与他们的探究。
产生蓝色沉淀,溶液由蓝色变为无色
(1)实验过程与分析:请写出实验1的实验现象。
(2)实验反思与拓展:①实验1发生反应的化学方程式为____________________________ _______________。②某同学认为实验2的结论不正确,他改进了该实验方案:先向氢氧化钠溶液中滴入几滴酚酞溶液并振荡,再滴入稀硫酸,观察到溶液由________色变为无色,由此表明氢氧化钠与硫酸已经发生了反应,该反应的化学方程式为_____________________________。
2NaOH+CuSO4=Cu(OH)2↓+ Na2SO4
2NaOH+H2SO4=Na2SO4+2H2O
第9讲 常见酸、碱、盐-【精美课件】备战2023年中考化学一轮复习课件: 这是一份第9讲 常见酸、碱、盐-【精美课件】备战2023年中考化学一轮复习课件,共60页。PPT课件主要包含了热点考点,重要考点,一般考点,不变色,中和反应,浓硫酸,苛性钠,熟石灰,消石灰,考点1酸碱性与pH等内容,欢迎下载使用。
中考化学一轮复习基本过关练习课件第11讲 常见有机物与化学合成材料(含解析): 这是一份中考化学一轮复习基本过关练习课件第11讲 常见有机物与化学合成材料(含解析),共23页。PPT课件主要包含了热点考点,重要考点,一般考点,烧焦羽毛,刺激性气味,聚氯乙烯,污染空气,塑料制品,可降解,各种废弃塑料等内容,欢迎下载使用。
中考化学复习---酸、碱、盐课件PPT: 这是一份中考化学复习---酸、碱、盐课件PPT,共11页。PPT课件主要包含了酸的化学性质5,碱的化学性质4,盐的化学性质4,复分解反应,溶解沉淀表等内容,欢迎下载使用。












