

2024重庆市八中高三上学期高考适应性月考(二)化学含答案
展开注意事项:
1.答题前,考生务必用黑色碳素笔将自己的姓名、准考证号、考场号、座位号在答题卡上填写清楚。
2.每小题选出答案后、 用2B铅笔把答题卡上对应题目的答案标号涂黑,如需改动,用橡皮擦干净后,再选涂其他答案标号。在试题卷上作答无效。
3.考试结束后,请将本试卷和答题卡一并交回。满分100分, 考试用时75分钟。
可能用到的相对原子质量:H—l Li—7 C—12 N—14 0—16 Si—28 S—32Cl—35.5 Mn—55 Fe—56 C—59
一、选择题:本题共14小题,每小题3分, 共42分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1. 下列说法错误的是
A. 战国青铜器属于金属材料
B. 脲醛树脂可用于生产电器开关
C. 氢氟酸具有弱酸性,因此可刻蚀玻璃
D. 同服补铁剂与维生素 C可提高补铁效果
2. 只改变一个影响因素,下列关于化学平衡说法错误的是
A. 平衡常数改变后,化学平衡一定发生移动
B. 化学平衡移动后,平衡常数不一定改变
C. 平衡正向移动,反应物的转化率一定增大
D. 正反应速率大于逆反应速率,平衡一定正向移动
3. 设NA为阿伏加德罗常数的值,下列有关说法错误的是
A. 46g乙醇中sp³杂化的原子数为3NA
₃4²⁺中σ键的个数为2.4NA
C. 40gSiC晶体中含有的共价键数为4NA
D. 0.5ml羟基中含有的电子数为4.5NA
4. 下列方程式正确的是
A. 向碳酸氢铵溶液中加入足量石灰水: Ca2++HCO3−+OH−=CaCO3↓+H2O
B.向苯酚钠溶液中通入少量 CO₂:2C₆H₅ONa+CO₂+H₂O→2C₆H₅OH+Na₂CO₃
C. 泡沫灭火器灭火的原理: 2Al3++3CO32−+3H2O=21l0H3↓+3CO2↑
D. 含 1ml FeBr₂的溶液中通入 1 mlCl₂:2Fe²⁺+2Br−+lCl₂=2Fe³⁺+Br₂+4Cl⁻
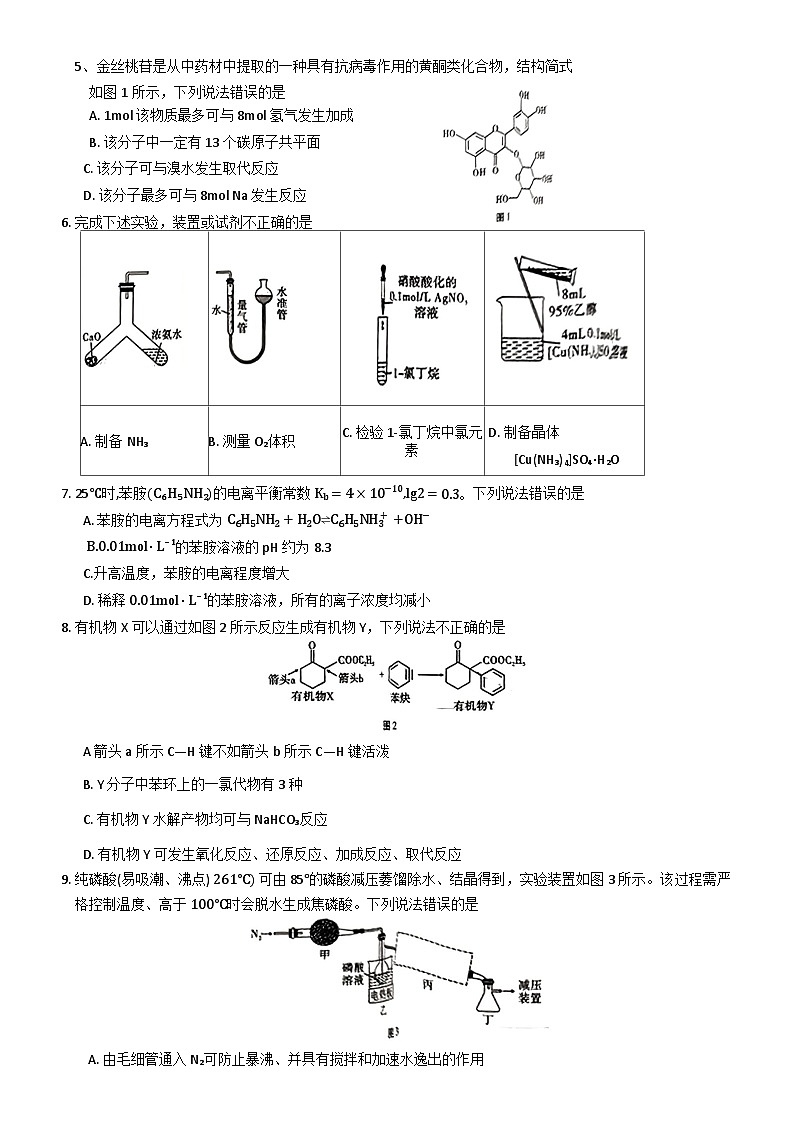
5、金丝桃苷是从中药材中提取的一种具有抗病毒作用的黄酮类化合物,结构简式如图1所示,下列说法错误的是
A. 1ml 该物质最多可与 8ml氢气发生加成
B. 该分子中一定有13个碳原子共平面
C. 该分子可与溴水发生取代反应
D. 该分子最多可与 8ml Na 发生反应
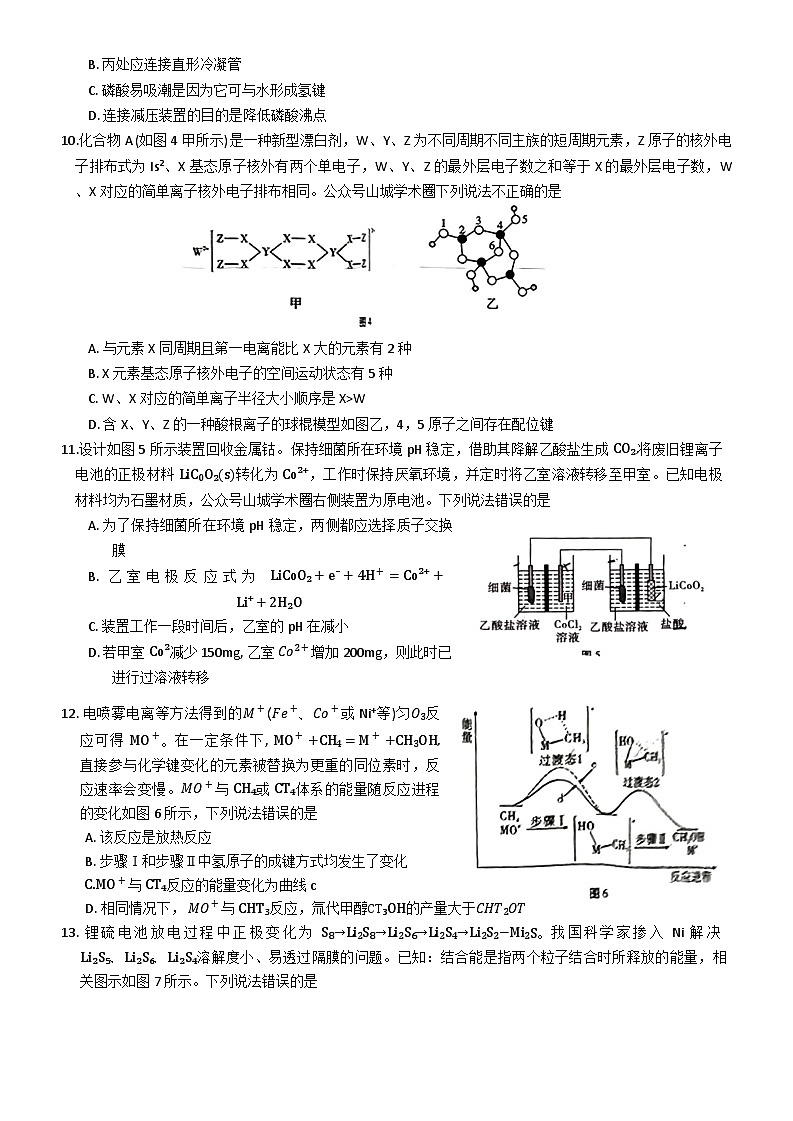
6. 完成下述实验,装置或试剂不正确的是
7. 25℃时,苯胺C₆H₅NH₂的电离平衡常数 Kb=4×10−10,lg2=0.3。下列说法错误的是
A. 苯胺的电离方程式为 C6H5NH2+H2O⇌C6H5NH3++OH−
⋅L⁻¹的苯胺溶液的 pH约为8.3
C.升高温度,苯胺的电离程度增大
D. 稀释 0.01ml⋅L⁻¹的苯胺溶液,所有的离子浓度均减小
8. 有机物X可以通过如图2所示反应生成有机物 Y,下列说法不正确的是
A 箭头a所示 C—H键不如箭头b所示C—H键活泼
B. Y 分子中苯环上的一氯代物有3种
C. 有机物Y水解产物均可与 NaHCO₃反应
D. 有机物Y可发生氧化反应、还原反应、加成反应、取代反应
9. 纯磷酸(易吸潮、沸点) 261°C) 可由85°的磷酸减压萎馏除水、结晶得到,实验装置如图3所示。该过程需严格控制温度、高于 100°C时会脱水生成焦磷酸。下列说法错误的是
A. 由毛细管通入 N₂可防止暴沸、并具有搅拌和加速水逸出的作用
B. 丙处应连接直形冷凝管
C. 磷酸易吸潮是因为它可与水形成氢键
D. 连接减压装置的目的是降低磷酸沸点
10.化合物A (如图4甲所示) 是一种新型漂白剂,W、Y、Z为不同周期不同主族的短周期元素,Z原子的核外电子排布式为Is2、X基态原子核外有两个单电子,W、Y、Z的最外层电子数之和等于X 的最外层电子数,W、X 对应的简单离子核外电子排布相同。公众号山城学术圈下列说法不正确的是
A. 与元素X同周期且第一电离能比X大的元素有2种
B. X元素基态原子核外电子的空间运动状态有5种
C. W、X对应的简单离子半径大小顺序是X>W
D. 含X、Y、Z的一种酸根离子的球棍模型如图乙,4,5 原子之间存在配位键
11.设计如图5所示装置回收金属钴。保持细菌所在环境pH稳定,借助其降解乙酸盐生成 CO₂,将废旧锂离子电池的正极材料 LiC0O₂s转化为 C²⁺,工作时保持厌氧环境,并定时将乙室溶液转移至甲室。已知电极材料均为石墨材质,公众号山城学术圈右侧装置为原电池。下列说法错误的是
A. 为了保持细菌所在环境pH稳定,两侧都应选择质子交换膜
B. 乙室电极反应式为 LiCO₂+e⁻+4H+=C²⁺+ Li⁺+2H₂O
C. 装置工作一段时间后,乙室的pH在减小
D. 若甲室 C²减少 150mg, 乙室 C2+增加200mg,则此时已进行过溶液转移
12. 电喷雾电离等方法得到的M+(Fe+、C+或Ni⁺等)匀O3反应可得 MO+。在一定条件下, MO++CH4=M++CH3OH,直接参与化学键变化的元素被替换为更重的同位素时,反应速率会变慢。MO+与 CH₄或 CT₄体系的能量随反应进程的变化如图6所示,下列说法错误的是
A. 该反应是放热反应
B. 步骤Ⅰ和步骤Ⅱ中氢原子的成键方式均发生了变化
C.MO+与 CT₄反应的能量变化为曲线c
D. 相同情况下, MO+与 CHT₃反应,氚代甲醇CT3OH的产量大于CHT2OT
13. 锂硫电池放电过程中正极变化为 S8→Li2S8→Li2S6→Li2S4→Li2S2−Mi2S。我国科学家掺入 Ni解决 Li₂S₅、Li₂S₆、Li₂S₄溶解度小、易透过隔膜的问题。已知:结合能是指两个粒子结合时所释放的能量,相关图示如图7所示。下列说法错误的是
A. 放电时,电池的总反应方程式为 16Li+xS8=8Li2Sx1≤x≤8
B. 放电一段时间后,电解质溶液增重0.14g,电路转移0.02ml电子
C. 电池充电时间越长,电池中 Li₂S的量越少
D. Ni对 Li₂Sx的吸附能力相较于石墨烯更强
14. 煤的气化是一种重要的制氢途径。在一定温度下,向体积固定的密闭容器中加入足量C(s)的和 2mlH₂Og,起始压强为0、4MPa时,发生下列反应生成水煤气:
I.Cs+H₂Og=−COg+H₂gΔH₁=+131.4kJml
Ⅱ.COg+H₂Og=CO₂g+H₂g△H₂=−41、1kJm--1下列说法错误的是
A. 平衡后,升高温度,CO的含量会增大
B. 平衡时 CO₂的体积分数不大于13
C. 平衡时、 H₂Og的转化率为 60%,CO 的物质的量为0.4ml,则整个体系会放出热量
D. 在相同条件下、维持压强为0、4MPa达到平衡,所得 H₂含量会更高
二、非选择题:本题共4小题,共58分。
15. (14分) 钴配合物 fCNH₃₆]Cl₃溶于热水,在冷水电微溶,实验室中可由金属钴及其他原料制备。
(一) CCl₂的制备
CCl₂易潮解、公众号山城学术圈实验室中利用如图8所示装置(连接用橡胶管省略) 进行制备。
(1)仪器A的名称为 。
(2) 用图中的装置组合制备CCl2,,连接顺序为 。装置丙的作用是
。
(3)装置甲中发生反应的离子方程式为 。
(二) [C(NH₃)6 ]Cl3的制备
步骤如下:
Ⅰ. 将NHLCl 溶解。
Ⅱ. 分批加入CCl3,后,将溶液温度降至 10°C以下,加入活性炭、浓氨水,搅拌下逐滴加入6%的双氧水。
Ⅲ. 加热至 55~60℃反应,20min。冷却、 过滤。
Ⅳ. 将滤得的固体转入含有少量盐酸的沸水中,进行操作X。
V.将滤液转入烧杯,加入浓盐酸,冷却、过滤、干燥,得到橙黄色晶体 CNH₃₆Cl₃M=267.5g⋅ml⁻¹。
(4)步骤Ⅱ中,公众号山城学术圈将温度降至10℃以下的原因是 。
(5) 步骤Ⅳ中操作X为 ,制备 CNH₃6Cl₃的总反应的化学方程式为 。
(6) 取0.2000gCNH₃₆Cl₃样品,配成100mL溶液,取 50mL样品溶液于锥形瓶中,加入3滴 K₂CrO₄溶液做指示剂,用 0.0600ml⋅L⁻¹的 AgNO₃,溶液滴定至终点时,消耗 AgNO₃溶液的体积为10.00mL,样品的纯度为 。
16. (14分) 电解金属锰阳极渣(主要成分 MnO₂,,杂质为 PbCO₃、Fe₂O₃、CuO)和黄铁矿 FeS₂为原料可制备 Mn₃O₄,公众号山城学术圈其流程如图9 所 示:
已知:室温下CaF₂和 MnF₂均难溶于水且前者的溶解度更小。回答下列问题:
(1)基态Mn原子的价电子的轨道表示式为 。
(2)“酸浸”过程中,所用的稀酸X是 (填化学式)。
(3)“酸浸”过程中 Fe2+、Fe3+的质量浓度、Mn浸出率与时间的关系如图10所示。20~80min,浸出Mn元素的主要离子方程式为 。 80~100min时, Fe2+浓度上升的原因可能是 。
(4)“除Fe、Cu”过程中依次加入的试剂Y、Z为 (填序号)。
A.H₂O₂、NH₃·H₂O B.KMnO₄、CaO
C.SO₂、MnCO₃ D.H₂O₂、CaCO₃
(5)“净化”中加入MnF₂的目的是除去Ca2+,其反应的离子方程式为 。
(6) 硫酸锰在空气中加热可以生产相应的氧化物,称取 151mg硫酸锰充分煅烧后刷余固体的质量为79mg,则此时固体的化学式为 。图11为不同温度下硫酸锰隔绝空气焙烧2小时后残留固体的X-射线衍射图,若由 MmSO4固体制取活性 Mn₂O3,方案为:将 MnSO4固体置于可控温度的反应管中, , 将 Mn₂O₃冷却、研磨、密封包装。(可选用的试剂有: 1ml/LBaCl₂溶液,1ml/L NaOH溶液)
17. (15分) 铁及其化合物在生产生活中都具有重要应用。
(1) 在铁的氧化物催化下,丙烷直接脱氢生成丙烯。根据图12所示,回答下列问题:
①该反应的决速步的活化能为 kJ/ml。
②写出丙烷生成丙烯的热化学方程式: 。
(2)公众号山城学术圈 将 FeSO₄s置入抽空的刚性容器中,升高温度发生分解反应: 2FSO₄s⇌ Fe₂O3s+SO₂g+SO₃g,平衡时 Ps₂和T的关系如下表所示:
①620K时,该反应的平衡总压 p总= kPa,,若压缩体积为原来的 12,则达到平衡时p。是否改变? (回答是否改变并说明原因)。
②起始状态I中有 FeSO3、Fe2O3、SO₂、SO3,维持温度和体积不变达到化学平衡Ⅱ若保持体积不变,降低温度达到化学平衡Ⅲ,已知状态Ⅰ和状态Ⅲ的固体质量相同。下列说法正确的是 (填序号)。
A. 从1到Ⅱ的过程中: △S>0
B. 平衡常数: KⅡ>KⅢ
C.平衡时 pSO2:Ⅱ<Ⅲ
D. 逆反应速率: I>Π>Ⅲ
③提高温度、上述容器中进一步发生反应 2SO₃g⇌2SO₂g+O₂g,平衡时 p₂ =14pS02−ps3。在 950K 达平衡时, p总=86kPa,ps3=36kPa则该反应的 Kₚ= kPa (列出计算式)。
3FeS₂晶胞为正方体,边长为a pm.如图13所示。
①与 Fe2+等距且最近的阴离子个数为 。
②晶胞的密度为 ρ= g⋅cm⁻³(列出表达式即可)。
(4) 如图14所示电解装置中,通电后石墨电极Ⅱ上有02生成, Fe₂O₃逐渐溶解。
当 0.02mlFe₂O₃完全溶解时,至少产生气体为 mL(在标准状况下)。
18.(15分) 药物Q能阻断血栓的形成,其合成路线如图15 所示:
(2) B的分子式为C₁₁H₁₃NO₂,E的结构简式是 。
(3) M→P的化学方程式为 。
(4) J→G 的反应类型是 。
(5)W是P的同分异构体.符合下列条件的W有 种,写出其中一种的结构简式: 。
i. 包含2个六元环;
ⅱ W可水解, W与NaOH 溶液共热时, lml W 最多消耗3ml NaOH。
A. 制备NH₃
B. 测量 O₂体积
C. 检验 1-氯丁烷中氯元素
D. 制备晶体
[Cu(NH₃)4]SO₄·H₂O
T/K
600
620
640
660
680
Ps2/kPa
0.75
1.0
1.25
1.5
1.75
重庆市第八中学校2023-2024学年高三上学期高考适应性月考卷4化学试题含答案: 这是一份重庆市第八中学校2023-2024学年高三上学期高考适应性月考卷4化学试题含答案,共24页。试卷主要包含了 下列离子方程式书写正确的是等内容,欢迎下载使用。
重庆市第八中学校2024届高三上学期高考适应性月考卷(三)化学试卷(含答案): 这是一份重庆市第八中学校2024届高三上学期高考适应性月考卷(三)化学试卷(含答案),共22页。试卷主要包含了单选题,填空题等内容,欢迎下载使用。
2024重庆市八中高三上学期高考适应性月考卷(四)化学含答案: 这是一份2024重庆市八中高三上学期高考适应性月考卷(四)化学含答案,共9页。试卷主要包含了1NA,下列离子方程式书写正确的是等内容,欢迎下载使用。












