




2024届高三化学一轮复习课件:电解池 金属的腐蚀与防护
展开1. 电解和电解池(1)电解:使 通过电解质溶液(或熔融电解质)而在阳极、阴极引起 反应的过程。 (2)电解池:将 转化为 的装置。 2.电解池的构成条件
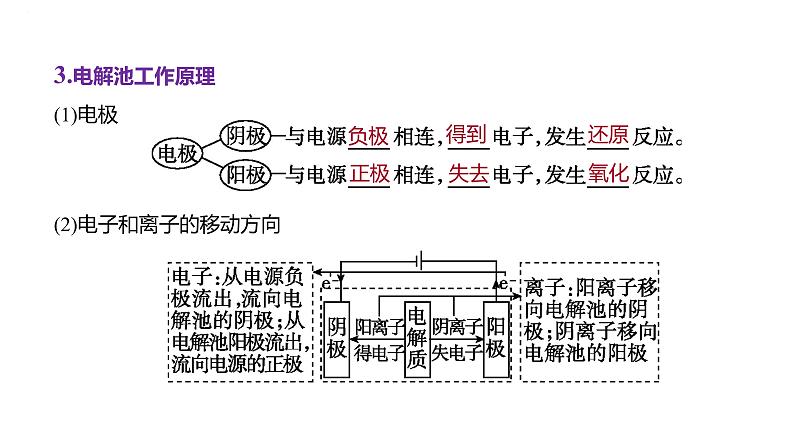
3.电解池工作原理(1)电极(2)电子和离子的移动方向
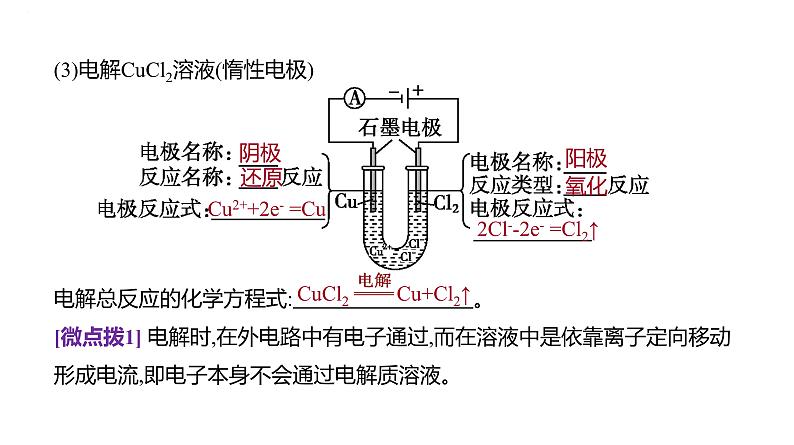
(3)电解CuCl2溶液(惰性电极)电解总反应的化学方程式: 。 [微点拨1] 电解时,在外电路中有电子通过,而在溶液中是依靠离子定向移动形成电流,即电子本身不会通过电解质溶液。
Cu2++2e- =Cu
2Cl--2e- =Cl2↑
CuCl2 Cu+Cl2↑
4.电解规律(1)阳极产物的判断①活性电极(除Au、Pt外的金属)作阳极,则活性电极 电子,发生 反应。 ②惰性电极(Pt、石墨等)作阳极,要依据阴离子的放电顺序判断。阴离子的放电顺序如下:
(2)阴极产物的判断不考虑电极材料,直接根据溶液中阳离子的放电顺序进行判断。阳离子的放电顺序如下:[微点拨3] ①阳离子的放电顺序遵循氧化还原反应的“先后规律”,前提条件是各种离子的浓度相差不大。②金属阳离子(除Fe3+)放电,则得到相应的金属,H+放电则得到H2;Fe3+放电一般转化为Fe2+。
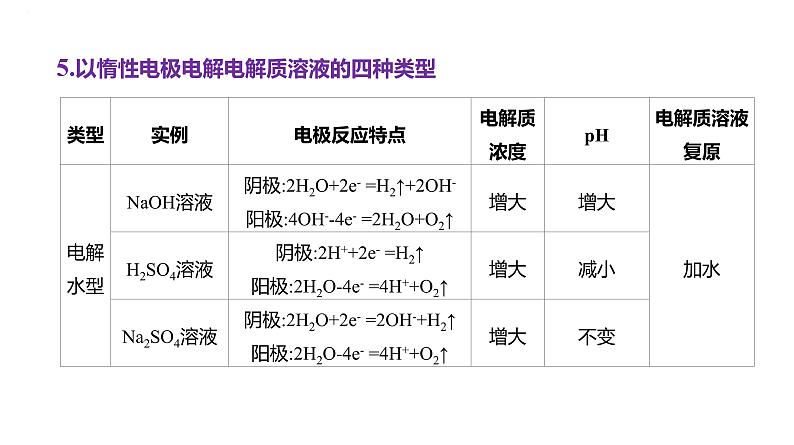
5.以惰性电极电解电解质溶液的四种类型
1.判断正误(正确的打“√”,错误的打“×”)(1)原电池的正极和电解池的阳极均发生氧化反应 ( )(2)电解质溶液的导电过程就是电解质溶液被电解的过程( )(3)电解CuCl2溶液,阴极逸出的气体能够使湿润的淀粉碘化钾试纸变蓝( )
(4)电解盐酸、硫酸溶液等,H+放电,溶液的pH逐渐增大( )
[解析] Cl2在阳极生成。
[解析]电解盐酸,pH变大;电解硫酸溶液,实际是电解水,pH变小。
[解析]电子不能通过溶液。
(5)用Cu作电极电解盐酸可发生Cu+2H+ Cu2++H2↑ ( )(6)电解池工作时电子从电源的负极流出,流入阴极通过溶液到阳极,然后从阳极流出,流回电源正极( )
2. 某学生设计了一种家用消毒液发生器,装置如图所示。下列说法错误的是 ( )A.该消毒液的有效成分是NaClOB.通电时Cl-发生氧化反应C.通电时电子从阳极经食盐溶液流向阴极D.该装置的优点是随制随用
[解析]电解食盐溶液会生成氯气、氢气和氢氧化钠,氯气与氢氧化钠反应生成次氯酸钠,故有效成分是次氯酸钠,A正确;通电时Cl-发生氧化反应生成氯气,Cl元素的化合价由-1价变为0价,B正确;溶液中只有阴、阳离子,没有电子,电子不能经过电解质溶液,C错误;该装置的优点是随制随用,以防旧制的次氯酸钠分解失效,D正确。
1. 电致变色器件可智能调控太阳光透过率,从而实现节能。图是某电致变色器件的示意图。当通电时,Ag+注入到无色WO3薄膜中,生成AgxWO3,器件呈现蓝色,对于该变化过程,下列叙述错误的是 ( )A.Ag为阳极B.Ag+由银电极向变色层迁移C.W元素的化合价升高D.总反应为WO3+xAg =AgxWO3
题组一 电解原理及规律
[解析]根据图示及信息,Ag失去电子转化为Ag+,Ag 为阳极,A选项正确;通电时,Ag+注入到无色WO3薄膜中,生成AgxWO3,B选项正确;转化过程中,WO3转化为AgxWO3,W的化合价降低,C选项错误;根据题意,总反应为WO3+xAg =AgxWO3,D选项正确。
2.用石墨作电极,电解稀Na2SO4溶液的装置如图所示,通电后在石墨电极A和B附近分别滴加一滴石蕊溶液。下列有关叙述正确的是 ( )A.逸出气体的体积:A电极
题组二 电解池电极反应式的书写
2. (1)将PbO溶解在HCl和NaCl的混合溶液中,得到含Na2PbCl4的电解液,电解Na2PbCl4溶液生成Pb的装置如图甲所示。写出电解时阴极的电极反应式: 。
Mn2+-2e-+2H2O =MnO2↓+4H+
[方法点拨] 电解池中电极产物的判断和电极反应式的书写
1.电解饱和食盐水——氯碱工业(1)电极反应阳极反应式: (氧化反应); 阴极反应式: (还原反应); 总反应方程式: 。 (2)阳离子交换膜的作用①只允许 通过,能阻止阴离子和Cl2通过,防止发生副反应: ; ②防止阳极产生的Cl2和阴极产生的H2混合,发生爆炸。
2H2O +2e- =H2↑+2OH-
2NaCl+2H2O 2NaOH+H2↑+Cl2↑
2NaOH+Cl2 =NaCl+NaClO+H2O
2. 电镀与电解精炼铜
Cu-2e- =Cu2+
3. 电冶金利用电解熔融盐(或氧化物)的方法来冶炼活泼金属,如Na、Ca、Mg、Al等。
2NaCl(熔融) 2Na+Cl2↑
MgCl2(熔融) Mg+Cl2↑
Mg2++2e- =Mg
2Al2O3(熔融) 4Al+3O2↑
6O2--12e- =3O2↑
[解析] MgO熔点很高,一般不用来冶炼Mg;而AlCl3为共价化合物,不存在离子,无法电解。
1.判断正误(正确的打“√”,错误的打“×”) (1)在镀件上电镀铜时,也可以用惰性材料作阳极,用硫酸铜溶液作电解液( )(2)电解冶炼镁、铝通常电解MgCl2和Al2O3,也可电解MgO和AlCl3( )
(3)若把Cu+H2SO4 =CuSO4+H2↑设计成电解池,应用Cu作阳极 ( )(4)电镀铜和电解精炼铜时,电解质溶液中c(Cu2+)均保持不变( )
[解析]电解精炼铜时电解质溶液中c(Cu2+)减小。
(5)阳离子交换膜(以电解NaCl溶液为例)只允许阳离子(Na+、H+)通过,而阻止阴离子(Cl-、OH-)和分子(Cl2)通过 ( )(6)用Zn作阳极,Fe作阴极,ZnCl2溶液作电解质溶液,由于放电顺序H+>Zn2+,不可能在铁上镀锌( )
2.粗铜的电解精炼如图所示。(1)在粗铜的精炼过程中,粗铜板应是图中电极 (填图中的字母);在电极d上发生的电极反应式为 。 (2)若粗铜中还含有Au、Ag、Fe,则阳极的电极反应式为 , 粗铜中的Au、Ag的存在形式和位置为 , 溶液中c(Cu2+) (填“变大”“变小”或“不变”)。
Fe-2e- =Fe2+、Cu-2e- =Cu2+
Au、Ag以单质的形式沉积在c电极的下方,形成阳极泥
1.金属镍有广泛的用途,粗镍中含有Fe、Zn、Cu、Pt等杂质,可用电解法制得高纯度的镍。下列叙述中正确的是(已知:氧化性Fe2+
[解析]电解时,阳极Zn、Fe、Ni失去电子,发生氧化反应,A错误;因氧化性:Ni2+>Fe2+>Zn2+,故阴极反应式为Ni2++2e- =Ni,可见,阳极质量减少是因为Zn、Fe、Ni溶解,而阴极质量增加是因为Ni析出,B错误;电解后溶液中的阳离子除Fe2+和Zn2+外,还有Ni2+和H+,C错误。
2. 科技工作者开发以乙醇为原料制备DDE( )的电解装置如图所示。下列说法错误的是 ( )A.电源的电极电势:a>bB.阳极电极反应式为C2H5OH+Cl--2e- =C2H5OCl+H+C.乙醛为该转化过程的催化剂D.每产生1 ml DDE,电路中通过2 ml e-
[解析] M电极为阳极,N电极为阴极,则a为正极,b为负极,故电极电势:a>b,A正确;M电极为阳极,电极反应式为C2H5OH+Cl--2e- =C2H5OCl+H+,B正确;C2H5OCl先转化为CH3CHO,CH3CHO再和C2H5OH反应生成水和DDE,则CH3CHO为中间产物,C错误;产生1 ml DDE需要消耗1 ml CH3CHO,而1 ml CH3CH2OH转化为1 ml CH3CHO需要转移2 ml e-,故产生1 ml DDE,电路中通过2 ml e-,D正确。
题组二 与电解有关的计算
2.工业上采用电解的方法来制备活泼金属铝,原理如图所示。下列说法正确的是 ( )A.电解过程中阳极反应式为Al3++3e- =AlB.电解过程中每产生6.4 g O2,反应所转移电子的物质的量为0.6 ml e-C.若生产9 g铝时,阳极损失3.6 g石墨,则石墨被氧化为CO、CO2物质的量之比为1∶2D.加入冰晶石Na3AlF6的目的是增强电解液的导电性
[方法技巧] 电化学综合计算的三种常用方法(1)根据总反应式计算先写出电极反应式,再写出总反应式,最后根据总反应式列出比例关系进行计算。(2)根据电子守恒计算①用于串联电路中阴阳两极产物、正负两极产物、相同电量等类型的计算,其依据是电路中转移的电子数相等。②用于混合溶液中电解的分阶段计算。
1. 金属腐蚀的本质金属原子 变为金属阳离子,金属发生 反应。 2.金属腐蚀的类型(1)化学腐蚀和电化学腐蚀的比较
(2)钢铁的析氢腐蚀与吸氧腐蚀
Fe-2e- =Fe2+
2H++2e- =H2↑
2H2O+O2+4e- =4OH-
Fe+2H+ =Fe2++H2↑
2Fe+O2+2H2O =2Fe(OH)2
3. 金属的防护(1)电化学防护法
(2)改变金属材料的组成,如制成合金、不锈钢等。(3)加防护层,如在金属表面喷油漆、涂油脂、电镀、喷镀或表面钝化等方法。
1.判断正误(正确的打“√”,错误的打“×”) (1) Al、Fe、Cu在潮湿的空气中腐蚀均生成氧化物( )
(2)铜在酸性较强的溶液中也可发生析氢腐蚀( )
(3)在金属表面覆盖保护层,若保护层破损后,就完全失去了对金属的保护作用( )
[解析]铜在潮湿的空气中腐蚀生成铜绿[Cu2(OH)2CO3]。
[解析]铜与H+不反应。
[解析]若在铁器上镀锌,则保护层破损后,锌仍对铁有保护作用。
[解析]被保护金属应与电源负极相连。
(5)外加电流法是将被保护金属接在直流电源的正极( )
(4)在潮湿空气中,钢铁表面形成水膜,金属发生的一定是吸氧腐蚀( )
[解析]若水膜酸性较强,可发生析氢腐蚀。
2.研究海水中金属桥墩的腐蚀及防护是桥梁建设的重要课题。下列有关说法错误的是( )A.桥墩的腐蚀主要是析氢腐蚀B.钢铁桥墩在海水中比在河水中腐蚀更快C.图甲辅助电极的材料可以为石墨D.图乙钢铁桥墩上发生的反应是O2+2H2O+4e- =4OH-
[解析]海水呈弱碱性,桥墩在海水中主要发生吸氧腐蚀,A错误;海水中电解质含量高于河水,因此钢铁桥墩在海水中比在河水中腐蚀更快,B正确;图甲是外加电流法,钢铁桥墩与电源的负极相连,辅助电极可以是石墨或金属,C正确;图乙是牺牲阳极法,辅助电极是比铁更活泼的金属,钢铁桥墩作正极,发生吸氧腐蚀,电极反应式为O2+2H2O+4e- =4OH-,D正确。
1.实验室模拟在海水环境和河水环境下对焊接金属材料使用的影响(如图)。下列相关描述中不正确的是 ( )A.由图示的金属腐蚀情况说明了Sn元素的金属性弱于Fe元素B.由图示可以看出甲是海水环境下的腐蚀情况,乙是河水环境下的腐蚀情况C.两种环境下铁被腐蚀时,电极反应式均为Fe-2e- =Fe2+D.为了防止舰艇在海水中被腐蚀,可在焊点附近用锌块打“补丁”
[解析]两图中被腐蚀的都是Fe,说明Fe是负极,Sn为正极,说明金属性Fe>Sn,A正确;从腐蚀程度来讲,乙明显腐蚀比较严重,因海水中含有较多的盐分,腐蚀速率比河水快,故乙是海水环境下的腐蚀情况,甲是河水环境下的腐蚀情况,B错误;铁被腐蚀时电极反应式应为Fe-2e- =Fe2+,C正确;金属性Zn>Fe>Sn,用锌块作补丁,Zn作负极被腐蚀,可以保护Fe和Sn,D正确。
2. 某同学利用如图所示装置探究金属的腐蚀与防护条件。(已知Fe2+遇K3[Fe(CN)6]溶液呈蓝色)。下列说法不合理的是 ( )A.①区Cu电极上产生气泡,Fe电极附近滴加K3[Fe(CN)6]溶液后出现蓝色,Fe被腐蚀B.②区Cu电极附近滴加酚酞后变成红色,Fe电极附近滴加K3[Fe(CN)6]溶液出现蓝色,Fe被腐蚀C.③区Zn电极的电极反应式为Zn-2e- =Zn2+,Fe电极附近滴加K3[Fe(CN)6]溶液未出现蓝色,Fe被保护D.④区Zn电极的电极反应式为2H2O+2e- =H2↑+2OH-,Fe电极附近滴加K3[Fe(CN)6]溶液出现蓝色,Fe被腐蚀
[解析] ①区发生吸氧腐蚀,Cu为正极,电极反应式为O2+2H2O+4e- =4OH-,Cu电极上不产生气泡,A错误;②区Cu为阴极,电极反应式为2H2O+2e- =H2↑+2OH-,Cu电极附近溶液碱性增强,滴加酚酞后变成红色,Fe为阳极,被腐蚀,电极反应式为Fe-2e- =Fe2+,Fe电极附近滴加K3[Fe(CN)6]溶液出现蓝色,B正确;③区Zn为负极,电极反应式为Zn-2e- =Zn2+,Fe为正极,被保护,C正确;④区Zn为阴极,电极反应式为2H2O+2e- =H2↑+2OH-,Fe作阳极,被腐蚀,电极反应式为Fe-2e- =Fe2+,Fe电极附近滴加K3[Fe(CN)6]溶液出现蓝色,D正确。
[规律小结] 判断金属腐蚀快慢的规律(1)对同一电解质溶液来说,腐蚀速率的快慢电解原理引起的腐蚀>原电池原理引起的腐蚀>化学腐蚀>有防腐措施的腐蚀。(2)对同一金属来说,在不同溶液中腐蚀速率的快慢强电解质溶液中>弱电解质溶液中>非电解质溶液中。(3)活动性不同的两种金属,活动性差别越大,腐蚀速率越快。(4)对同一种电解质溶液来说,电解质溶液浓度越大,金属腐蚀速率越快。
1. 将金属M连接在钢铁设施表面,可减缓水体中钢铁设施的腐蚀。在图所示的情境中,下列有关说法正确的是 ( )A.阴极的电极反应式为Fe-2e- =Fe2+B.金属M的活动性比Fe的活动性弱C.钢铁设施表面因积累大量电子而被保护D.钢铁设施在河水中的腐蚀速率比在海水中的快
[解析] A项,该装置为原电池,阴极处为正极,参与电极反应的是O2或是溶液中的H+,错误;B项,M比Fe活泼,M作为负极,发生氧化反应,失去的电子转移至Fe处,错误;C项,Fe表面有M传过来的电子,则O2或H+得到的电子不是Fe失去的电子,故Fe被保护,正确;D项,海水中存在大量的电解质,所以更容易发生电化学腐蚀,错误。
2024届高三化学高考备考一轮复习专题:电解池 金属的腐蚀与防护课件: 这是一份2024届高三化学高考备考一轮复习专题:电解池 金属的腐蚀与防护课件,共43页。PPT课件主要包含了电解与电解池,化学能,电解产物的判断,按要求填空,氯碱工业,3设备装置,电镀和电解精炼铜,阳极泥,电冶金,金属腐蚀的本质等内容,欢迎下载使用。
人教版高考化学一轮复习6.3电解池金属的腐蚀与防护课件: 这是一份人教版高考化学一轮复习6.3电解池金属的腐蚀与防护课件
人教版高考化学一轮总复习课时质量评价24电解池金属的腐蚀与防护课件: 这是一份人教版高考化学一轮总复习课时质量评价24电解池金属的腐蚀与防护课件,共34页。












