
高中化学第一节 铁及其化合物课时训练
展开铁的氧化物
常见考点
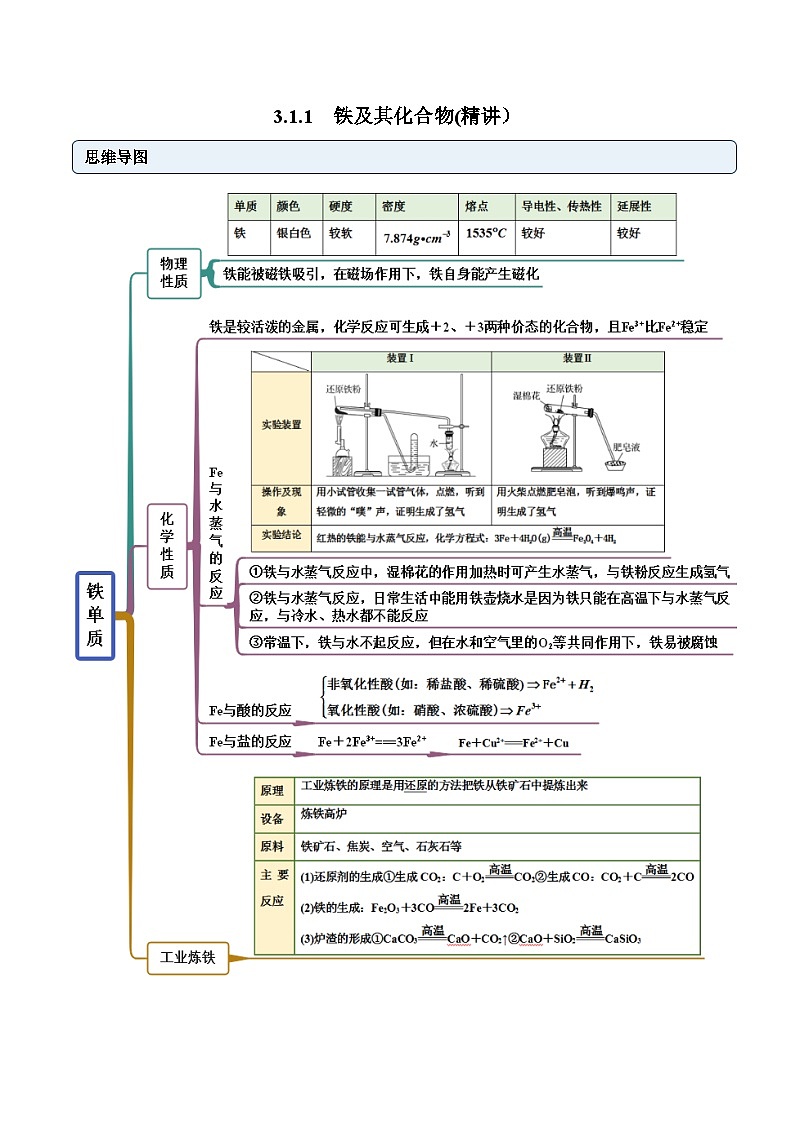
考点一 单质铁
【例1】(2021·河北·模拟预测)下列关于铁的说法正确的是
A.纯铁为灰黑色,所以铁属于黑色金属
B.铁在硫蒸气中燃烧生成 SKIPIF 1 < 0
C.纯铁的抗腐蚀能力非常强,铁在干燥的空气里不易被氧化
D.铁的化学性质比较活泼,所以铁在自然界中全部以化合态存在
【答案】C
【解析】A.纯铁为银白色金属,冶金工业上将铁归为黑色金属,故A错误;
B.硫为弱氧化剂,则Fe在硫蒸气中燃烧生成FeS,故B错误;
C.Fe不易失去电子,且纯铁中的杂质相对较少,则纯铁的抗腐蚀能力相当强,铁在干燥的空气里不易被氧化,故C正确;
D.Fe在自然界中既有游离态又有化合态,故D错误;
本题答案C。
【一隅三反】
1.我国宋代《开宝本草》中记载了中药材铁华粉的制作方法:“取钢煅作叶,如笏或团,平面磨错令光、净,以盐水洒之,于醋瓮中阴处埋之一百日,铁上衣生,铁华成矣。”下列说法错误的是
A.“取钢煅作叶,如笏或团”说明金属铁有较好的延展性
B.“平面磨错令光、净”的目的是除去表面的铁锈
C.“铁上衣生”的原因是铁被氧气氧化
D.中药材铁华粉的主要成分是醋酸亚铁
【答案】C
【解析】A.把钢煅作或长或圆的叶子形状,说明金属铁有良好延展性,故A正确;
B.中药材铁华粉的主要成分是醋酸亚铁,故开始要除去铁锈,防止三价铁影响产物纯度,故B正确;
C.金属铁在醋瓮中密封保存,隔绝空气,不能与氧气反应,故C错误;
D.隔绝空气,铁与醋酸反应生成醋酸亚铁,故D正确;
故C正确。
2.铁的下列性质中不属于纯铁的物理性质是
A.质软B.银白色C.能导电D.易生锈
【答案】D
【解析】物理性质通常包括:颜色、状态、气味、密度、硬度、熔沸点、导电性、导热性、溶解性等,所以铁质软、银白色、能导电,均为物理性质,而易生锈是指易被氧化,为化学性质;
综上所述答案为D。
3.(2022·北京市八一中学高一阶段练习)下列关于金属铁的描述不正确的是
A.纯铁是银白色金属B.能与水蒸气反应生成氧化铁
C.能盛放冷的浓硫酸D.能与氯化铁溶液反应
【答案】B
【解析】A.纯铁是银白色、具有金属光泽的金属,A正确;
B.高温下,铁能与水蒸气反应生成四氧化三铁和氢气,B不正确;
C.铁在冷的浓硫酸中发生钝化,故能盛放冷的浓硫酸,C正确;
D.铁能与氯化铁溶液反应生成氯化亚铁,D正确;
答案选B。
考点二 铁与水蒸气的反应
【例2】(2022·上海市复旦中学高一期中)在常温下,Fe与水并不起反应,但在高温下,Fe与水蒸气可发生反应。应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”。
请回答该实验中的问题。
(1)写出该反应的化学方程式:__ __;并指明该反应的还原剂是____,被还原的是____。
(2)圆底烧瓶中盛装的水,该装置受热后的主要作用是___ _;烧瓶底部放置了几片碎瓷片,碎瓷片的作用是__ __。
(3)酒精灯和酒精喷灯点燃的顺序是_ ___,原因是__ ___。
(4)干燥管中盛装是的物质是__ __,作用是_ ___。
(5)试管中收集气体是__ __,如果要在A处玻璃管处点燃该气体,则必须对该气体进行__ __,方法是_ ___。这一操作的目的是___ _。
【答案】(1) 3Fe+4H2O(g) SKIPIF 1 < 0 Fe3O4+4H2 Fe H2O
(2) 为硬质玻璃管内Fe与水蒸气的反应实验提供持续不断的水蒸气 防止暴沸事故的发生
(3) 先点燃酒精灯,产生水蒸气后,再点燃酒精喷灯 防止先点燃酒精喷灯所导致的Fe与O2的反应
(4) 碱石灰 除去反应产生的H2中的水蒸气
(5) H2 验纯 用试管收集一试管气体,靠近火焰,如果发出的声音是尖锐的爆鸣声,则证明产生的氢气不纯,如果是“噗”的声音,则证明是纯净的氢气 防止点燃时,氢气因含有氧气而爆炸
【解析】根据题意和实验装置图,先在酒精灯加热作用下使圆底烧瓶中的水产生水蒸气,在硬质玻璃管中与铁粉在高温下发生反应:3Fe+4H2O(g) SKIPIF 1 < 0 Fe3O4+4H2,硬质玻璃管中产生黑色晶体,用装有碱石灰的干燥管对生成的气体干燥,收集产生的气体并检验,证明在常温下,Fe与水并不起反应,在高温下,Fe与水蒸气可发生反应。
根据分析可知,在高温下,Fe与水蒸气可发生的反应方程式为:3Fe+4H2O(g) SKIPIF 1 < 0 Fe3O4+4H2;在反应中Fe的化合价升高,H的化合价降低,则还原剂是Fe,氧化剂是H2O,被还原的是H2O。
(2)圆底烧瓶中盛装水,为后续操作提供反应物,该装置受热后的主要作用是为硬质玻璃管内Fe与水蒸气的反应实验提供持续不断的水蒸气;为防止加热过程中烧瓶内的液体产生剧烈振荡,烧瓶底部放置了几片碎瓷片,碎瓷片的作用是防止暴沸事故的发生。
(3)酒精灯和酒精喷灯点燃前,应防止Fe与空气中的O2反应,所以点燃顺序是先点燃酒精灯,产生水蒸气后,再点燃酒精喷灯,防止先点燃酒精喷灯所导致的Fe与O2的反应。
(4)生成的H2中混有水蒸气,为了得到干燥的氢气,干燥管中盛装的物质是碱石灰,作用是除去反应产生的H2中的水蒸气。
(5)可燃性气体点燃前,应检验气体的纯度,若混有空气,易发生爆炸,试管中收集气体是H2,如果要在A处玻璃管处点燃该气体,则必须对该气体进行验纯,方法是:用试管收集一试管气体,靠近火焰,如果发出的声音是尖锐的爆鸣声,则证明产生的氢气不纯,如果是“噗”的声音,则证明是纯净的氢气,这一操作的目的是防止点燃时,氢气因含有氧气而爆炸。
【一隅三反】
1.(2022·黑龙江·哈师大附中高一期末)用如图所示装置进行Fe与水蒸气反应的实验,下列有关说法正确的是
A.实验时,先点燃酒精喷灯再点燃酒精灯
B.反应中H2O作氧化剂,发生反应的化学方程式为2Fe+3H2O=Fe2O3+3H2
C.干燥管中加入的固体干燥剂可以是无水氯化钙
D.收集反应产生的气体选用装置②
【答案】C
【解析】A.实验时,应先用水蒸气排出装置中的空气,即先点燃酒精灯再点燃酒精喷灯,A错误;
B.铁和水蒸气反应生成四氧化三铁和氢气,B错误;
C.氢气是中性气体,可以用碱石灰干燥,C正确;
D.收集的是氢气,密度比空气小,应用向下排气法,选用装置c,D错误;
故选C。
2.装置甲、乙、丙都是铁与水蒸气反应的实验装置,下列说法不正确的是
装置甲 装置乙 装置丙
A.选用丙装置,实验结束时先移去酒精灯,再将导气管拿出水面
B.甲装置中氯化钙的作用是除去氢气中混有的水蒸气
C.用乙装置实验时,蒸发皿中产生大量肥皂泡,点燃肥皂泡发出爆鸣声
D.三个装置相比较,乙装置简单、操作简便、节约原料、安全性好
【答案】A
【解析】A.选用丙装置,实验结束时先将导气管拿出水面,再移去酒精灯,以防发生倒吸,错误;
B.从硬质玻璃管导出的气体有生成的氢气和未反应的剩余的水蒸气,氯化钙的作用是除去氢气中混有的水蒸气,正确;
C.用乙装置实验时,蒸发皿中产生大量肥皂泡,肥皂泡里是氢气,所以点燃肥皂泡发出爆鸣声,正确;
D.和甲、丙装置相比较,乙装置简单、操作简便、节约原料、安全性好,正确;
故选A。
3.(2022·陕西·西北农林科技大学附中高一期末)在常温下,Fe与水并不起反应,但在高温下,Fe与水蒸气可发生反应。应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”。
请回答下列问题:
(1)写出该反应的反应方程式:________,并指出该氧化还原反应的还原剂是_______,氧化剂是________。
(2)实验前必须对整套装置进行操作的是________。
(3)圆底烧瓶中盛装的水,该装置受热后的主要作用是_______;烧瓶底部放置了几片碎瓷片,碎瓷片的作用是________。
(4)酒精灯和酒精喷灯点燃的顺序是_________,为什么?________。
(5)干燥管中盛装的物质是________,作用是___________。
(6)试管中收集气体是_______,如果要在A处玻璃管处点燃该气体,则必须对该气体进行___________,这一操作的目的是_________。
【答案】(1) 3Fe+4H2O(g) SKIPIF 1 < 0 Fe3O4+4H2 Fe H2O
(2)检查装置气密性
(3) 为硬质玻璃管内Fe与水蒸气的反应实验提供持续不断的水蒸气 防止暴沸事故的发生
(4) 先点燃酒精灯,产生水蒸气后,再点燃酒精喷灯 防止先点燃酒精喷灯所导致的Fe与O2的反应
(5) 碱石灰 除去反应产生的H2中的水蒸气
(6) H2 验纯 防止点燃时,氢气因含有氧气而爆炸
【解析】(1)高温下,铁与水蒸气反应,生成四氧化三铁和氢气,该反应的反应方程式:3Fe+4H2O(g) SKIPIF 1 < 0 Fe3O4+4H2,在反应中Fe的化合价升高,H的化合价降低,则还原剂是Fe,氧化剂是H2O。答案为:3Fe+4H2O(g) SKIPIF 1 < 0 Fe3O4+4H2;Fe;H2O;
(2)实验前必须检查整套装置是否漏气,所以应进行的操作是检查装置气密性。答案为:检查装置气密性;
(3)圆底烧瓶中盛装水,为后续操作提供反应物,该装置受热后的主要作用是为硬质玻璃管内Fe与水蒸气的反应实验提供持续不断的水蒸气;为防止加热过程中烧瓶内的液体产生剧烈振荡,烧瓶底部放置了几片碎瓷片,碎瓷片的作用是防止暴沸事故的发生。答案为:为硬质玻璃管内Fe与水蒸气的反应实验提供持续不断的水蒸气;防止暴沸事故的发生;
(4)酒精灯和酒精喷灯点燃前,应防止Fe与空气中的O2反应,所以点燃顺序是先点燃酒精灯,产生水蒸气后,再点燃酒精喷灯,防止先点燃酒精喷灯所导致的Fe与O2的反应。答案为:先点燃酒精灯,产生水蒸气后,再点燃酒精喷灯;防止先点燃酒精喷灯所导致的Fe与O2的反应;
(5)生成的H2中混有水蒸气,为了得到干燥的氢气,干燥管中盛装的物质是碱石灰,作用是除去反应产生的H2中的水蒸气。答案为:碱石灰;除去反应产生的H2中的水蒸气;
(6)可燃性气体点燃前,应检验气体的纯度,若混有空气,易发生爆炸。试管中收集气体是H2,如果要在A处玻璃管处点燃该气体,则必须对该气体进行验纯,这一操作的目的是防止点燃时,氢气因含有氧气而爆炸。答案为:H2;验纯;防止点燃时,氢气因含有氧气而爆炸。
考点三 铁与酸或盐反应
【例3-1】(2022·新疆·乌市一中高一期末)下列物质反应后一定有+3价铁生成的是
①过量的Fe与Cl2反应②Fe与过量稀硫酸反应③FeCl2溶液中通入少量Cl2
④Fe和Fe2O3的混合物溶于盐酸中⑤向Fe(NO3)2溶液中加入过量稀硫酸
A.只有①B.只有①③⑤C.只有①③④⑤D.全部
【答案】B
【解析】①Fe与Cl2反应生成FeCl3,与二者相对量的多少无关,①符合题意;
②Fe与过量稀硫酸反应生成FeSO4和H2,②不符合题意;
③FeCl2溶液中通入少量Cl2,反应生成FeCl3,③符合题意;
④Fe和Fe2O3的混合物溶于盐酸中,Fe2O3与盐酸反应生成FeCl3,FeCl3能够与Fe反应产生FeCl2,若Fe不足量,则溶液中含有FeCl3,若Fe足量,则溶液中完全是FeCl2,故反应后溶液中不一定含有+3价铁,④不符合题意;
⑤向Fe(NO3)2溶液中加入过量稀硫酸,相当于有硝酸,亚铁离子与硝酸发生氧化还原反应生成铁离子,⑤符合题意;
综上所述,①③⑤一定有+3价铁生成,答案选B。
【例3-2】(2022·辽宁·高一期中)某稀溶液中含有6mlKNO3和3mlH2SO4向其中加入2ml铁粉,充分反应(已知被还原为NO),最终溶液体积为1L。下列说法正确的是
A.所得溶液中c(NO SKIPIF 1 < 0 )=3ml/L
B.所得溶液中c(Fe2+):c(Fe3+)=3:1
C.反应后生成NO的体积为33.6L
D.所得溶液中的溶质只有Fe(NO3)3和Fe(NO3)2
【答案】B
【解析】第一步反应:比例关系来看,只有H+完全反应。
SKIPIF 1 < 0
铁粉剩余2ml-1.5ml=0.5ml,硝酸根离子剩余6ml-1.5ml=4.5ml,n(Fe3+)=1.5ml,V(NO)=n(NO)×Vm=1.5ml×22.4L/ml=33.6L;
第二步反应:比例关系来看,铁粉完全反应。
SKIPIF 1 < 0
铁离子剩余:1.5ml-1ml=0.5ml,生成n(Fe2+)=1.5ml。
根据以上分析解题。
A.所得溶液中c(NO SKIPIF 1 < 0 )= SKIPIF 1 < 0 =4.5ml·L-1,故A错误;
B.所得溶液中所得溶液中c(Fe2+):c(Fe3+)=1.5ml/L:0.5ml/L=3:1,故B正确;
C.反应后生成NO的体积为V(NO)=n(NO)×Vm=1.5ml×22.4L/ml=33.6L(标准状况下),选项中无标准状况,故C错误;
D.反应所得溶液中阳离子为铁离子、亚铁离子和钾离子,阴离子为硫酸根离子和硝酸根离子,溶质中含有硫酸钾和硝酸钾,故D错误;故选:B。
【一隅三反】
1.一定条件下单质铁与下列物质反应,产物中铁元素呈+3价的是
A.稀盐酸B.氯气C.硫酸铜溶液D.稀硫酸
【答案】B
【解析】A.稀盐酸具有弱氧化性,且弱氧化性是H元素体现的,能将Fe氧化为+2价,故A错误;
B.氯气具有强氧化性,能将Fe氧化+3价,无论铁是否过量,铁在氯气中燃烧都生成氯化铁,故B正确;
C.硫酸铜中铜离子具有弱氧化性,能和Fe发生置换反应生成+2价Fe,故C错误;
D.稀硫酸具有弱氧化性,能和Fe发生置换反应生成+2价,故D错误;
故选:B。
2.(2022·上海市复旦中学高一期中)将0.02ml铁分别投入足量的下列物质中,在一定条件下充分反应,产生氢气最多的是
A.2ml/L稀硫酸B.18.4ml/L硫酸C.5ml/L硝酸D.灼热的水蒸气
【答案】D
【解析】A.铁与稀硫酸反应的化学方程式为:Fe+H2SO4=FeSO4+H2↑,0.02mlFe与足量稀硫酸反应生成0.02mlH2;
B.铁与浓硫酸反应不产生氢气;
C.铁与硝酸反应不生成氢气;
D.铁与灼热的水蒸气反应的化学方程式为:3Fe+4H2O(g) SKIPIF 1 < 0 Fe3O4+4H2,0.02mlFe与足量灼热的水蒸气反应生成氢气 SKIPIF 1 < 0 ml>0.02ml;
答案选D。
3.(2022·上海市洋泾中学高一期中)常温下,将铁片放入下列溶液中,能明显观察到有气体产生的是
A.浓硫酸B.浓盐酸C.浓硝酸D.硫酸铜溶液
【答案】B
【解析】A.常温下,铁在浓硫酸中会钝化,不能明显观察到有气体产生,故A不符合题意;
B.常温下,铁片与浓盐酸反应生成氯化亚铁和氢气,能明显观察到有气体产生,故B符合题意;
C.常温下,铁在浓硝酸中会钝化,不能明显观察到有气体产生,故C不符合题意;
D.铁与硫酸铜溶液反应生成铜和硫酸亚铁,不会有气体产生,故D不符合题意;
答案选B。
4.(2022·浙江·舟山中学高一期中)向200mL稀硫酸和稀硝酸的混合溶液中缓慢加入铁粉,产生气体的体积随铁粉质量的变化如图所示
已知:①硝酸只被还原为NO气体;
②酸性条件下,氧化性: NO SKIPIF 1 < 0 >Fe3+ >H+
下列说法不正确的是
A.OA段产生的气体是NO, BC段产生的气体是H2
B.B点溶液中的溶质为FeSO4和H2SO4
C.原混合溶液中SO SKIPIF 1 < 0 的物质的量为0.4ml
D.原混合溶液中NO SKIPIF 1 < 0 的物质的量浓度为2 ml/L
【答案】D
【解析】OA段发生反应 SKIPIF 1 < 0 ,AB段发生反应 SKIPIF 1 < 0 ;BC段发生反应 SKIPIF 1 < 0 。
A.OA段发生反应 SKIPIF 1 < 0 ,OA段产生的气体是NO;BC段发生反应 SKIPIF 1 < 0 ,BC段产生的气体是H2,故A正确;
B.BC段发生反应 SKIPIF 1 < 0 ,说明溶液中不含Fe3+、 SKIPIF 1 < 0 ,BC段反应放出氢气,说明B点溶液中含有硫酸,所以B点溶液中的溶质为FeSO4和H2SO4,故B正确;
C.C点溶液中的溶质为FeSO4,根据铁守恒,FeSO4的物质的量为 SKIPIF 1 < 0 ,根据S守恒,原混合溶液中SO SKIPIF 1 < 0 的物质的量为0.4ml,故C正确;
D.发生 SKIPIF 1 < 0 反应,消耗铁的物质的量为 SKIPIF 1 < 0 ,所以原混合溶液中NO SKIPIF 1 < 0 的物质的量为0.2ml,NO SKIPIF 1 < 0 的浓度为 SKIPIF 1 < 0 1 ml/L,故D错误;
选D。
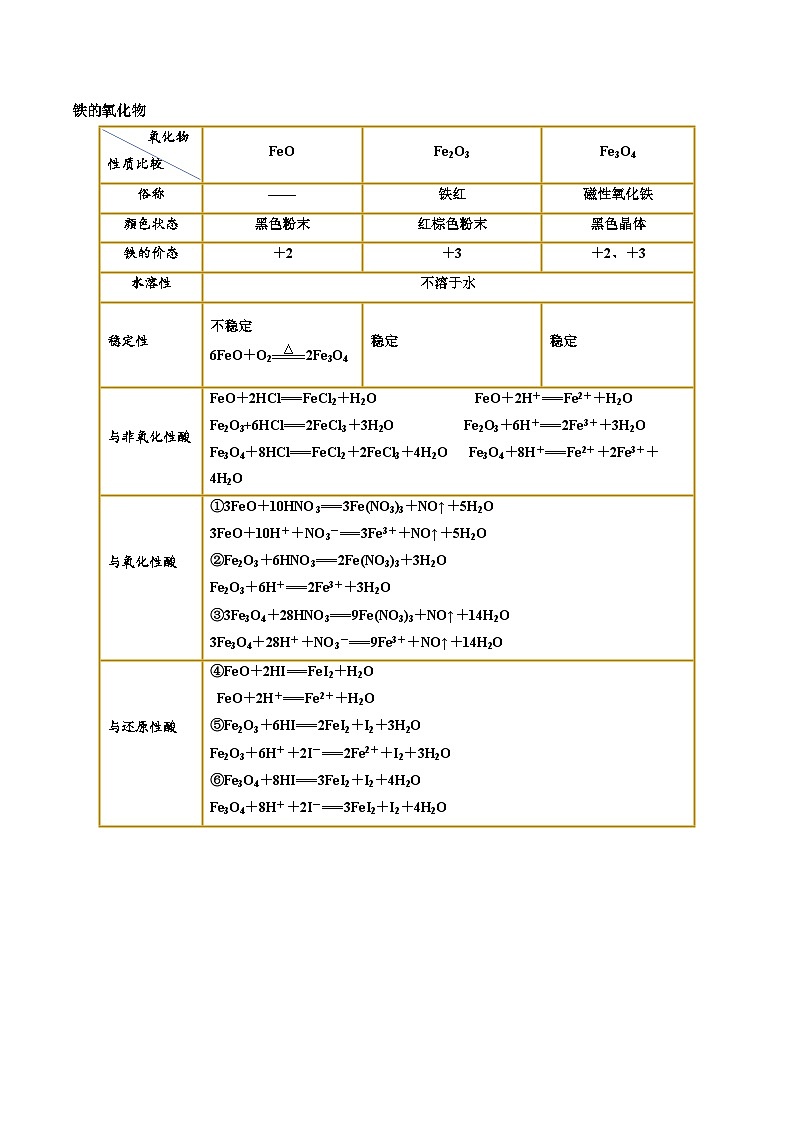
考点四 铁的氧化物
【例4-1】将一定质量的Fe、FeO、Fe2O3的混合物加入200mL 1ml/L稀硝酸中,有气泡生成且混合物完全溶解,向所得溶液中加入KSCN溶液,振荡,无血红色出现,则混合物中铁元素的质量可能为
A.11.2gB.9.6gC.5.6gD.2.8g
【答案】D
【解析】分析题目可以得出,反应后的溶液中只含 SKIPIF 1 < 0 ,由于反应中有NO生成,根据氮原子守恒可以得到,n(HNO3)=1ml/L×0.2L=0.2ml,混合物中铁元素的物质的量小于0.1ml,质量小于5.6g,D项正确。
【例4-2】(2022·山西省长治市第二中学校高一期末)由硫铁矿烧渣(主要成分为Fe3O4、Fe2O3、FeO和SiO2)制备绿矾(FeSO4•7H2O)的流程如图,已知:FeS2难溶于水。下列说法错误的是
A.步骤①酸溶烧渣最好选用硫酸
B.步骤②涉及的离子反应为FeS2+14Fe3++8H2O═15Fe2++2 SKIPIF 1 < 0 +16H+
C.步骤③须控制条件防止氧化
D.将溶液b加热到有较多固体析出,再用余热将液体蒸干得纯净绿矾
【答案】D
【解析】硫铁矿烧渣(主要成分为Fe3O4、Fe2O3、FeO和SiO2)加硫酸进行酸溶后,生成溶液a中含亚铁离子与铁离子,二氧化硅不溶于硫酸,以滤渣形式存在,再向滤液a加FeS2进行还原,将Fe3+还原为Fe2+后将过量的FeS2过滤以后得到溶液b,可隔绝氧气,经过蒸发浓缩、冷却结晶、过滤、洗涤、干燥等操作得到绿矾,以此解答该题。
A.因为要制备绿矾(FeSO4•7H2O),晶体中所含阴离子为硫酸根离子,所以酸溶时要选用硫酸,A正确;
B.步骤②加入FeS2目的是为了将Fe3+还原为Fe2+,涉及的离子反应为FeS2+14Fe3++8H2O=15Fe2++2SO42-+16H+,B正确;
C.因为亚铁离子易被氧化,所以步骤③须控制条件防止氧化,C正确;
D.将溶液b加热到有较多固体析出时,蒸发结晶即可,若再用余热将液体蒸干,绿矾可能会失去结晶水,从而不能得到纯净的绿矾,D错误;故答案选:D。
【一隅三反】
1.向一定量Fe和Fe2O3的混合物中加入500mL一定浓度的稀硝酸恰好使混合物溶解,同时可得到标准状况下2.24L NO气体。向所得到的溶液中再加入KSCN溶液,无红色出现。若用足量的H2在加热条件下还原相同质量的混合物,得到11.2g铁单质。则原稀硝酸的物质的量浓度为
A.1ml/LB.1.5ml/LC.2ml/LD.无法计算
【答案】A
【解析】向一定量Fe和Fe2O3的混合物中加入500mL一定浓度的稀硝酸恰好使混合物溶解,同时可得到标准状况下2.24L NO气体。向所得到的溶液中再加入KSCN溶液,无红色出现,说明产物是Fe(NO3)2。用足量的H2在加热条件下还原相同质量的Fe和Fe2O3的混合物,得到11.2g铁单质,则Fe和Fe2O3的混合物中Fe元素的物质的量为0.2ml;则反应后的溶液中含有0.2mlFe(NO3)2,根据氮元素守恒,500mL一定浓度的稀硝酸中含HNO3的物质的量为0.2ml×2+ SKIPIF 1 < 0 =0.5ml;原稀硝酸的物质的量浓度为 SKIPIF 1 < 0 ,选A。
2.(2022·上海市七宝中学高一期末)某铁的氧化物( SKIPIF 1 < 0 )1.04g溶于足量盐酸中,向所得溶液中通入标准状况下 SKIPIF 1 < 0 ,恰好将 SKIPIF 1 < 0 完全氧化。x值为
A.0.714B.0.750C.0.800D.0.875
【答案】D
【解析】FexO中Fe的平均化合价为+ SKIPIF 1 < 0 ,被氧化为Fe3+,根据电子守恒可知,转移的电子数和Cl2转移的电子数相等.标准状况下112mLCl2转移电子数为 SKIPIF 1 < 0 ,则有: SKIPIF 1 < 0 ,解得x=0.875,故选D。
3.(2022·江苏南京·高一期末)由硫铁矿烧渣(主要含Fe2O3、Al2O3、SiO2)制取绿矾(FeSO4·7H2O)的流程如下:
下列有关说法不正确的是
A.“酸溶”时适当提高稀硫酸浓度,可提高铁元素的浸出效率
B.“还原”时主要发生反应的离子方程式为2Fe3++Fe=3Fe2+
C.“检验”时可用KSCN溶液检验“还原”步骤是否进行完全
D.“系列操作”必须使用的仪器有玻璃棒、酒精灯、坩埚等
【答案】D
【解析】硫铁矿烧渣(主要含Fe2O3、Al2O3、SiO2)中加入稀硫酸酸溶,Fe2O3、Al2O3溶解得到Fe3+、Al3+的酸性溶液,SiO2不反应,过滤,滤渣为SiO2;滤液中加入过量铁粉还原,离子方程式为:2Fe3++Fe=3Fe2+;然后用KSCN溶液检验“还原”步骤是否进行完全;加入NaOH溶液调节溶液pH除铝,过滤,滤渣为氢氧化铝,滤液中含有FeSO4;经蒸发浓缩、冷却结晶、过滤、洗涤、干燥得到FeSO4·7H2O,据此分析作答。
A.“酸溶”时适当提高稀硫酸浓度,可加快反应速率,从而提高铁元素的浸出效率,A项正确;
B.“还原”时加入的过量铁粉与铁离子反应生成亚铁离子,主要发生反应的离子方程式为2Fe3++Fe=3Fe2+,B项正确;
C.Fe3+与KSCN溶液反应生成硫氰化铁,溶液变红,所以“检验”时可用KSCN溶液检验是否存在Fe3+,若溶液不变红,说明“还原”步骤进行完全,C项正确;
D.滤液中含有FeSO4,经蒸发浓缩、冷却结晶、过滤、洗涤、干燥得到FeSO4·7H2O,则“系列操作”必须使用的仪器有玻璃棒、酒精灯、蒸发皿等,不需要坩埚,D项错误;
答案选D。
考点五 工业炼铁
【例5】(铁是地壳中含量非常丰富的元素,金属铁是在高炉中冶炼的,在冶金工业中,常用焦炭来冶炼铁。
(1)写出焦炭在高炉中所参加的两个反应的化学方程式: ________________。
(2)写出赤铁矿被 SKIPIF 1 < 0 还原成铁的化学方程式:__________________________。
(3)实验室中可用 SKIPIF 1 < 0 还原 SKIPIF 1 < 0 ,在加热 SKIPIF 1 < 0 前应先_________,否则可能发生________现象;未反应完的 SKIPIF 1 < 0 ___________(填“能”或“不能”)排放到大气中,应做________处理。
【答案】(1) SKIPIF 1 < 0
SKIPIF 1 < 0
SKIPIF 1 < 0 验纯 爆炸 不能 点燃
【解析】(1)在冶炼铁的过程中,为提高C的利用率,先发生反应 SKIPIF 1 < 0 ,再发生反应 SKIPIF 1 < 0 。
(2)赤铁矿的主要成分为三氧化二铁,故赤铁矿被 SKIPIF 1 < 0 还原成铁的化学方程式为: SKIPIF 1 < 0 。
(3)一氧化碳属于可燃性气体,加热 SKIPIF 1 < 0 之前应先检验 SKIPIF 1 < 0 的纯度,否则可能发生爆炸;由于 SKIPIF 1 < 0 有毒故未反应完的 SKIPIF 1 < 0 应点燃,以防污染环境。
【一隅三反】
1.(2021·山东省青岛第一中学高一开学考试)小明对实验室炼铁的原理进行了以下整理,你认为错误的一项是
A.a处B.b处C.c处D.d处
【答案】B
【解析】A.赤铁矿主要成分是Fe2O3,物质成分化学式书写合理,A正确;
B.C元素化合价由反应前CO中的+2价变为反应后CO2中的+4价,化合价升高,失去电子被氧化,发生氧化反应,B错误;
C.该反应是在高温条件下进行,反应条件合理,C正确;
D.两种反应物都是化合物,生成物一种是单质,一种是化合物,因此反应基本类型不是置换反应,反应类型判断合理,D正确;
故合理选项是B。
2.(2021·黑龙江·哈尔滨市第六中学校高一期中)高炉炼铁中存在反应:3CO + Fe2O3 SKIPIF 1 < 0 3CO2 + 2Fe。下列说法正确的是
A.Fe2O3是氧化剂
B.Fe是氧化产物
C.CO2是还原产物
D.CO既不是氧化剂又不是还原剂
【答案】A
【详解】A.Fe2O3中铁元素的化合价由+3价变成0价,化合价降低,因此Fe2O3作氧化剂,故A正确;
B.铁单质是由Fe2O3还原得到,因此Fe是还原产物,故B错误;
C.CO中的C元素化合价由+2价升高到+4价,化合价升高,因此CO是还原剂,被氧化成CO2,CO2是氧化产物,故C正确;
D.CO中C元素化合价升高,则CO作还原剂,故D错误;
答案A。
3.铁是地壳中含量仅次于铝的金属元素。铁及其化合物在生活、生产中有广泛应用。请回答下列问题:
(1)磁铁矿是工业上冶炼铁的原料之一,其原理是:Fe3O4 + 4CO SKIPIF 1 < 0 3Fe + 4CO2,若有1ml Fe3O4参加反应,转移电子的物质的量是___________ ml。
(2)高铁酸钾(K2FeO4)是一种既能杀菌、消毒,又能絮凝净水的水处理剂。工业制备高铁酸钾的方法为在KOH浓溶液中加入NaClO和Fe(OH)3,并不断搅拌,其发生反应的离子方程式为:___________。
(3)某课外活动小组将下图所示装置按一定顺序连接,在实验室里制取一定量的FeCl3(所通气体过量并充分反应)已知FeCl3会吸水潮解。
请回答下列问题:
①A中发生反应的化学方程式为 ___________ 。
②各装置的正确连接顺序为(填写装置代号) A→___________ → ___________ → ___________ → ___________→D。(如有必要,某些装置可重复使用)
③装置E的作用是 ___________ ,
④写出装置D中反应的离子方程式 ___________ 。
⑤反应开始后,B中硬质玻璃管内的现象为 ___________ ;
⑥实验室常用FeCl3的饱和溶液制备氢氧化铁胶体,其反应的离子方程式为:___________ 。
【答案】(1) 8
2Fe(OH)3 + 3ClO- + 4OH- = 2 SKIPIF 1 < 0 + 3Cl- + 5H2O
① MnO2 + 4HCl(浓) SKIPIF 1 < 0 MnCl2 + Cl2↑ + 2H2O
②E C B C
③除去氯气中的氯化氢
④2OH- + Cl2 = Cl- + ClO- + H2O
⑤产生棕色的烟
⑥ Fe3+ + 3H2O SKIPIF 1 < 0 Fe(OH)3 (胶体) + 3H+
【解析】(1)根据Fe3O4 + 4CO SKIPIF 1 < 0 3Fe + 4CO2可知,1mlFe3O4参加反应,Fe原子得电子,而C原子失去电子,4mlCO作还原剂,化合价从+2价升到+4价,所以每摩尔Fe3O4被还原有8ml电子转移,故答案为:8;
(2) KOH浓溶液中加入NaClO和Fe(OH)3,生成K2FeO4,Fe元素的化合价升高,则Cl元素的化合价降低,由电子、电荷守恒可知,离子反应为2Fe(OH)3 + 3ClO- + 4OH- = 2 SKIPIF 1 < 0 + 3Cl- + 5H2O,故答案为:2Fe(OH)3 + 3ClO- + 4OH- = 2 SKIPIF 1 < 0 + 3Cl- + 5H2O;
(3)①A中发生反应的化学方程式为MnO2 + 4HCl(浓) SKIPIF 1 < 0 MnCl2 + Cl2↑ + 2H2O,故答案为:MnO2 + 4HCl(浓) SKIPIF 1 < 0 MnCl2 + Cl2↑ + 2H2O;
②制备氯气中含有氯化氢和水蒸气,除去氯化氢气体用饱和食盐水,除去水蒸气用浓硫酸,应先除氯化氢,后干燥,还要防止氯化铁水解,最后吸收尾气中未反应的氯气,防止污染空气,所以装置顺序为A→E→C→B→C→D,故答案为:E;C;B;C;
③E的作用为吸收氯气中的氯化氢,故答案为:除去氯气中的氯化氢;
④D中的离子反应为2OH-+Cl2=Cl-+ClO-+H2O,故答案为:2OH-+Cl2=Cl-+ClO-+H2O;
⑤反应开始后,B中硬质玻璃管内的现象为产生棕色的烟,故答案为:产生棕色的烟;
⑥FeCl3的饱和溶液制备氢氧化铁胶体,离子方程式为:Fe3+ + 3H2O SKIPIF 1 < 0 Fe(OH)3 (胶体) + 3H+,故答案为:Fe3+ + 3H2O SKIPIF 1 < 0 Fe(OH)3 (胶体) + 3H+。
氧化物
性质比较
FeO
Fe2O3
Fe3O4
俗称
——
铁红
磁性氧化铁
颜色状态
黑色粉末
红棕色粉末
黑色晶体
铁的价态
+2
+3
+2、+3
水溶性
不溶于水
稳定性
不稳定
6FeO+O2 SKIPIF 1 < 0 2Fe3O4
稳定
稳定
与非氧化性酸
FeO+2HCl===FeCl2+H2O FeO+2H+===Fe2++H2O
Fe2O3+6HCl===2FeCl3+3H2O Fe2O3+6H+===2Fe3++3H2O
Fe3O4+8HCl===FeCl2+2FeCl3+4H2O Fe3O4+8H+===Fe2++2Fe3++4H2O
与氧化性酸
①3FeO+10HNO3===3Fe(NO3)3+NO↑+5H2O
3FeO+10H++NO3-===3Fe3++NO↑+5H2O
②Fe2O3+6HNO3===2Fe(NO3)3+3H2O
Fe2O3+6H+===2Fe3++3H2O
③3Fe3O4+28HNO3===9Fe(NO3)3+NO↑+14H2O
3Fe3O4+28H++NO3-===9Fe3++NO↑+14H2O
与还原性酸
④FeO+2HI===FeI2+H2O
FeO+2H+===Fe2++H2O
⑤Fe2O3+6HI===2FeI2+I2+3H2O
Fe2O3+6H++2I-===2Fe2++I2+3H2O
⑥Fe3O4+8HI===3FeI2+I2+4H2O
Fe3O4+8H++2I-===3FeI2+I2+4H2O
高中化学人教版 (2019)必修 第一册第三章 铁 金属材料第一节 铁及其化合物同步达标检测题: 这是一份高中化学人教版 (2019)必修 第一册第三章 铁 金属材料第一节 铁及其化合物同步达标检测题,共10页。
化学必修 第一册第一节 铁及其化合物练习题: 这是一份化学必修 第一册第一节 铁及其化合物练习题,共10页。
人教版 (2019)必修 第一册第一节 铁及其化合物练习题: 这是一份人教版 (2019)必修 第一册第一节 铁及其化合物练习题,共10页。试卷主要包含了单质铁,铁与水蒸气的反应,铁与酸或盐反应,铁的氧化物等内容,欢迎下载使用。














