
人教版 (2019)选择性必修1第四章 化学反应与电能第一节 原电池同步训练题
展开一、单选题
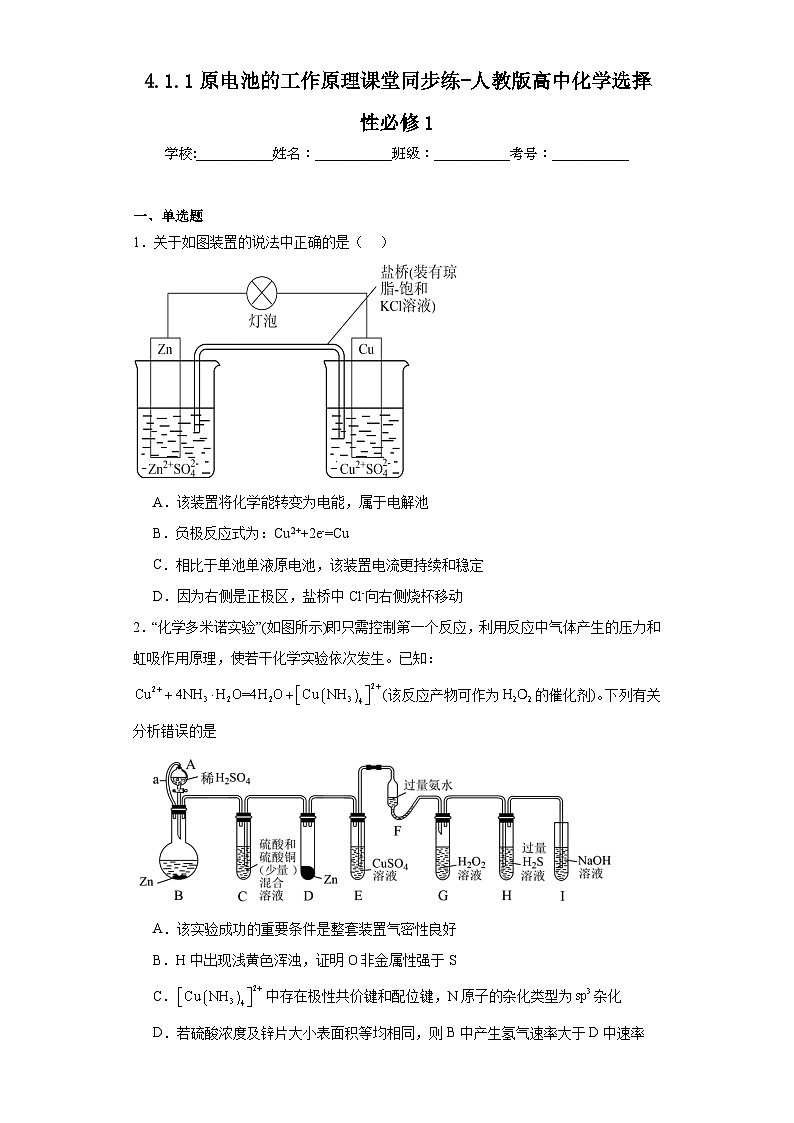
1.关于如图装置的说法中正确的是( )
A.该装置将化学能转变为电能,属于电解池
B.负极反应式为:Cu2++2e-=Cu
C.相比于单池单液原电池,该装置电流更持续和稳定
D.因为右侧是正极区,盐桥中Cl-向右侧烧杯移动
2.“化学多米诺实验”(如图所示)即只需控制第一个反应,利用反应中气体产生的压力和虹吸作用原理,使若干化学实验依次发生。已知:(该反应产物可作为的催化剂)。下列有关分析错误的是
A.该实验成功的重要条件是整套装置气密性良好
B.H中出现浅黄色浑浊,证明O非金属性强于S
C.中存在极性共价键和配位键,N原子的杂化类型为杂化
D.若硫酸浓度及锌片大小表面积等均相同,则B中产生氢气速率大于D中速率
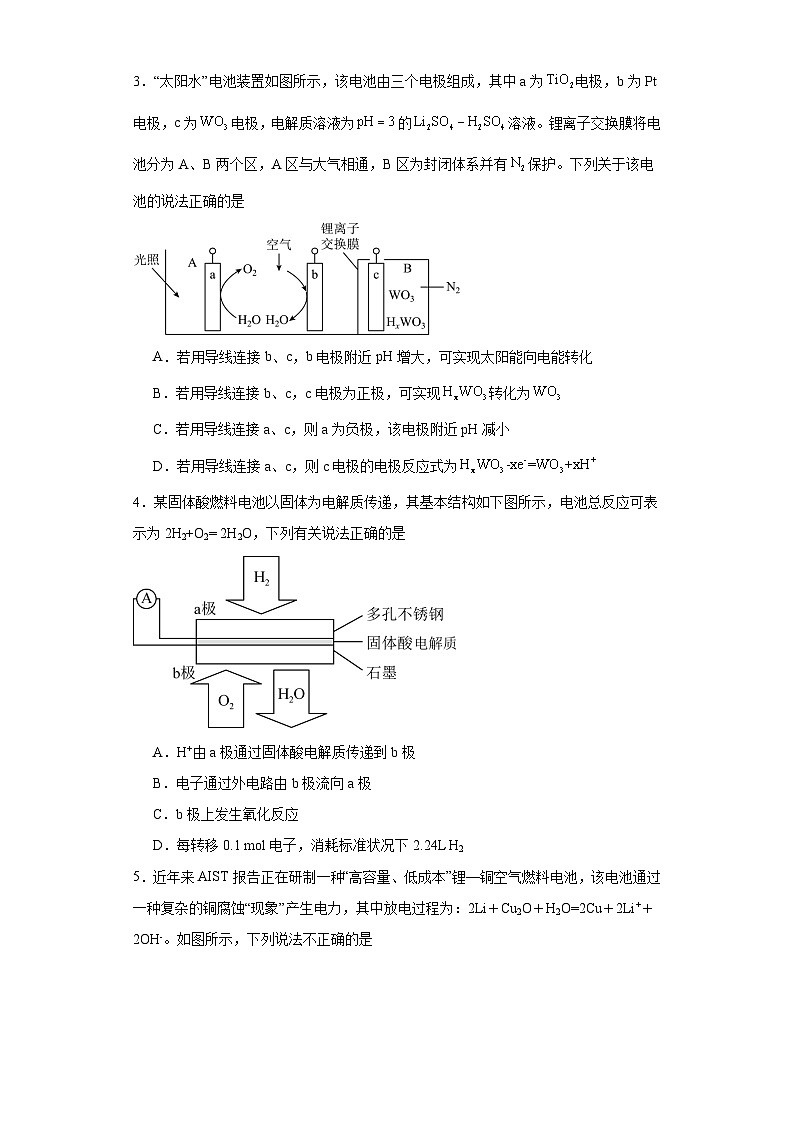
3.“太阳水”电池装置如图所示,该电池由三个电极组成,其中a为电极,b为Pt电极,c为电极,电解质溶液为的溶液。锂离子交换膜将电池分为A、B两个区,A区与大气相通,B区为封闭体系并有保护。下列关于该电池的说法正确的是
A.若用导线连接b、c,b电极附近pH增大,可实现太阳能向电能转化
B.若用导线连接b、c,c电极为正极,可实现转化为
C.若用导线连接a、c,则a为负极,该电极附近pH减小
D.若用导线连接a、c,则c电极的电极反应式为
4.某固体酸燃料电池以固体为电解质传递,其基本结构如下图所示,电池总反应可表示为2H2+O2= 2H2O,下列有关说法正确的是
A.H+由a极通过固体酸电解质传递到b极
B.电子通过外电路由b极流向a极
C.b极上发生氧化反应
D.每转移0.1 ml电子,消耗标准状况下2.24L H2
5.近年来AIST报告正在研制一种“高容量、低成本”锂—铜空气燃料电池,该电池通过一种复杂的铜腐蚀“现象”产生电力,其中放电过程为:2Li+Cu2O+H2O=2Cu+2Li++2OH-。如图所示,下列说法不正确的是
A.放电时,Li+透过固体电解质向Cu极移动
B.放电时,负极的电极反应式为Cu2O+H2O+2e-=2Cu+2OH-
C.通空气时,铜被腐蚀,表面产生Cu2O
D.整个反应过程中,铜相当于催化剂
6.是汽车尾气中的主要污染物之一、通过传感器可监测的含量,其工作原理如图所示。下列说法正确的是
A.电极作负极,电极作正极
B.电极上发生的是氧化反应
C.电极上发生的是还原反应
D.电极的电极反应式为
7.下列说法正确的是
A.原电池中,负极上发生的反应是还原反应
B.原电池中,电流的方向是负极−导线−正极
C.双液原电池中的盐桥是为了连通电路,所以也可以用金属导线代替
D.在原电池中,阳离子移向正极,阴离子移向负极
8.锂锰电池的体积小、性能优良,是常用的一次电池。该电池基本原理如图所示,其中电解质LiClO4溶于混合有机溶剂中,Li+通过电解质迁移入MnO2晶格中,生成LiMnO2.下列说法正确的是
A.外电路的电流方向是由a极流向b极
B.电池负极反应式为MnO2+e-+Li+=LiMnO2
C.该电池电解液可用LiClO4水溶液代替
D.从废旧锂锰电池的正极材料中可回收金属Li、Mn
9.某同学设计了如图所示的原电池,发现一开始电流计指针偏向铝,随后又转而偏向镁。下列说法不正确的是
A.镁比铝活泼,始终作负极,发生氧化反应
B.最终铝电极逐渐溶解,镁电极表面出现大量气泡
C.电流计指针偏转方向改变后,溶液中OH-流向铝电极
D.铝电极的电极反应式:
10.下图为番茄电池装置示意图,下列说法正确的是
A.铜片上发生氧化反应B.锌片质量减小,发生还原反应
C.电子由锌片通过导线流向铜片D.该装置可将电能转化为化学能
二、填空题
11.微型纽扣电池在现代生活中有广泛应用,有一种银锌电池,其电极分别是Ag2O和Zn,电解质溶液为KOH溶液,总反应为Ag2O+Zn=ZnO+2Ag,其中一个电极反应为Ag2O+H2O+2e-=2Ag+2OH-。
(1)判断正负极的材料。
负极材料 ,正极材料 。
(2)写出另一电极的电极反应式,并判断反应类型。
电极反应式
反应类型
(3)判断电池工作时,电子的流动方向和电解质溶液中离子的流动方向。电子由 到 ,溶液中的阳离子流向电池的 ,阴离子流向
(4)在电池使用的过程中,电解质溶液中KOH的物质的量怎样变化? (增大、减小、不变)
(5)当电池工作时通过电路对外提供了1 ml电子,计算消耗的负极的质量 。
(6)氢氧燃料电池为绿色化学电源,在碱性NaOH溶液为电解质溶液时的负极电极反应式为 。
12.据图回答下列问题:
(1)若烧杯中溶液为氢氧化钠溶液,则负极为 (填Mg或Al),总反应方程式为 。
(2)美国阿波罗宇宙飞船上使用了一种新型装置,其构造如下图所示:A、B两个电极均由多孔的碳块组成。该电池的正极反应式为: 。
(3)如果将上述装置中通入的H2改成CH4气体,也可以组成一个原电池装置,电池的总反应方程式为:CH4+2O2+2KOH=K2CO3+3H2O,则该电池的负极反应式为: 。
13.电能是现代社会应用最广泛的能源之一。某原电池装置如图所示。
(1)Cu电极为原电池的 极(填“正”或“负”),电极反应式是 。
(2)Zn电极上发生的反应属于 (填“氧化”或“还原”) 反应,当有13克Zn溶解时,导线中通过的电子数目为 。
14.原电池揭示了氧化还原反应的本质是电子转移,实现了化学能转化成电能,使氧化还原反应在现代生活中获得重大应用,从而改变了人们的生活方式。某兴趣小组为探究原电池工作原理,利用金属Zn与稀H2SO4反应,通过如图所示装置A、B进行实验,实验过程中装置A内溶液的温度升高,装置B的电流计指针发生偏转。
根据所学知识,完成下列各题:
(1)装置B为原电池,则Cu作 (填“正”或“负”)极,Zn电极上的电极反应式为 。
(2)一般把金属导线称为“电子导体”,把电解质溶液称为“离子导体”。装置B中电池工作时“电子导体”中电子的流动方向可描述为 。
(3)从能量转化的角度来看,装置A中反应物的总能量 (填“高于”、“低于”或“=”)生成物的总能量;从反应速率的角度上看,可以观察到A中反应比B中 (填“快”或“慢”)。
(4)该小组同学由此得出的结论错误的是 。(多选)
A.任何自发进行的氧化还原反应均可以设计成原电池
B.装置B中Cu电极不可用碳棒代替
C.原电池的负极发生还原反应
D.原电池装置中化学能全部转化为电能
15.某学习小组用如图所示A、B装置分别探究金属锌与稀硫酸的反应,实验过程中A装置烧杯内的溶液温度升高,B装置的电流计指针发生偏转。
(1)装置B烧杯中发生反应的离子方程式为 。
(2)B装置中锌做 极, 铜做 极 (填“正”或“负”)。电子由 极流向 极 (填“Zn”或“Cu”)
(3)Cu板上的现象是 ,发生的电极反应是 。
(4)该小组同学反思原电池的原理,其中观点正确的是_______(填字母)。
A.原电池反应的过程中可能没有电子发生转移
B.原电池装置需要2个电极
C.电极一定不能参加反应
D.氧化反应和还原反应可以拆开在两极发生
16.有如下两个反应:A.2HCl+Ba(OH)2=BaCl2+2H2O B.2Fe3++Cu=2Fe2++Cu2+
(1)根据两反应的本质,判断 能设计成原电池。(填“A”或“B” )。
(2)根据能设计成原电池的反应选择适合的材料和试剂设计一个原电池:
负极材料是 ,正极材料是 ,电解质溶液是 ;
(3)写出负极的电极反应式: (发生 反应),原电池工作时溶液中的Cl-移向 极移动(填正或负)。
17.将A、B两个电极,分别用接线柱平行地固定在一块塑料板上,与电流表连结,插入盛有溶液C的小烧杯中。试回答下列问题:
(1)若A、B分别为铜和铝C为浓,原电池的负极为 (填“铝”或“铜”)极,铝片上的电极反应式为: 。
(2)若A、B分别为镁和铝,C为氢氧化钠溶液,原电池的负极为 (填“铝”或“镁”)极铝片上的电极反应式为: 。
(3)若A、B分别为碳和铝,C为氯化钠溶液,原电池正极上的电极反应式为: 。
18.研究化学反应的原理,对掌握物质的应用有重要的意义。
Ⅰ.硅是太阳能电池的重要材料。“精炼硅”反应历程中的能量变化如下图所示:
(1)工业上用,为原料制备粗硅。反应的化学方程式为 。
(2)反应Ⅲ生成2ml Si(s)时, (填“吸收”或“放出”) 热量。
(3)在2L密闭容器中投入过量Si(s)和3ml HCl(g)发生反应Ⅰ,经过t min反应达到平衡状态,测得容器中HCl的平衡浓度为0.6。
①反应开始到t min,用HCl浓度变化表示的平均反应速率为 。
②下列叙述不能说明反应Ⅰ一定达到平衡状态的是 (填标号)。
A. B.硅的质量保持不变
C.HCl的质量分数保持不变 D.保持不变
Ⅱ.用于检测酒驾的酸性燃料电池酒精检测仪工作原理如图所示。
(4)电极X为 (填“正极”、“负极”)。
(5)电池工作时,质子通过交换膜 (填“从左到右”“从右到左”)迁移。
(6)正极的电极反应式为 。
19.如图所示,组成一个原电池.
当电解质溶液为硝酸银溶液时:
①Fe电极是 (填“正”或“负”)极,其电极反应为 ,该反应是 (填“氧化”或“还原”)反应;
②Cu电极是 电极,其电极反应为 ,该反应是 反应(填“氧化”或“还原”).
20.如图所示,是原电池的装置图。请回答:
(1)若溶液C 为稀H2SO4溶液,电流表指针发生偏转,B 电极材料为Fe 且作负极,则 A 电极上发生的电极反应为 。
(2)若需将反应 Cu+2Fe3+=Cu2++2Fe2+设计成如图所示的原电池装置,则 A 极(负极)材料为 , B 极电极反应式为 。
(3)若 C 为 CuCl2溶液,Zn 是 极(填正极或负极),Cu 极发生 反应(填氧化或还原),Cu 极电极反应为 。
(4)CO 与 H2反应还可制备 CH3OH,CH3OH 可作为燃料使用,用 CH3OH 和 O2组合形成的质子交换膜燃料电池的结构示意图如下:
电池总反应为 2CH3OH+3O2=2CO2+4H2O,则电极 d 反应式为 ,若线路中转移 2 ml 电子,则上述 CH3OH 燃料电池,消耗的 O2 在标准状况下的体积为 L。
三、实验题
21.某研究性学习小组的同学对Na2SO3溶液和KIO3溶液的反应原理进行了探究。
(1)已知酸性条件下KIO3与Na2SO3反应,产物之一能使淀粉变蓝色,写出反应的离子方程式: ,该反应中有一种常见的含氧酸根离子生成,证明有该离子生成的方法是:取少量试样放入试管中, 。
(2)室温下,该小组的同学将含淀粉的0.01 ml/L Na2SO3溶液加入到0.01 ml/L KIO3酸性溶液(过量)中,观察到的现象为:5秒内无明显变化→迅速变蓝。对此现象的形成,该小组的甲同学提出了如下假设:
假设1:该变化及快慢不同的两个反应:+3-=I-+3 (I)
+5I-+6H+=3I2+3H2O (II)
假设2:开始时生成I2的反应速率慢,5秒后反应变快
乙同学经分析后认为假设2肯定不正确,他判断的依据是 。如果假设1正确,则I、II两个反应中,反应速率较快的是 (填“I”或“II”)。
(3)为了确定假设1是否正确,该小组的丙同学设计了如下图所示的实验。
实验中a极区溶液不变蓝色,由此可知假设1 (填“正确”或“错误”),b电极上电极反应式为 。
22.某兴趣小组用锡粒制备氯化锡(SnCl4)和氯化亚锡(SnCl2),流程如下:
制备SnCl4的装置如图:
已知:SnCl4为无色液体,熔点-33℃,沸点114℃,遇水强烈水解,可溶于乙醇、四氯化碳等。SnCl2·2H2O为白色晶体,在空气中加热会发生水解及氧化。SnCl2为白色晶体,熔点247℃,沸点623℃,易溶于水、乙醇、冰醋酸,极易溶于盐酸。
请回答:
(1)步骤①的反应装置如图甲,其中仪器a的作用为 。若用图乙代替图甲作为反应装置,优点是在不拆除装置的情况下,向支管不断填装锡粒大量制备SnCl4,则制备过程中将生成的SnCl4转移至蒸馏烧瓶中的简易操作为 。
(2)步骤②的装置如图丙,此装置存在一处明显的缺陷为 。
(3)步骤③选择的实验仪器为铂皿,比用玻璃仪器或陶瓷仪器更好,其理由为 。
(4)步骤⑥中的反应需在搅拌下进行,该反应的化学方程式为 。
(5)关于SnCl2的制备,下列说法不正确的是 。
A.步骤④蒸发及步骤⑦干燥时均需在真空环境下进行
B.步骤⑤抽滤操作中,将晶体转移至布氏漏斗时,若有晶体附着在烧杯内壁,应用蒸馏水将烧杯内壁的晶体淋洗至布氏漏斗中,以提高产率
C.为提高产品纯度,可在含醋酸酐的冰醋酸中重结晶
D.SnCl2·2H2O在干燥N2或干燥HCl气流中加热也可得到无水SnCl2
E.若步骤⑤产生的母液较多,可进一步浓缩母液以提高产品纯度
23.I.有甲、乙两位同学均想利用原电池反应检测金属的活动性顺序,两人均用镁片和铝片作电极,但甲同学将电极放入6 ml·L-1的H2SO4溶液中,乙同学将电极放入6 ml·L-1的NaOH溶液中,如图所示。
(1)写出甲中正极的电极反应式:
(2)乙中负极为 , 总反应的离子方程式:
(3)由此实验得出的下列结论中,正确的有_______
A.利用原电池反应判断金属活动性顺序时应注意选择合适的介质
B.镁的金属性不一定比铝的金属性强
C.该实验说明金属活动性顺序表已过时,没有实用价值了
D.该实验说明化学研究对象复杂、反应受条件影响较大,因此应具体问题具体分析
II.利用反应Cu+2FeCl3=CuCl2+2FeCl2设计成如图所示原电池,回答下列问题:
(4)写出电极反应式:正极 ;负极 。
(5)图中X溶液是 ,Y溶液是 。
参考答案:
1.C
【分析】该装置为原电池,锌易失电子作负极,铜作正极,负极上锌失电子发生氧化反应生成锌离子,正极上铜离子得电子发生还原反应生成铜。
【详解】A. 该装置将锌置换铜反应中的化学能转变为电能,属于原电池,故A错误;
B. 负极上锌失电子发生氧化反应生成锌离子,负极反应式为:Zn-2e-=Zn2+,故B错误;
C. 相比于单池单液原电池,盐桥能隔绝锌与硫酸铜溶液的接触,维持溶液的电性守恒,构成闭合回路,形成持续和平稳的电流,故C正确;
D. 原电池中,阴离子向负极移动,锌作负极,盐桥中Cl-向左侧烧杯移动,故D错误;
故选C。
2.D
【分析】由装置及原理可知,实验中生成气体,应防止装置漏气,B中生成氢气,A和B之间导管a可平衡气压,C中导管短进长出,氢气将C中溶液排入D中,B与D两容器中比较,D中形成原电池后可以加快反应速率,生成的氢气将E中硫酸铜排入F中发生Cu2++4NH3•H2O═4H2O+[Cu(NH3)4]2+,然后进入G中,作H2O2的催化剂可加快反应进行,气流过快时H中过氧化氢与硫化氢反应生成S,I中NaOH溶液吸收尾气,以此解答该题。
【详解】A.进行实验前必须进行的操作检验装置的气密性,一旦漏气实验失败,故A正确;
B.氧气和硫化氢反应生成硫,H中出现浅黄色浑浊,可证明O非金属性强于S,故B正确;
C.中存在N-H极性共价键和配位键,NH3中N原子价层电子对数为3+ =4,N原子的杂化类型为杂化,故C正确;
D.装置B与D中比较,D中形成原电池后可以加快反应速率,则若硫酸浓度及锌片大小表面积等均相同,则B中产生氢气速率小于D中速率,故D错误;
故选D。
3.C
【详解】A.用导线连接b、c,b电极发生O2→H2O,为正极,电极反应式为O2+4H++4e−=2H2O,b电极附近pH增大,可实现化学能向电能转化,故A错误;
B.c电极为负极,发生反应:HxWO3−xe−=WO3+xH+,可实现HxWO3转化为WO3,故B错误;
C.由图可知,连接a、c时,a电极上H2O→O2,发生失电子的氧化反应,则a电极为负极,电极反应式为2H2O-4e-=O2↑+4H+,生成H+,a电极附近pH减小,故C正确;
D.由图可知,连接a、c时,a电极为负极,c电极为正极,正极上发生得电子的还原反应,电极反应式为WO3+xH++xe−=HxWO3,故D错误;
答案选C。
4.A
【分析】氢氧燃料电池中,通入氢气的一极为负极,负极发生氧化反应,通入氧气的一极为正极,正极发生还原反应,则a极为负极,b极为正极。
【详解】A.由上述分析可知,a电极为负极,b电极为正极,工作时阳离子向正极移动,即H+由a极通过固体酸电解质传递到b极,故A正确;
B.a电极为负极,b电极为正极,电子从负极沿导线流向正极,即电子通过外电路由a极流向b极,故B错误;
C.b电极为正极,正极发生还原反应,故C错误;
D.负极反应式为H2-2e-=2H+,每转移0.1ml电子,负极上消耗0.05mlH2,标准状况下体积为0.05ml×22.4L/ml=1.12L,故D错误;
故答案选A。
5.B
【详解】A.放电时,阳离子向正极移动,则Li+透过固体电解质向Cu极移动,A正确;
B.放电时,锂失去电子为负极,负极的电极反应式为Li-e-=Li+,B错误;
C.通空气时,铜被腐蚀,表面产生Cu2O,C正确;
D.通空气时,铜被腐蚀,表面产生Cu2O,放电时Cu2O转化为Cu,则整个反应过程中,铜相当于催化剂,D正确;
故合理选项是B。
6.D
【分析】根据氧离子迁移过程和原电池“同性相吸”得到NiO电极为负极,Pt为正极。
【详解】A.根据前面分析电极作正极,电极作负极,故A错误;
B.电极为正极,发生的是还原反应,故B错误;
C.电极是负极,发生的是氧化反应,故C错误;
D.电极上是一氧化氮失去电子和氧离子结合生成二氧化氮,其电极反应式为,故D正确;
综上所述,答案为D。
7.D
【详解】A项、原电池中,负极上发生氧化反应,故A错误;
B项、原电池中,电流的方向是电子移动方向的反向,应是正极−导线−负极,故B错误;
C项、盐桥的作用是通过离子的定向移动,构成闭合回路,不能用导线代替,故C错误;
D项、在原电池中,阳离子移向正极,阴离子移向负极,故D正确;
故选D。
8.D
【分析】形成原电池反应时,Li为负极,被氧化,电极方程式为Li-e-=Li+,MnO2为正极,被还原,电极方程式为MnO2+e-+Li+=LiMnO2。
【详解】A. Li为负极,MnO2为正极,原电池工作时,外电路的电流方向从正极到负极,即从b极流向a极,故A错误;
B. Li为负极,被氧化,电池负极电极方程式为Li-e-=Li+,故B错误;
C. 因负极材料为Li,可与水反应,则不能用水代替电池中的混合有机溶剂,故C错误;
D. 从废旧锂锰电池的正极材料中可回收金属Li、Mn,故D正确;
故选D。
9.A
【详解】A.电流表指针偏向正极。由于金属活动性:Mg>Al,在开始时Mg为负极,Al为正极,电流表指针偏向Al。后由于Mg不能与NaOH反应,而Al能够与NaOH溶液反应,所以Al为负极,Mg为正极,因此电流表指针又偏向Mg,A错误;
B.由于Al能够与NaOH反应反应产生NaAlO2、H2,而Mg不能反应,因此Al为原电池的负极,Al不断溶解消耗,电子由导线经电流表流向正极Mg,水电离产生的H+在正极Mg上得到电子变为H2逸出,因此看到镁电极表面出现大量气泡,B正确;
C.电流计指针偏转方向改变后,Al为负极,Mg为正极,溶液中OH-移向正电荷增多的负极铝电极,C正确;
D.Al电极为负极,Al失去电子变为Al3+,与溶液中的OH-结合形成、H2O,故负极的电极反应式为:2Al-6e-+8OH-=2+4H2O,D正确;
故合理选项是A。
10.C
【分析】根据金属的活泼性知,酸性条件下,锌作负极,铜作正极,负极上锌失电子、发生氧化反应,正极上得电子、发生还原反应,电子从负极沿导线流向正极,电流从正极沿导线流向负极,据此解答。
【详解】A.该原电池中,锌作负极,发生失电子的氧化反应,铜作正极,得电子、发生还原反应,故A错误;
B.该原电池中,锌作负极,发生失电子的氧化反应,即Zn-2e-=Zn2+,锌片质量会减少,故B错误;
C.该原电池中,锌作负极,铜作正极,电子从负极Zn沿导线流向正极Cu片,故C正确;
D.该装置是原电池是将化学能转化为电能的装置,故D错误;
故选C。
11. Zn Ag2O Zn+2OH--2e-=ZnO+H2O 氧化反应 负 正 正 负 不变 32.5g H2+2OH--2e-=2H2O
【分析】总反应为Ag2O+Zn=ZnO+2Ag,其中一个电极反应为Ag2O+H2O+2e-=2Ag+2OH-,Ag2O变成Ag,Ag的化合价从+1变为0,化合价降低,则该电极反应化合价降低、被还原,是正极。
【详解】(1)由分析可知,Zn为负极,Ag2O为正极,故答案为:Zn;Ag2O;
(2)Ag2O+H2O+2e-=2Ag+2OH-为正极反应,负极失电子,被氧化,则负极反应为:Zn+2OH--2e-=ZnO+H2O,故答案为:Zn+2OH--2e-=ZnO+H2O;氧化反应;
(3)原电池中,电子由负极经导线流回正极,溶液中离子流向为阳离子流向正极,阴离子流向负极,故答案为:负;正;正;负;
(4)从总反应Ag2O+Zn=ZnO+2Ag来看,反应不涉及KOH,故答案为:不变;
(5)Zn-+2OH-+2e-=ZnO+H2O
65g 2ml
m 1ml 列式解得:m=32.5g
故答案为:32.5g;
(6)碱性氢氧燃料电池的负极反应式为:H2+2OH--2e-=2H2O,故答案为:H2+2OH--2e-=2H2O。
【点睛】正极-得电子-化合价升高-被氧化,负极-失电子-化合价降低-被还原。原电池的题是高考高平考点,熟练运用原电池工作基本原理,是解决本类题的关键,有些题从化合价入手,有些题从电子入手,有些题从反应类型入手,轻而易举就拿下了。
12. Al 2Al+2NaOH+2H2O=2NaAlO2+3H2↑ O2+2H2O+4e-=4OH- CH4+10OH--8e-=CO32-+7H2O
【详解】(1)如图装置为原电池,若烧杯中溶液为氢氧化钠溶液,由于铝能与氢氧化钠溶液反应,则负极是铝,镁是正极,总反应式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑。
(2)氧气得到电子发生还原反应,在正极通入,电解质溶液显碱性,则正极反应式为O2+2H2O+4e-=4OH-。
(3)甲烷失去电子发生氧化反应,在负极通入,电解质溶液显碱性,则该电池的负极反应式为CH4+10OH--8e-=CO32-+7H2O。
【点睛】该题的难点是正负极判断:首先原电池正、负极的判断基础是自发进行的氧化还原反应,如果给出一个化学反应方程式判断正、负极,可以直接根据化合价的升降来判断,发生氧化反应的一极为负极,发生还原反应的一极为正极。其次判断电极时,不能简单地依据金属的活泼性来判断,要看反应的具体情况,如:a.Al在强碱性溶液中比Mg更易失电子,Al作负极,Mg作正极;b.Fe、Al在浓HNO3中钝化后,比Cu等金属更难失电子,Cu等金属作负极,Fe、Al作正极。
13. 正 2H++2e-=H2↑ 氧化 0.4NA
【详解】(1)金属性锌强于铜,则Cu电极为原电池的正极,溶液中氢离子放电,电极反应式是2H++2e-=H2↑。
(2)Zn电极是负极,负极上发生的反应属于氧化反应,当有13克Zn溶解时,锌的物质的量是13g÷65g/ml=0.2ml,根据Zn-2e-=Zn2+可知导线中通过的电子数目为0.4NA。
14.(1) 正 Zn-2e=Zn2+
(2)电子从负极(Zn)流出经外电路流向正极(Cu)
(3) 高于 慢
(4)BCD
【详解】(1)由于金属活动性Zn>Cu,所以在装置B构成的原电池中Cu作正极,Zn电极是负极,失去电子变为Zn2+进入溶液,故Zn电极的反应式是: Zn-2e=Zn2+;
(2)装置B中电池工作时“电子导体”中电子的流动方向可描述为电子从负极(Zn)流出经外电路流向正极(Cu);
(3)在装置A中Zn与硫酸发生置换反应产生ZnSO4、H2,发生反应过程中会放出热量,使溶液的温度升高,说明反应物的总能量大于生成物的总能量;
B中形成原电池,反应速率加快,故从反应速率的角度上看,可以观察到A中反应比B中慢;
(4)A.构成原电池内界条件是自发的发生氧化还原反应,所以理论上,任何自发进行的氧化还原反应均可以设计成原电池,选项A正确;
B.装置B中Cu电极可用碳棒代替,作为正极,锌为负极,形成原电池原理不变,选项B错误;
C.原电池的负极发生失电子的氧化反应,选项C错误;
D.原电池装置中化学能主要转化为电能,也有部分转化为热能等,选项D错误;
答案选BCD。
15.(1)
(2) 负 正 Zn Cu
(3) 产生气泡
(4)BD
【分析】A装置中,锌与稀硫酸反应生成硫酸锌和氢气,且实验过程中A装置烧杯内的溶液温度升高,则该反应放热,B装置形成了锌-铜原电池,锌活泼性强,为负极,则铜为正极,装置中电流计指针发生偏转,据此解答。
【详解】(1)装置B烧杯中发生反应的离子方程式为:;故答案为:。
(2)B装置为原电池,其中锌做负极,铜做正极;电子由负极流向正极,即由Zn极流向Cu极;故答案为:负;正;Zn;Cu。
(3)Cu板上会产生气泡,发生的电极反应是:;故答案为:产生气泡;。
(4)A.原电池要能自发进行氧化还原反应,所以一定有电子的转移,故A错误;
B.原电池的构成条件必须有两个电极,故B正确;
C.活泼金属作负极,失电子发生氧化反应,正极得电子发生还原反应,一般负极发生反应溶解,正极质量增加或析出气体,故C错误;
D.原电池中,负极发生氧化反应,正极发生还原反应,分别在两极发生,故D正确;
故答案为:BD。
16.(1)B
(2) Cu 石墨 FeCl3
(3) Cu-2e-=Cu2+ 氧化 负
【详解】(1)只有自发的氧化还原反应才能设计成原电池。A是复分解反应,没有电子转移,不能设计成原电池,B是自发的氧化还原反应,能设计成原电池。
(2)2Fe3++Cu=2Fe2++Cu2+,根据方程式可知,铜的化合价升高,失电子,应作为原电池的负极,铁离子化合价降低,得到电子,故电解质溶液选择含Fe3+的溶液,可选用氯化铁溶液,正极可选用惰性电极石墨(Pt亦可)。
(3)铜为负极,电极反应式为Cu-2e-=Cu2+,溶液中阴离子移向负极。
17. 铜 铝
【详解】(1)在浓硝酸中,铝被钝化,铜溶解,所以铜易失电子为负极,铝是正极,正极上硝酸根离子得电子生成二氧化氮,正极电极方程式为;
(2)该原电池中,Al易失电子作负极,Mg作正极,Al极上铝失电子生成偏铝酸根离子,铝片上的电极反应式为:;
(3)该原电池中,Al易失电子作负极,碳作正极,正极上氧气得电子生成氢氧根离子,正极的电极方程式为:。
18.(1)
(2) 吸收 476kJ
(3) 0.9/t AD
(4)负极
(5)从左到右
(6)
【分析】乙醇酸性燃料电池中,乙醇发生失电子的氧化反应生成醋酸,则乙醇所在铂电极为负极、O2所在的铂电极为正极,负极反应式为CH3CH2OH-4e-+H2O=4H++CH3COOH,O2所在的铂电极为正极、发生得电子的还原反应,电极正极反应式为O2+4e-+4H+=2H2O,放电时,电子由负极经过导线流向正极,阳离子由负极通过交换膜移向正极,据此分析解答。
【详解】(1)粗硅冶炼原理是用C在高温条件下还原二氧化硅生成硅和一氧化碳,反应方程式为;
(2)反应Ⅲ中,反应物总能量小于生成物总能量,为吸热反应,反应Ⅲ生成2ml Si(s)时,吸收2×238=476kJ热量;
(3)①开始HCl浓度为,反应开始到t min,用HCl浓度变化表示的平均反应速率为;
②A.正逆反应速率相等时反应达到平衡,才能说明平衡,故A选;
B.反应过程中硅的质量是一变量,当其保持不变时,反应达到平衡,故B不选;
C.HCl的质量分数即HCl的质量保持不变,反应达到平衡,故C不选;
D.与起始加入量和转化量有关,不能判断平衡状态,故D选;
故选AD;
(4)该原电池中电极X上CH3CH2OH氧化生成CH3COOH,电极X是负极;
(5)该原电池中乙醇所在铂电极为负极、O2所在的铂电极为正极,工作时阳离子由负极移向正极,即质子由图中左边的极室穿过质子交换膜进入右边的极室;
(6)O2所在的铂电极为正极、发生得电子的还原反应,电极正极反应式为O2+4e-+4H+=2H2O。
19. 负 Fe-2e-=Fe2+ 氧化 正 Ag++e-=Ag 还原
【详解】Fe比Cu活泼,当电解质溶液为硝酸银溶液时,构成原电池:
①Fe电极是负极,其电极反应为Fe-2e-=Fe2+,该反应是氧化反应;
②Cu电极是正电极,其电极反应为 Ag++e-=Ag,该反应是还原。
20. 2H++2e- =H2↑ Cu 或铜 2Fe3++2e- =2Fe2+ 负 还原 Cu2++2e- =Cu O2+ 4H++ 4e- =2H2O 11.2
【详解】(1)若溶液C 为稀H2SO4 溶液,电流表指针发生偏转,B 电极材料为Fe 且作负极,说明形成了原电池,铁失电子发生氧化反应,则 A 电极上得电子,发生还原反应,发生的电极反应为2H++2e- =H2↑。故答案为:2H++2e- =H2↑;
(2)若需将反应 Cu+2Fe3+=Cu2++2Fe2+设计成如图所示的原电池装置,铜是还原剂,作负极,则 A 极(负极)材料为Cu 或铜, B 极得电子发生还原反应,电极反应式为2Fe3++2e- =2Fe2+。故答案为:Cu 或铜;2Fe3++2e- =2Fe2+;
(3)若 C 为 CuCl2 溶液,Zn是活泼金属,作负极(填正极或负极),Cu 极发生还原反应(填氧化或还原),Cu 极电极反应为Cu2++2e- =Cu。故答案为:负;还原;Cu2++2e- =Cu;
(4)电池总反应为 2CH3OH+3O2=2CO2+4H2O,则电极 d 得电子发生还原反应,反应式为O2+ 4H++ 4e- =2H2O,若线路中转移 2 ml 电子,则上述 CH3OH 燃料电池,消耗的 O2 在标准状况下的体积为 =11.2 L。故答案为:O2+ 4H++ 4e- =2H2O;11.2。
21. 2+5+2H+=5+I2 +H2O 加入过量稀盐酸酸化后,再滴加少量BaCl2溶液,有白色沉淀生成 开始时反应物浓度处于最大状态,反应速率应最大 II 正确 +H2O-2e-=+2H+
【分析】(1)在酸性条件下KIO3与Na2SO3发生氧化还原反应,产生I2、Na2SO4及水,根据电子守恒、原子守恒、电荷守恒,书写离子方程式;利用BaSO4的不溶性检验;
(2)根据浓度对化学反应速率的影响分析判断;结合反应现象判断反应快慢;
(3)实验中a极区溶液不变蓝色,说明a区开始冒烟生成I2,证明反应分步进行;在b电极上,失去电子被氧化为,据此书写电极反应式。
【详解】(1)在酸性条件下KIO3具有氧化性,会将Na2SO3氧化为Na2SO4,KIO3被还原为I2,同时产生水,根据电子守恒、原子守恒、电荷守恒,可得离子方程式:2+5+2H+=5+I2 +H2O;
反应得到的含氧酸根离子是,检验其存在的方法是:取少量试样放入试管中,加入过量稀盐酸酸化,然后再滴加少量BaCl2溶液,若有白色沉淀生成,就证明含有;
(2)由于反应开始时反应物浓度处于最大状态,反应速率应最大,而反应现象却是:5秒内无明显变化,后来迅速变蓝,说明假设2错误;
若假设1正确,发生了两个反应,由于反应开始的前5秒内无明显变化,后来迅速变蓝,说明反应I缓慢,反应II速率较快;
(3)实验中a极区溶液不变蓝色,说明a区开始没有生成I2,当形成闭合回路后,a电极得到电子,发生还原反应,电极反应式为:+6e-+6H+=I-+3H2O,反应产生的I-再进一步与溶液中的离子发生反应:+5I-+6H+=3I2+3H2O;b电极失去电子,发生氧化反应,b电极上电极反应式为+H2O-2e-=+2H+,从而证明了假设I正确。
【点睛】本题考查了氧化还原反应方程式的书写、离子的检验、化学反应原理的应用、原电池反应原理。掌握氧化还原反应、离子反应的规律及原电池反应原理是本题解答的关键。注意守恒方法在电极式及离子方程式书写的应用。
22.(1) 冷凝回流 用橡皮球洗耳球从冷凝管上口向装置中鼓气,将液体从左端导管压入蒸馏烧瓶中
(2)锥形瓶上口缺少隔绝空气中水蒸气的装置
(3)能形成原电池,加快锡与盐酸的反应速率
(4)SnCl2·2H2O+2(CH3CO)2=SnCl4+4CH3COOH
(5)BE
【分析】某兴趣小组用锡粒制备氯化锡(SnCl4)和氯化亚锡(SnCl2),由流程可知锡粒与干燥氯气反应可生成SnCl4,与过量盐酸反应,煮沸,过滤,经蒸发结晶、抽滤得到SnCl2·2H2O,加入醋酸酐,静置、抽滤、干燥、洗涤可得到SnCl2,以此分析解答该题。
【详解】(1)步骤①中的仪器a为球形冷凝管,其作用是冷凝回流;利用压强原理,将生成的SnCl4转移至蒸馏烧瓶中的简易操作为:用橡皮球(洗耳球)从冷凝管上口向装置中鼓气,将液体从左端导管压入蒸馏烧瓶中;
(2)步骤②的装置是用来制取氯化亚锡(SnCl2)的,由于氯化亚锡(SnCl2)易溶于水,所有制取后锥形瓶不能敞口,否则水蒸气就会进入锥形瓶,故此装置存在一处明显的缺陷为:锥形瓶上口缺少隔绝空气中水蒸气的装置;
(3)锡比铂金属性活泼,在盐酸中可形成原电池,加快反应速率,所以步骤③选择的实验仪器为铂皿,比用玻璃仪器或陶瓷仪器更好;
(4)步骤⑥中的反应是氯化亚锡晶体与醋酸酐反应,生成醋酸和氯化亚锡,该反应的化学方程式为:SnCl2·2H2O+2(CH3CO)2=SnCl4+4CH3COOH;
(5)A.因为SnCl2·2H2O为白色晶体,在空气中加热会发生水解及氧化,所以步骤④蒸发及步骤⑦干燥时均需在真空环境下进行,A正确;
B.抽滤是用于分离粒径较细的沉淀与溶剂,利用抽气泵使抽滤瓶中的压强降低,加快过滤速度,步骤⑤抽滤操作中,将晶体转移至布氏漏斗时,若有晶体附着在烧杯内壁,用蒸馏水将烧杯内壁的晶体淋洗至布氏漏斗中,不能提高产率,B错误;
C.因为SnCl2为白色晶体,易溶于水、乙醇、冰醋酸,所以为提高产品纯度,可在含醋酸酐的冰醋酸中重结晶,C正确;
D.因为SnCl2·2H2O在空气中加热会发生水解及氧化,所以在干燥N2中加热可隔绝空气,在干燥HCl气流中加热可抑制氯化亚锡发生水解,也可得到无水SnCl2,D正确;
E.若步骤⑤产生的母液中主要成分为盐酸,进一步浓缩母液对产品纯度没有影响, E错误;
故答案为合理选项是BE。
23.(1)2H++2e-=H2↑
(2) Al 2Al+2OH-+2H2O=2+3H2↑
(3)AD
(4) 2Fe 3++2e- = 2Fe 2+ Cu-2e- =Cu2+
(5) FeCl3 CuCl2
【分析】I.甲中Mg和H2SO4反应生成MgSO4和H2,Mg是负极,Al是正极;乙中Al和NaOH反应生成NaAlO2和H2,Al是负极,Mg是正极;
II.根据反应方程式可知,Cu是负极,C棒是正极;
【详解】(1)甲中正极是Al,H+得到电子生成H2,电极反应式为2H++2e-=H2↑;
(2)由以上分析可知,乙中负极为Al;总反应的离子方程式为2Al+2OH-+2H2O=2AlO +3H2↑;
(3)A.与电解质溶液可以自发反应的是负极,故利用原电池反应判断金属活动性顺序时应注意选择合适的介质,A正确;
B.镁的金属性一定比铝的金属性强,B错误;
C.金属活动性顺序表一直是准确的,C错误;
D.与电解质溶液可以自发反应的是负极,具体情况具体分析,D正确;
故选AD;
(4)C棒是正极,Fe3+得到电子变成Fe2+,电极反应式为2Fe 3++2e- = 2Fe 2+;Cu是负极,Cu失电子变成Cu2+,电极反应式为Cu-2e- =Cu2+;
(5)盐桥是为了减小液接电位,转移离子而在两种溶液之间连接的高浓度电解质溶液,由装置图可知,X溶液是FeCl3,Y溶液是CuCl2。
高中化学苏教版 (2019)选择性必修1第二单元 化学能与电能的转化课堂检测: 这是一份高中化学苏教版 (2019)选择性必修1第二单元 化学能与电能的转化课堂检测,共4页。试卷主要包含了单选题,填空题,实验探究题等内容,欢迎下载使用。
化学选择性必修1第二单元 化学能与电能的转化一课一练: 这是一份化学选择性必修1第二单元 化学能与电能的转化一课一练,共23页。试卷主要包含了单选题,填空题,实验题等内容,欢迎下载使用。
化学苏教版 (2019)第二单元 化学能与电能的转化课后练习题: 这是一份化学苏教版 (2019)第二单元 化学能与电能的转化课后练习题,共15页。试卷主要包含了单选题,填空题,实验题等内容,欢迎下载使用。













