

江苏省淮安市2024届高三年级第一次调研测试化学试题(含答案)
展开2023—2024学年度高三年级第一次调研测试
化学试题 2023.09
可能用到的相对原子质量:H-1 C-12 N-14 O-16 Na-23 S-32 Co-59
一、单项选择题:共13题,每题3分,共39分。每题只有一个选项最符合题意。
1.中华文明源远流长,在世界文明中独树一帜,汉字居功至伟。随着时代发展,汉字被不断赋予新的文化内涵,其载体也发生相应变化。下列汉字载体主要由合金材料制成的是
汉字载体 | ||||
选项 | A.兽骨 | B.青铜器 | C.纸张 | D.液晶显示屏 |
2.CsCl是一种分析试剂,制备方法Cs2CO3+2HCl=2CsCl+H2O+CO2↑。下列说法正确的是
A.CsCl的电子式: B.基态O的核外电子排布式:1s22s22p6
C.CO的空间构型:三角锥形 D.中子数为18的Cl原子:
3.下列关于NO2的制取、净化、收集及尾气处理的装置和原理不能达到实验目的的是
A.制取NO2 B.净化NO2 C.收集NO2 D.尾气处理
4.元素H、Li、Na位于周期表中ⅠA族,下列说法正确的是
A.原子半径:r(H)>r(Li)>r(Na) B.第一电离能:I1(H)>I1(Li)>I1(Na)
C.H2、Li、NaH晶体类型相同 D.碱性:LiOH>NaOH
阅读下列资料,完成5~7题:从烟道气(含粉渣、CO2、SO2等)中分离回收硫的基本反应之一是SO2(g) + 2CO(g) 2CO2(g) + S(s) ΔH < 0。SO2在大气中能生成SO3、H2SO3、H2SO4。
5.下列说法正确的是
A.SO2与CO2分子是含有极性键的极性分子
B.SO2与CO2中键角都为180º
C.1mol(SO3)3分子中含有12molσ键(结构如右图)
D.H2SO3酸性比H2SO4的酸性强
6.下列关于硫的化合物的实验,能正确描述其反应的离子方程式的是
A.向BaCl2溶液中通入SO2:Ba2+ + H2O + SO2 = BaSO3↓+ 2H+
B.硫化亚铁溶于稀硝酸中:FeS + 2H+ = Fe2+ + H2S↑
C.等物质的量浓度等体积NH4HSO4溶液与NaOH溶液混合:NH+ 4 + OH- = NH3•H2O
D.用Na2SO3溶液吸收少量Cl2:3SO2- 3+ Cl2 + H2O = 2HSO- 3 + 2Cl- + SO2- 4
7.下列有关反应SO2(g) + 2CO(g) 2CO2(g) + S(s) ΔH < 0的说法正确的是
A.ΔS > 0
B.其他条件不变,升高温度,正反应速率减小
C.该反应的平衡常数可表示为K=
D.反应中每消耗1 mol CO转移的电子数目约为2×6.02×1023
8. 氯及其化合物的转化具有重要应用。下列说法不正确的是
A.家用消毒剂生产:HClOCl2NaClO(aq)
B.制备碳酸钠过程中的物质转化:
C.制备漂白粉发生的反应:2Cl2+2Ca(OH)2===CaCl2+Ca(ClO)2+2H2O
D.实验室制备少量氯气的原理: MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O
9.化合物Z具有广谱抗菌活性,可利用X和Y反应获得。下列有关说法不正确的是
A.有机物X能与甲醛发生缩聚反应 B.有机物Y存在顺反异构体
C.Z分子中所有原子一定不在同一平面上 D.Y、Z可用FeCl3溶液进行鉴别
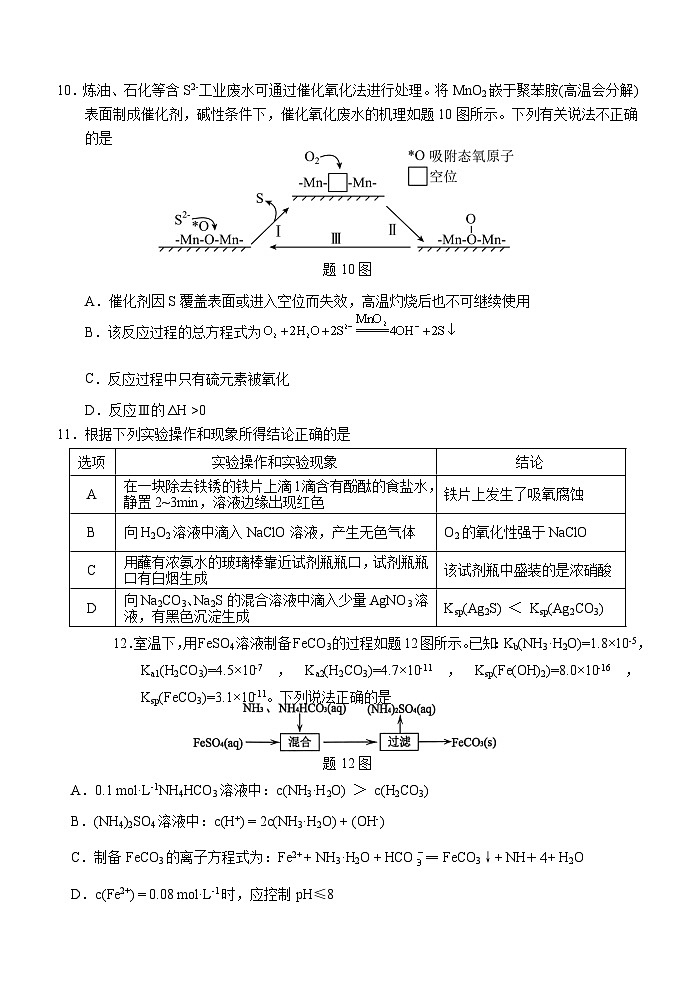
10.炼油、石化等含S2-工业废水可通过催化氧化法进行处理。将MnO2嵌于聚苯胺(高温会分解)表面制成催化剂,碱性条件下,催化氧化废水的机理如题10图所示。下列有关说法不正确的是
题10图
A.催化剂因S覆盖表面或进入空位而失效,高温灼烧后也不可继续使用
B.该反应过程的总方程式为
C.反应过程中只有硫元素被氧化
D.反应Ⅲ的ΔH >0
11.根据下列实验操作和现象所得结论正确的是
选项 | 实验操作和实验现象 | 结论 |
A | 在一块除去铁锈的铁片上滴1滴含有酚酞的食盐水,静置2~3min,溶液边缘出现红色 | 铁片上发生了吸氧腐蚀 |
B | 向H2O2溶液中滴入NaClO溶液,产生无色气体 | O2的氧化性强于NaClO |
C | 用蘸有浓氨水的玻璃棒靠近试剂瓶瓶口,试剂瓶瓶口有白烟生成 | 该试剂瓶中盛装的是浓硝酸 |
D | 向Na2CO3、Na2S的混合溶液中滴入少量AgNO3溶液,有黑色沉淀生成 | Ksp(Ag2S) < Ksp(Ag2CO3) |
12.室温下,用FeSO4溶液制备FeCO3的过程如题12图所示。已知:Kb(NH3·H2O)=1.8×10-5,Ka1(H2CO3)=4.5×10-7,Ka2(H2CO3)=4.7×10-11,Ksp(Fe(OH)2)=8.0×10-16,Ksp(FeCO3)=3.1×10-11。下列说法正确的是
题12图
A.0.1 mol·L-1NH4HCO3溶液中:c(NH3·H2O) > c(H2CO3)
B.(NH4)2SO4溶液中:c(H+) = 2c(NH3·H2O) + (OH-)
C.制备FeCO3的离子方程式为:Fe2+ + NH3·H2O + HCO= FeCO3↓+ NH+ 4+ H2O
D.c(Fe2+) = 0.08 mol·L-1时,应控制pH≤8
13.利用H2和CO反应生成CH4的过程中主要涉及的反应如下:
反应Ⅰ CO(g)+3H2(g)=CH4(g)+H2O(g) ΔH1=-206.2 kJ·mol-1
反应Ⅱ CO(g)+H2O(g)=CO2(g)+H2(g) ΔH2=-41.2 kJ ·mol-1
[CH4的产率=×100%,CH4的选择性=×100%]。
保持温度一定,在固定容积的密闭容器中进行上述反应,平衡时CH4和CO2的产率及CO和H2的转化率随的变化情况如题13图所示。下列说法不正确的是
A.当容器内气体总压不变时,反应Ⅱ达到平衡状态
B.曲线c表示平衡时CH4的产率随的变化
C.=0.5,反应达平衡时,CH4的选择性为50%
D.随着增大,CO2的选择性先增大后减小
二、非选择题:共4题,共61分。
14.(15分)某学者分别使用Fe2O3和Fe3O4作催化剂对燃煤烟气脱硝脱硫进行了研究。
(1)催化剂制备。在60〜100℃条件下,向足量NaOH溶液中通入N2一段时间,再加入适量新制FeSO4溶液,充分反应后得到混合物X;向混合物X中加入NaNO3溶液,充分反应后经磁铁吸附、洗涤、真空干燥,制得Fe3O4催化剂。
①通入N2的目的是 ▲ 。
②混合物X与NaNO3反应生成Fe3O4和NH3,该反应的化学方程式为 ▲ 。
(2)催化剂研究。如题14图-1所示,当其他条件一定时,分别在无催化剂、Fe2O3作催化剂、Fe3O4作催化剂的条件下,测定H2O2浓度对模拟烟气(含一定比例的NO、SO2、O2、N2)中NO和SO2脱除率的影响,NO脱除率与H2O2浓度的关系如题14图-2所示。
题14图-1 题14图-2
已知:•OH能将NO、SO2氧化。•OH产生机理如下。
反应I:Fe3+ + H2O2 = Fe2+ + •OOH + H+(慢反应)
反应II:Fe2+ + H2O2 = Fe3+ + •OH + OH—-(快反应)
①与Fe2O3作催化剂相比,相同条件下Fe3O4作催化剂时NO脱除率更高,其原因是
▲ 。
②NO部分被氧化成NO2。NO2被NaOH溶液吸收生成两种含氧酸钠盐,该反应的离子方程式为 ▲ 。
③实验表明•OH氧化SO2的速率比氧化NO速率慢。但在无催化剂、Fe2O3作催化剂、Fe3O4作催化剂的条件下,测得SO2脱除率几乎均为100%的原因是 ▲ 。
(3)催化剂的回收。将回收的废催化剂进行处理,制成的改性Fe3O4是一种优良的磁性材料,该Fe3O4晶胞的 的结构如题14图-3所示,研究发现结构中的Fe2+只可能出现在图中某一“▲”所示位置上,请确定Fe2+所在晶胞的位置 ▲ ,请说明确定理由: ▲ 。
题14图-3
15.(15分)化合物H是治疗肠炎痢疾的常用喹诺酮类抗菌药。其中一种合成路线如下:
已知:① ②
(1)化合物B在水中溶解性比化合物D的 ▲ (选填“大”、“小”、“无差别”)
(2)已知EMME的结构为,D与EMME发生取代反应生成E和小分子X,X的结构简式为 ▲ 。
(3)H的分子式为C4H10N2,G→I的反应类型为 ▲ 。
(4)E的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式 ▲ 。
①分子中有一个苯环和一个手性碳原子
②能发生银镜反应
③分子中有5种不同化学环境的氢原子
④碱性条件下水解,适当酸化后得到两种产物a、b,其中a遇FeCl3溶液显紫色,b为氨基酸,a中杂化轨道类型为sp3的碳原子数与b中相同。
(5)设计以和CH3CH2CH2OH为原料,制备的合成路线 ▲ (无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。
16.(15分)以废旧锂离子电池的正极材料[活性物质为LixCoO2(x≤1)、附着物为炭黑、聚乙烯醇粘合剂、淀粉等]为原料,制备纳米钴粉和Co3O4。
(1)浸出:将煅烧后的粉末(含LixCoO2和少量难溶杂质)与H2SO4溶液、H2O2溶液中的一种配成悬浊液,加入题16图-1所示的烧瓶中。75℃下通过滴液漏斗缓慢滴加另一种溶液;充分反应后,滤去少量固体残渣。得到Li2SO4、CoSO4和硫酸的混合溶液。
①滴液漏斗中的溶液是 ▲ 。
②为了提高浸出过程中钴的浸出率,实验中可采取的措施有 ▲ 。(填字母)
A.增加预处理后材料投入量 B.将预处理后材料粉碎并适当加快搅拌
C.缩短浸出时间 D.适当提高浸出温度
题16图-1 题16图-2 题16图-3
(2)制钴粉:向浸出后的溶液中加入NaOH调节pH,接着加入N2H4·H2O可以制取单质钴粉,同时有N2生成。已知不同pH时Co(II)的物种分布图如题16图-2所示。Co2+可以和柠檬酸根离子(C6H5O73-)生成络合离子[Co(C6H5O7)]-。
① 写出pH=9时制钴粉的离子方程式: ▲ 。
② pH>10后所制钴粉中由于含有Co(OH)2而导致纯度降低。若向pH>10的溶液中加入柠檬酸钠[Na3(C6H5O7)],可以提高钴粉的纯度,原因是 ▲ 。
③ 已知:Ksp[Co(OH)3]=a,Kb(NH3·H2O)=b, Co3++4OH- [Co(OH)4]- K=c。为了探究氨水能否溶解Co(OH)3,反应Co(OH)3+NH3·H2O [Co(OH)4]-+NH4+的平衡常数为 ▲ 。
(3)请补充完整由浸取后滤液先制备CoC2O4·2H2O,并进一步制取Co3O4的实验方案:取浸取后滤液, ▲ ,得到Co3O4。[已知:Li2C2O4易溶于水,CoC2O4难溶于水,CoC2O4·2H2O在空气中加热时的固体残留率(×100%)与随温度的变化如题16图-3所示。必须使用的试剂有:2.000mol·L-1(NH4)2C2O4溶液、蒸馏水、0.1000mol·L-1BaCl2溶液]
17.(16分)臭氧氧化法是处理水体中有机污染物的常用方法。
(1)研究臭氧发生的原理
一种臭氧发生装置原理如题17图-1所示。阳极(惰性电极)的电极反应式为 ▲ 。
(2)研究温度对相同时间内O3降解有机物的影响
通常降解时采用一次性投加O3的方式,温度升高,相同时间内有机物降解率降低。提出猜想:溶液中溶解的O3减少。作出猜想的依据: ▲ ;设计一个实验验证猜想
▲ 。
(3)研究O3降解有机物的路径
资料:臭氧除直接降解有机物外,O3在溶液中能产生羟基自由基(•OH),•OH也能降解水中有机物。
①写出产生羟基自由基(•OH)的化学方程式: ▲ 。
实验:取三份废水,保持其它条件相同。第一份直接通入1.25 mg /L O3;第二份在加入一定量MnO2的同时通入1.25 mg /L O3;第三份在加入一定量MnO2与叔丁醇的同时通入1.25 mg /L O3(叔丁醇能迅速结合•OH而将其除去),分别测量三份废水中有机物的残留率随时间的变化,结果如题17图-2所示。
②根据题17图-2中曲线可以得出的结论为 ▲ 。
题17图-1 题17图-2 题17图-3
(4)研究O3降解有机物的机理
MnO2催化O3反应的一种机理如题17图-3所示,“Vo”表示MnO2表面氧空位。根据此机理,实际具有催化活性的催化剂为 ▲ 。(以含字母x的化学式表示其组成)。研究表明:利用蜂窝陶瓷所含的氧化物作为载体负载MnO2对臭氧降解有机物能力有较好的促进作用,而温度过高则臭氧降解有机物能力显著降低,分析其发生变化的原因 ▲ 。
江苏省南通市2024届高三第一次调研测试化学试题: 这是一份江苏省南通市2024届高三第一次调研测试化学试题,共8页。试卷主要包含了单项选择题,非选择题等内容,欢迎下载使用。
江苏省淮安市2023—2024学年度高三年级第一次调研测试化学试题(PDF版含答案答案): 这是一份江苏省淮安市2023—2024学年度高三年级第一次调研测试化学试题(PDF版含答案答案),共11页。
2022年江苏省淮安市高三5月模拟测试化学试题含答案: 这是一份2022年江苏省淮安市高三5月模拟测试化学试题含答案,共8页。












