






- 第63讲 烃+化石燃料-2024高考化学一轮复习高频考点精讲(新教材新高考)课件PPT 其他 0 次下载
- 第64讲 卤代烃+醇+酚-2024高考化学一轮复习高频考点精讲(新教材新高考)课件PPT 其他 0 次下载
- 第65讲 醛、酮、羧酸、酯、酰胺-2024高考化学一轮复习高频考点精讲(新教材新高考)课件PPT 其他 0 次下载
- 第66讲 油脂+生物大分子-2024高考化学一轮复习高频考点精讲(新教材新高考)课件PPT 其他 0 次下载
- 第67讲 合成高分子+有机合成路线设计-2024高考化学一轮复习高频考点精讲(新教材新高考)课件PPT 其他 0 次下载
- 第68讲 有机合成与推断综合题突破-2024高考化学一轮复习高频考点精讲(新教材新高考)课件PPT 试卷 0 次下载
第6讲 物质的量 气体摩尔体积-2024年高考化学一轮复习高频考点精讲(新教材新高考)课件PPT
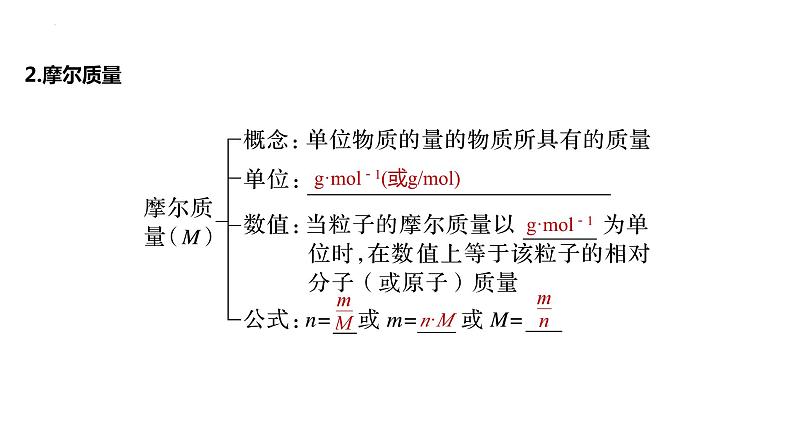
展开1.物质的量(1)概念:表示含有一定数目 的集合体。(2)符号为n,单位是 (ml)。(3)使用范围:适用于微观粒子或微观粒子的特定组合。(4)阿伏加德罗常数:指1 ml任何粒子的粒子数,符号为NA,NA≈ 。(5)公式:n= 或N= 或NA= 。
6.02×1023 ml-1
g·ml-1(或g/ml)
1.物质的量是表示微粒数目多少的物理量( )2.2 ml H2O的摩尔质量是1 ml H2O的摩尔质量的2倍( )3.1 ml O2的质量与它的相对分子质量相等( )4.12 g 12C中所含碳原子的数目约为6.02×1023( )5.1 ml OH-的质量为17 g·ml-1( )
(1)物质的量只用来描述粒子集合体的多少,不能表示宏观物质的集合体。(3)
(2)阿伏加德罗常数的数值约为6.02×1023,单位是ml-1。
质量、物质的量与微粒数目之间的换算1.“可燃冰”是由水和甲烷在一定条件下形成的类冰结晶化合物。1.6 g“可燃冰”(CH4·xH2O)的物质的量与6.02×1021个水分子的物质的量相等,则该“可燃冰”的摩尔质量为____________,x的值为____。2.最近材料科学家研究发现了首例带结晶水的晶体在5 K下呈现超导性。据报道,该晶体的化学式为Na0.35CO2·1.3H2O。若用NA表示阿伏加德罗常数的值,试计算12.2 g该晶体中含氧原子数约为________,氢原子的物质的量约为______ml。
计算判断物质中所含指定微粒数目的技巧
弄清楚微粒与所给物质的关系:原子(电子)的物质的量=分子(或特定组合)的物质的量×1个分子(或特定组合)中所含这种原子(电子)的个数。如:第2题中,Na0.35CO2·1.3H2O是一个整体,计算对象氧原子、氢原子为部分,它们的关系为Na0.35CO2·1.3H2O~3.3O~2.6H。
气体摩尔体积 阿伏加德罗定律
L·ml-1(或 L/ml)
22.4 L·ml-1
2.阿伏加德罗定律(1)同温、同压下,同体积的任何气体具有相同的 或 。(2)阿伏加德罗定律的推论
1.22 g CO2气体的体积为11.2 L( )2.标准状况下,11.2 L SO3中含有的原子数为2NA( )3.同温、同体积的条件下,等质量的SO2和O2的压强之比为2∶1( )4.标准状况下,11.2 L O2和H2的混合气体所含分子数约为3.01×1023( )5.相同体积的CO和N2,二者含有的原子数相同( )
(1)相同温度和压强下,任何气体粒子之间的距离是相等的。任何气体都是由分子构成的。
(2)标准状况下的任何气体的摩尔体积均约为 22.4 L·ml-1,但是气体的摩尔体积约为 22.4 L·ml-1,对应的条件不一定是标准状况。
(3)常温(25 ℃)和 101 kPa 的条件下,气体的摩尔体积约为24.5 L·ml-1
(4)气体的摩尔体积与气体的种类和多少无关,只与温度和压强有关.
1.有以下四种物质:①标准状况下,11.2 L二氧化碳 ②8 g氢气 ③1.204×1024个氮气分子 ④4 ℃时18 mL水(ρ=1 g·cm-3)。完成下列填空:它们所含分子数最多的是_____(填序号,下同),所含原子数最多的是_____,质量最大的是_____,所含电子数最多的是_____。
以物质的量为中心计算的思维流程
二、相对分子质量的计算2.按要求解答下列问题。(1)已知标准状况下,气体A的密度为2.857 g·L-1,则气体A的相对分子质量为_____,可能是______气体。
M=ρ×22.4 L·ml-1≈64 g·ml-1。
(2)CO和CO2的混合气体18 g,完全燃烧后测得CO2的体积为11.2 L(标准状况),则①混合气体在标准状况下的密度是______g·L-1。
2CO+O2 2CO2,CO的体积与生成CO2的体积相等,故18 g CO和CO2的混合气体的总体积为11.2 L,在标准状况下,该混合气体的物质的量为0.5 ml,设CO的物质的量为x ml,CO2的物质的量为y ml,
②混合气体的平均摩尔质量是_____g·ml-1。
(3)在一定条件下,m g NH4HCO3完全分解生成NH3、CO2、H2O(g),若所得气体对H2的相对密度为d,则该混合气体的平均相对分子质量为______,混合气体的物质的量为_________,NH4HCO3的摩尔质量为____________(用含m、d的代数式表示)。
求气体摩尔质量(M)的常用方法
(3)根据标准状况下气体的密度ρ:M=ρ×22.4 L·ml-1。
(5)对于混合气体,求其平均摩尔质量,上述计算式仍然成立;还可以用下式计算:M=M1×a%+M2×b%+M3×c%……,a%、b%、c%……指混合气体中各成分的物质的量分数(或体积分数)。
三、阿伏加德罗定律的应用3.一个密闭容器,中间有一可自由滑动的隔板(厚度不计),将容器分成两部分,当左侧充入1 ml N2,右侧充入一定量的CO时,隔板处于如图位置(保持温度不变)。
按要求回答问题。(1)N2与CO的分子数之比为________。(2)右侧通入的CO的物质的量为__________。
(3)若改变右侧CO的充入量而使隔板处于容器正中间,保持温度不变,应再充入CO的物质的量为__________。
隔板处于正中间位置,此时n(CO)=n(N2),所以再充入CO的物质的量为1 ml-0.25 ml=0.75 ml。
4.三种气体X、Y、Z的相对分子质量关系为M(X)
(2)同温同压下,同质量的三种气体,气体密度最小的是_____。
相对分子质量越小,密度越小。
(3)同温下,体积相同的两容器分别充入2 g Y气体和1 g Z气体,则压强p(Y)∶p(Z)=________。
应用阿伏加德罗定律解题的一般思路
第一步,分析“条件”:分析题干中的条件,找出相同与不同。第二步,明确“要求”:分析题目要求,明确所要求的比例关系。第三步,利用“规律”:利用阿伏加德罗定律及其推论,根据条件和要求进行判断。
包罗万象的阿伏加德罗常数(NA)
一、识破阿伏加德罗常数判断的陷阱1.NA为阿伏加德罗常数的值。请判断下列说法的正误(正确的打“√”,错误的打“×”)。(1)2.24 L CO2中含有的原子数为0.3NA( )(2)常温下,11.2 L甲烷气体含有的甲烷分子数为0.5NA( )(3)常温常压下,1.4 g乙烯与丙烯混合气体含有的原子数为0.3NA( )(4)标准状况下,22.4 L SO3中含有SO3的分子数为NA( )(5)标准状况下,22.4 L氧气、氮气和CO的混合气体中含有2NA个原子( )(6)用惰性电极电解饱和食盐水,若阴极产生11.2 L气体,则线路中通过NA个电子( )(7)常温常压下,1 ml CO2与SO2的混合气体中含氧原子数为2NA( )
2.NA为阿伏加德罗常数的值。请判断下列说法的正误(正确的打“√”,错误的打“×”)。(1)0.1 L 3.0 ml·L-1的NH4NO3溶液中含有的 的数目为0.3NA( )(2)在高温、高压和催化剂条件下,密闭容器中2 g H2与足量N2反应,转移电子数为2NA( )(3)等体积、等物质的量浓度的NaCl和KCl溶液中,阴、阳离子数目之和均为2NA( )(4)1 ml Al3+完全水解生成氢氧化铝胶体粒子的数目为NA( )(5)含2 ml H2SO4的浓硫酸与足量铜共热,转移的电子数为2NA( )(6) 0.1 ml·L-1的NaHSO4溶液中,Na+数目为0.1NA( )(7)密闭容器中,2 ml NO与1 ml O2充分反应后,混合气体中氧原子数为4NA( )(8)100 g 46%的乙醇溶液中含有氧原子数为NA( )
二、关注特殊物质的“组成”和结构特点3.NA为阿伏加德罗常数的值。请判断下列说法的正误(正确的打“√”,错误的打“×”)。(1)36 g 18O2中含有10NA个中子( )(2)17 g —OH与17 g OH-所含电子数均为10NA( )(3)92 g NO2与N2O4的混合气体中含有的原子总数为6NA( )(4)乙烯和环丙烷(C3H6)组成的28 g混合气体中含有3NA个氢原子( )(5)CH4与P4的分子结构均为正四面体形,在1 ml CH4分子或P4分子中含有的共价键数均为4NA( )(6)4.5 g SiO2晶体中含有的硅氧键的数目为0.3NA( )(7)34 g过氧化氢存在的极性键总数为3NA( )(8)46 g乙醇中存在的共价键总数为8NA( )(9)26 g乙炔中含有π键的个数为2NA( )
(1)理清整体与部分的数量关系确定粒子个数:弄清楚微粒中相关粒子(质子、中子、电子、离子)、化学键之间的数量关系。如单原子分子:稀有气体He、Ne等;双原子分子:Cl2、N2、O2、H2等。有特殊结构的物质的量计算:如1 ml Si中含Si—Si的数目为2NA、1 ml SiO2中含Si—O的数目为4NA、1 ml石墨烯(单层石墨)中含有六元环的个数为0.5NA。(2)最简式相同的混合物计算技巧——求同存异,如第3题(3)将混合物看作“NO2”,(4)将混合物看作“CH2”。(3)最简式相同的混合物计算技巧——极端假设法,如第3题(3)可先假设都是NO2计算,再假设都是N2O4,结果相同;同样的方法解答第3题(4)。
三、关注特殊物质氧化还原反应中电子转移数目4.NA为阿伏加德罗常数的值。请判断下列说法的正误(正确的打“√”,错误的打“×”),简述判断依据。(1)标准状况下,2.24 L CO2与足量的Na2O2充分反应,转移的电子总数为0.2NA( )判断依据:___________________________________________________________________________________________。(2)5.6 g Fe和6.4 g Cu分别与0.1 ml Cl2充分反应,转移的电子数均为0.2NA( )判断依据:_________________________________________________________________________。(3)5.6 g铁粉与硝酸反应失去的电子数一定为0.3NA( )判断依据:_____________________________________________________________________________。
该反应为Na2O2中-1价氧元素的歧化反应,0.1 ml CO2反应消耗0.1 ml Na2O2,转移0.1 ml电子
0.1 ml Fe和0.1 ml Cu均能完全使0.1 ml Cl2转化为0.2 ml Cl-,转移0.2 ml电子
没有给出硝酸的量,不能判断最终产物中铁元素的价态,故不能判断转移电子的数目
(4)6.4 g Cu与S完全反应,转移的电子数为0.2NA( )判断依据:_________________________________________________。(5)向FeBr2溶液中通入适量Cl2,当有1 ml Fe2+被氧化时,转移的电子总数一定等于3NA( )判断依据:_____________________________________________________________________________________________________。
该反应的产物为Cu2S,0.1 ml Cu只能失去0.1 ml电子
还原性:Fe2+>Br-,Cl2首先氧化Fe2+,Cl2的量不确定,无法确定Br-被氧化的量,转移的电子数在NA~3NA之间
(1)围绕“气体摩尔体积的作用条件”进行判断
阿伏加德罗常数判断题中的常见陷阱
(2)围绕“物质的组成与微观结构”进行判断
①等质量的最简式相同的物质含有的原子数相同,如NO2
与N2O4,C2H4 与C3H6,O2 与O3。
②等质量的摩尔质量相同的物质含有的分子数相同,如N2
与CO,CO2 与 N2O,H2SO4 与H3PO4。
③物质的量相同的分子含有的分子数相同,原子数不一定
相同。如CO2 与CO 的混合气体若为1 ml,则含分子数为NA,原子数介于2NA 和3NA 之间。
⑥在分析理解的基础上记准常考物质所含化学键的数目,
(3)围绕“电解质溶液中微粒数目”进行判断
(4)围绕“氧化还原反应中转移电子数”进行判断
第7讲 物质的量浓度-2024年高考化学一轮复习高频考点精讲(新教材新高考)课件PPT: 这是一份第7讲 物质的量浓度-2024年高考化学一轮复习高频考点精讲(新教材新高考)课件PPT,共39页。PPT课件主要包含了复习目标,物质的量浓度,考点一,必备知识,易错辨析,专项突破,归纳总结,考点二,使用容量瓶的“五不”,真题演练等内容,欢迎下载使用。
第01讲 物质的量 气体摩尔体积(课件)-2024年高考化学一轮复习讲练测(新教材新高考): 这是一份第01讲 物质的量 气体摩尔体积(课件)-2024年高考化学一轮复习讲练测(新教材新高考),共38页。PPT课件主要包含了复习目标,网络构建,知识梳理题型归纳,真题感悟,内容索引,考情分析,PARTONE等内容,欢迎下载使用。
2024年高考化学一轮复习(新高考版) 第2章 第6讲 物质的量 气体摩尔体积: 这是一份2024年高考化学一轮复习(新高考版) 第2章 第6讲 物质的量 气体摩尔体积,文件包含2024年高考化学一轮复习新高考版第2章第6讲物质的量气体摩尔体积pptx、2024年高考化学一轮复习新高考版第2章第6讲物质的量气体摩尔体积docx、第2章第6讲物质的量气体摩尔体积docx、第2章第6练物质的量气体摩尔体积docx等4份课件配套教学资源,其中PPT共55页, 欢迎下载使用。












