

专题7.3 热重曲线的相关问题-备战2023年高考化学新编大一轮复习讲义(原卷版)
展开专题7.2 热重曲线的相关问题
【考情分析】
近年来“热重曲线”类试题均以试样热重实验曲线为依据编制。试题以试样质量(剩余固体质量占原试样质量的百分比)随温度变化的曲线为载体,以图像和文字组合的形式呈现,考查内容以书写方程式、判断某温度时物质组成为重点,考查方式以填空、计算等形式较为常见,综合考查学生获取信息的能力、处理据的能力和元素守恒的化学思想等,促使学生对中学化学知识内涵的再次理解和体会,题型旨在考查学生“接受、吸收、整合化学信息的能力”从而培养学生分析、变形、转换的能力。
【核心知识梳理】
1.测定固体物质组成的热重法
只要物质受热时发生质量变化,都可以用热重法来研究物质的组成。热重法是在控制温度的条件下测量物质的质量与温度关系的方法。通过分析热重曲线,我们可以知道样品及其可能产生的中间产物的组成、热稳定性、热分解情况及生成产物等与质量相联系的信息。
2.热重曲线模型
由热重分析记录的质量变化对温度的关系曲线称热重曲线,曲线的横轴为温度,纵轴为质量。如固体物质A热分解反应:A(固体)B(固体)+C(气体)的典型热重曲线如图所示。图中T1为固体A开始分解的温度,T2为质量变化达到最大值时的终止温度。若试样初始质量为W0,失重后试样质量为W1,则失重百分数为。
3.热重曲线的分析法的思考路径
坐标曲线体解题时可以拆分为识图、析图、用图三个步骤。其中识图是基础,析图是关键,用图是目的。
(1)识图
识图的关键是三看:一看轴即横、纵坐标所表示的化学含义(自变量X轴和函数Y轴表示的意义),寻找X、Y轴之间的关系,因为这是理解题意和进行正确思维的前提;二看点即曲线中的特殊点(顶点、始点、终点、拐点、交叉点);三看线即曲线的走势(变化趋势是上升、下降、波动、正态、偏态等变化)。
(2)析图
分析图中为什么会出现这些特殊点,曲线为什么有这样的变化趋势和走向,分析曲线变化的因果关系;通过联想,把课本内的有关化学概念、原理、规律等与图像曲线中的图形与相关点建立联系。
(3)用图
将相关的化学知识与图像曲线紧密结合,在头脑中构建新的曲线——知识体系,然后运用新的曲线——知识体系揭示问题的实质,解决实际问题。
4.热重分析的一般方法和规律
(1)设晶体为1 mol。
(2)失重一般是先失水,再失非金属氧化物。
(3)计算每步的剩余固体质量,×100%=固体残留率。
(4)晶体中金属质量不减少,仍在m(剩余)中。
(5)失重最后一般为金属氧化物,由质量守恒得m(O),由n(金属)∶n(O)即可求出失重后物质的化学式。
5.热重分析试题类型
类型1 热重分析及计算
【例1】(2019·全国卷Ⅰ,27(5))硫酸铁铵[NH4Fe(SO4)2·xH2O]是一种重要铁盐。采用热重分析法测定硫酸铁铵晶体样品所含结晶水数,将样品加热到150 ℃时失掉1.5个结晶水,失重5.6%。硫酸铁铵晶体的化 学式为 。
【解题突破】
第一步 | 根据题给信息,确定硫酸铁铵发生的变化:NH4Fe(SO4)2·xH2O→NH4Fe(SO4)2·(x-1.5)H2O |
第二步 | 理解样品失重5.6%的含义,列出含x的代数式,求出x的值,确定硫酸铁铵的化学式 |
解析 样品加热到150 ℃时失掉1.5个结晶水,发生变化:NH4Fe(SO4)2·xH2O→NH4Fe(SO4)2·(x-1.5)H2O+1.5H2O。固体失重5.6%,即失去水的质量占样品总质量的5.6%,列出关系式:×100%=5.6%,解得x=12,故硫酸铁铵晶体的化学式为NH4Fe(SO4)2·12H2O。
【方法指导】
“两步法”突破热重分析及计算题
| 突破技法 |
第一步 读题,找变化 | 阅读题给信息,找出物质之间发生的变化,一般结晶水合物先失结晶水,后发生分解,碳酸盐产生CO2,硫酸盐产生SO2或SO3,氢氧化物产生H2O |
第二步 列式,求未知 | 根据固体质量变化,列出定量关系式,求出未知数,确定剩余固体的化学式 |
类型2 热重曲线及计算
热重曲线是指在热分析过程中通过热天平而得到的试样在加热过程中质量随温度变化的曲线,一般与差热曲线结合使用,通过热重曲线的分析计算,可以了解样品在某一温度下的反应程度及相应的物质含量等信息。热重曲线分析要抓住“三点”——起点、拐点、终点,根据质量(或失重质量分数)等随温度的变化,确定定量关系,列式计算,确定剩余固体的成分。
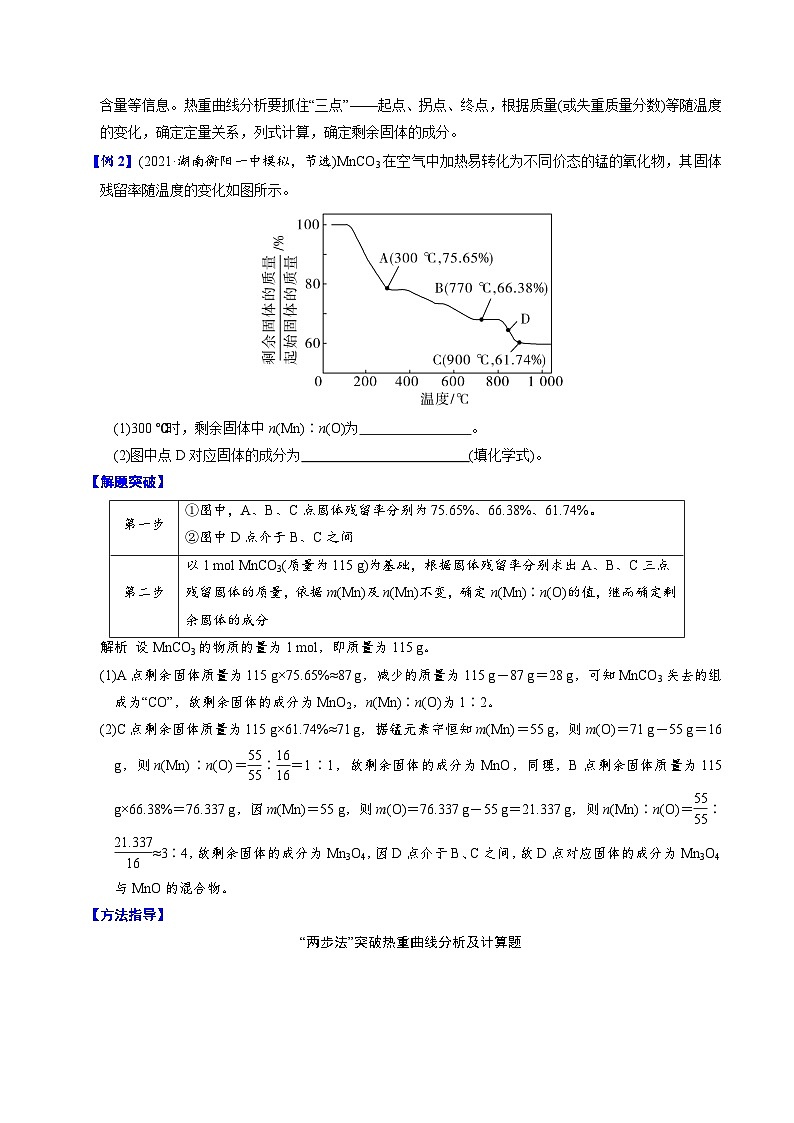
【例2】(2021·湖南衡阳一中模拟,节选)MnCO3在空气中加热易转化为不同价态的锰的氧化物,其固体残留率随温度的变化如图所示。
(1)300 ℃时,剩余固体中n(Mn)∶n(O)为 。
(2)图中点D对应固体的成分为 (填化学式)。
【解题突破】
第一步 | ①图中,A、B、C点固体残留率分别为75.65%、66.38%、61.74%。 ②图中D点介于B、C之间 |
第二步 | 以1 mol MnCO3(质量为115 g)为基础,根据固体残留率分别求出A、B、C三点残留固体的质量,依据m(Mn)及n(Mn)不变,确定n(Mn)∶n(O)的值,继而确定剩余固体的成分 |
解析 设MnCO3的物质的量为1 mol,即质量为115 g。
(1)A点剩余固体质量为115 g×75.65%≈87 g,减少的质量为115 g-87 g=28 g,可知MnCO3失去的组成为“CO”,故剩余固体的成分为MnO2,n(Mn)∶n(O)为1∶2。
(2)C点剩余固体质量为115 g×61.74%≈71 g,据锰元素守恒知m(Mn)=55 g,则m(O)=71 g-55 g=16 g,则n(Mn)∶n(O)=∶=1∶1,故剩余固体的成分为MnO,同理,B点剩余固体质量为115 g×66.38%=76.337 g,因m(Mn)=55 g,则m(O)=76.337 g-55 g=21.337 g,则n(Mn)∶n(O)=∶≈3∶4,故剩余固体的成分为Mn3O4,因D点介于B、C之间,故D点对应固体的成分为Mn3O4与MnO的混合物。
【方法指导】
“两步法”突破热重曲线分析及计算题
【精准训练1】
1.随着材料科学的发展,金属钒及其化合物得到了越来越广泛的应用,并被誉为“合金的维生素”。经过热重分析测得:NH4VO3在焙烧过程中,固体质量的减少值(纵坐标)随温度变化的曲线如图所示。则NH4VO3在分解过程中下列说法正确的是( )
A.先分解失去H2O,再分解失去NH3
B.先分解失去NH3,再分解失去H2O
C.同时分解失去H2O和NH3
D.同时分解失去H2、N2和H2O
2.在加热固体NH4Al(SO4)2·12H2O时,固体质量随温度的变化曲线如图所示:已知a点物质为NH4Al(SO4)2,b点物质为Al2(SO4)3,下列判断正确的是( )
A.0~T ℃的过程变化是物理变化
B.c点物质是工业上冶炼铝的原料
C.a→b反应中生成物只有Al2(SO4)3和NH3两种
D.Al2(SO4)3能够净水,可用离子方程式表示为Al3++3OH-===Al(OH)3
3.8.34 g FeSO4·7H2O(M=278 g·mol -1)样品受热脱水过程的热重曲线(样品质量随温度变化的曲线)如图所示,下列说法正确的是( )
A.温度为78 ℃时,固体物质M的化学式为FeSO4·5H2O
B.温度为159 ℃时固体N的化学式为FeSO4·2H2O
C.在隔绝空气条件下,由N得到P的化学方程式为FeSO4·H2OFeSO4+H2O
D.取适量380 ℃时所得的样品P,隔绝空气加热至650 ℃,得到一种固体物质Q,同时有两种无色气体生成,Q的化学式为Fe3O4
4.将草酸锌晶体(ZnC2O4·2H2O)加热分解可得到一种纳米材料。加热过程中固体残留率随温度的变化如图所示,300~460 ℃范围内,发生反应的化学方程式为_______________________________________。
5.在空气中加热10.98 g草酸钴晶体(CoC2O4·2H2O)样品,受热过程中不同温度范围内分别得到一种固体物质,其质量如表。
温度范围/℃ | 固体质量/g |
150~210 | 8.82 |
290~320 | 4.82 |
890~920 | 4.50 |
(1)加热到210 ℃时,固体物质的化学式为_______________________________________。
(2)经测定,加热到210~310 ℃过程中的生成物只有CO2和钴的氧化物,此过程发生反应的化学方程式为
________________________________________________________________________。
6.CoC2O4是制备钴的氧化物的重要原料。下图为二水合草酸钴(CoC2O4·2H2O)在空气中受热的质量变化曲线,曲线中300 ℃及以上所得固体均为钴氧化物。
通过计算确定C点剩余固体的化学成分为________(填化学式)。写出B点对应的物质与O2在225~300 ℃发生反应的化学方程式:___________________________________________________________。
【真题感悟】
1.【2014全国高考】PbO2在加热过程发生分解的失重曲线如图所示,已知失重曲线上的a点样品失重4.0%(即×100%)的残留固体。若a点固体组成表示为PbOx或mPbO2·nPbO,列式计算x值和m∶n值_________。
2.【2003江苏卷】碱式碳酸铝镁[MgaAlb(OH)c(CO3)d·xH2O]常用作塑料阻燃剂。为确定碱式碳酸铝镁的组成,进行如下实验:
①准确称取3.390 g样品与足量稀盐酸充分反应,生成0.560 L CO2(已换算成标准状况下)。
②另取一定量样品在空气中加热,样品的固体残留率随温度的变化如图所示(样品在270 ℃时已完全失去结晶水,600 ℃以上残留固体为金属氧化物的混合物)。
根据以上实验数据计算碱式碳酸铝镁样品中的n(OH-)∶n(CO)=________。
3.【2000 年广东卷】下图是100 mg CaC2O4·H2O受热分解时,所得固体产物的质量随温度变化的曲线。试利用图中信息结合所学的知识,回答下列各问题:
(1)温度分别为t1和t2时,固体产物的化学式A是_________________,B是:_________________。
(2)由CaC2O4·H2O得到A的化学方程式为_________________________。
(3)由A得到B的化学方程式为___________________________________。
(4)由图计算产物C的分子量,并推断C的合理的化学式。
2.【2011全国卷】0.80g CuSO4·5H2O样品受热脱水过程的热重曲线(样品质量随温度变化的曲线)如下图所示。
请回答下列问题:
(1)试确定200℃时固体物质的化学式______________(要求写出推断过程);
(2)取270℃所得样品,于570℃灼烧得到的主要产 。把该黑色粉末溶解于稀硫酸中,经浓缩、冷却,有晶体析出,该晶体的化学式为 ,其存在的最高温度是_____________;
(3)上述氧化性气体与水反应生成一种化合物,该化合物的浓溶液与Cu在加热时发生反应的化学方程式为 ;
(4)在0.10mol·L-1硫酸铜溶液中加入氢氧化钠稀溶液充分搅拌,有浅蓝色氢氧化铜沉淀生成,当溶液的pH=8时,c(Cu2+)=________________mol·L-1(Ksp[Cu(OH)2]=2.2×10-20)。若在0.1mol·L-1 硫酸铜溶液中通入过量 H2S气体,使Cu2+完全沉淀为CuS,此时溶液中的H+浓度是_______mol·L-1。
【课时达标训练】
1.草酸钴在氧气氛围中热重分析如表:(失重率=;W1、W2为起始点、终点的固体质量)
序号 | 温度范围/℃ | 热分解步骤 | 失重率% | |
实际 | 理论 | |||
1 | 150~210 | CoC2O4•2H2O=CoC2O4+2H2O | 19.10 | 19.67 |
2 | 290~320 | 46.34 | 45.35 | |
3 | 890~920 | 3.81 | 6.6 | |
加热到290~320℃和890~920℃时的化学方程式分别为:
____________________________________________________________________________________、
____________________________________________________________________________________。
2.在空气中加热一定质量的固体样品时,其固体失重率数据见下表,请补充完整表中问题。
已知:①在空气中加热至300℃及以上时,所得固体产物为钴氧化物,气体产物为。
②。
序号 | 温度范围/℃ | 发生反应的化学方程式 | 固体失重率 |
Ⅰ | 120~220 | 19.67% | |
Ⅱ | 300~350 | ___________________________________ | 56.12% |
3.取26.90g ZnSO4·6H2O加热,剩余固体的质量随温度的变化如图2所示。750℃时所得固体的化学式为( )
A.ZnO B.ZnSO4 C. Zn3O(SO4)2 D.ZnSO4·H2O
4.xNH4Cl·yScF3·zH2O是“沉钪”过程中ScF3与氯化物形成的复盐沉淀,“脱水除铵”过程中固体质量与温度的关系如下图所示,其中在380-400℃过程中会有白烟冒出,保温至无烟气产生,即得到 ScF3,由图3中数据可得x:z=___________。
5.称取3.60 g草酸亚铁晶体(FeC2O4·2H2O,相对分子质量是180)用热重法对其进行热分解,得到剩余固体的质量随温度变化的曲线如图所示,请分析图并回答下列问题:
(1)过程Ⅰ发生反应的化学方程式为_________________________________________________________。
(2)300 ℃时剩余固体只有一种且是铁的氧化物,试通过计算确定该氧化物的化学式________________。
6.胆矾(CuSO4·5H2O)是铜的重要化合物,在工业生产中应用广泛。若改变反应条件可获得化学式为Cux(OH)y(SO4)z·nH2O的晶体,用热重分析仪对Cux(OH)y(SO4)z·nH2O晶体进行分析并推断该晶体的化学式。取3.30 g晶体样品进行热重分析,所得固体质量的变化曲线如图所示。已知:体系温度在650 ℃及以下时,放出的气体只有水蒸气;实验测得温度在650℃时,残留固体的组成可视为aCuO·bCuSO4;温度在1 000 ℃以上时,得到的固体为Cu2O。请回答下列问题:
(1)温度650~1 000 ℃产生的气体中,n(O)∶n(S)____(填“>”“<”或“=”)3。
(2)通过计算推断Cux(OH)y(SO4)z·nH2O晶体的化学式:__________。
7.热分解的质量变化过程如图所示,其中之前是隔绝空气加热,之后是在空气中加热,A、B、C三点时的产物均为纯净物。用化学方程式表示从A点到B点的物质转化:_________________,C点时产物的化学式是_________________。
8.采用热重分析法测定NiSO4·nH2O样品所含结晶水数。将样品在900℃下进行煅烧,失重率随时间变化如下图,A点时失掉2个结晶水,n的值为___________;C点产物的化学式为___________。
9.为确定NVCO{化学式可表示为:(NH4)a[(VO)b(CO3)c(OH)d]·10H2O}的组成,进行如下实验:
①称取2.130 g样品与足量NaOH充分反应,生成NH3 0.224 L(已换算成标准状况下)。
②另取一定量样品在氮气氛围中加热,样品的固体残留率(×100%)随温度的变化如图所示(分解过程中各元素的化合价不变)。
根据以上实验数据计算确定NVCO的化学式(写出计算过程)。
10.如图是1.00gMgC2O4•nH2O晶体放在坩埚里从25℃徐徐加热至700℃分解时,所得固体产物的质量(m)随温度(t)变化的关系曲线。(已知100℃以上才会逐渐失去结晶水,并约在230℃时完全失去结晶水)
试回答下列问题:
(1)MgC2O4•nH2O中n=__________________。
(2)通过计算确定C点固体物质的化学式________________________(要求写出推断过程);
(3)通过计算确定从E点到F点过程中的化学方程式_____________________(要求写出推断过程)。
专题7.1 物质的制备和分离-备战2023年高考化学新编大一轮复习讲义(原卷版): 这是一份专题7.1 物质的制备和分离-备战2023年高考化学新编大一轮复习讲义(原卷版),共27页。
专题7.2 工业生产中陌生方程式的书写-备战2023年高考化学新编大一轮复习讲义(原卷版): 这是一份专题7.2 工业生产中陌生方程式的书写-备战2023年高考化学新编大一轮复习讲义(原卷版),共20页。
专题7.3 热重曲线的相关问题-备战2023年高考化学新编大一轮复习讲义(解析版): 这是一份专题7.3 热重曲线的相关问题-备战2023年高考化学新编大一轮复习讲义(解析版),共20页。












