


【培优导学案】浙教版科学九年级全册:9、有机物 学案(含解析)
展开有机物
【回顾】
有机物
1.定义:一类含碳化合物[碳的氧化物(CO2、CO)、碳酸、碳酸盐等除外]。有机物大多含有碳、氢元素,还可能含有氧、氮、硫等元素。
2.性质:可燃性。如:
CH4+2O2CO2+2H2O
3.初中常见有机物的化学式
CH4(最简单的有机物、相对分子质量最小的有机物)、C2H6(乙烷)、C2H4(乙烯)、C2H2(乙炔)、C2H5OH(乙醇,俗名:酒精)、 CH3COOH(乙酸,俗名:醋酸)、C6H12O6(葡萄糖)、C12H22O11(蔗糖)、蛋白质、淀粉[(C6H10O5)n]等。
4.葡萄糖与新制的Cu(OH)2在碱性条件下发生反应:C6H12O6+2Cu(OH)2C6H12O7+2H2O+Cu2O。
现象:产生砖红色沉淀。
应用:可以检验尿液中是否含有葡萄糖。
5.AxBy物质中微粒个数比为N(x)∶N(y)=,即个数可以用公式:N=计算。
![]()
例 现有一种有机物4.6 g,在氧气中充分燃烧生成8.8 g CO2和5.4 g H2O。
(1)通过计算回答该物质的元素组成。
(2)求各元素的质量比。
(3)如果该物质的相对分子质量小于50,请判断该物质的化学式。
[答案] 解:(1)根据质量守恒定律可知,该有机物中一定含有C、H两种元素,
碳元素的质量为8.8 g×=2.4 g,
氢元素的质量为5.4 g×=0.6 g,
2.4 g+0.6 g=3 g<4.6 g
则该有机物中一定含有氧元素,且氧元素的质量为4.6 g-3 g=1.6 g。
(2)m(C)∶m(H)∶m(O)=2.4 g∶0.6 g∶1.6 g=12∶3∶8。
(3)该有机物中C、H、O三种原子个数比为=261,又因该有机物的相对分子质量小于50,故该有机物的化学式为C2H6O。
答:(1)该物质由C、H、O三种元素组成;(2)C、H、O三种元素的质量比为12∶3∶8;(3)该物质的化学式为C2H6O。
[方法点拨] 根据有机物燃烧产物判断有机物中是否含有氧元素,需要通过定量计算才能确定。
以有机物燃烧产物为二氧化碳、水为例:
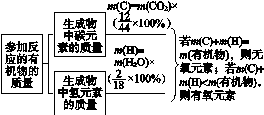
图9-1
![]()
1.下列叙述错误的是( )
A.三大合成材料是指塑料、合成纤维、合成橡胶
B.聚乙烯塑料袋可用加热法封口
C.燃烧法可辨别毛衣的成分是羊毛还是化纤
D.棉花和涤纶都是天然纤维
2.不粘锅内表面通常使用特氟龙涂层,原料为聚四氟乙烯,其结构简式为(CF2CF2)n。对聚四氟乙烯的推断,不合理的是( )
A.属于有机合成材料
B.有较好的耐高温性
C.可耐酸腐蚀
D.可溶于酒精、食用油等有机溶剂
3.淳安提前招生经测定,由甲酸(HCOOH)、乙醛(CH3CHO)和丙酮(CH3COCH3)组成的混合物中,氢元素的质量分数为x%,则该混合物中氧元素的质量分数为( )
A.6x% B.1-2x%
C.1-7x% D.2x%
4.(多选)下列各组有机物等分子数燃烧时所消耗氧气质量相等的是( )
A.C2H2,C6H6 B.C2H4,C2H5OH
C.C3H8,C3H6 D.CH3CHO,C2H2
5.在有机化合物中,有一大类物质的分子组成具有Cm(H2O)n的特征,我们把它们称为糖类。例如淀粉(C6H10O5)n是一种糖,可以把它写成C6(H2O)5的形式,下列物质属于糖类的是( )
①苯酚(C6H6O) ②蔗糖(C12H22O11)
③纤维素(C6H10O5)n ④葡萄糖(C6H12O6)
⑤氨基乙酸(C2H5O2N)
A.①② B.②③④ C.④⑤ D.③④
6.(多选)下列四组以任意比组成的气态混合物分别在氧气中充分燃烧时,都生成水和二氧化碳。其中生成的水分子数一定比二氧化碳分子数多的是( )
A.C3H4和C2H6 B.C2H2和C3H8
C.C2H6和C2H8 D.C2H4和C2H6
7.科学上常采用燃烧法测定有机物的组成,现取2.3 g某有机物在足量的氧气中充分燃烧,生成4.4 g二氧化碳和2.7 g水,则该有机物的化学式可能为( )
A.CH4O B.CH4 C.C2H6O D.C3H6
8.有机物分子式的确定常采用燃烧法,其操作如下:在电炉加热下用纯氧气氧化管内样品,根据产物的质量确定有机物的组成。如图9-2所示是用燃烧法测定有机物分子式常用的装置,其中A管装碱石灰,B管装无水CaCl2。现准确称取1.80 g有机物样品(含碳、氢元素,还可能含有氧元素),经燃烧被吸收后A管质量增加1.76 g,B管质量增加0.36 g。请按要求填空。

图9-2
(1)此法适用于测定固体有机物的分子式,此有机物的组成元素可能是________。
(2)产生的气体按从左到右的流向,所选各装置导管口的连接顺序是___________________。
(3)E和D中应分别装何种药品? ____________________________________________。
(4)如果将CuO网去掉,A管增加的质量将________(填“增大”“减小”或“不变”)。
(5)该有机物的最简式是________。
(6)要确定该有机物的分子式,还必须知道的数据是________。
A.消耗液体E的质量
B.样品的摩尔质量
C.CuO固体减少的质量
D.C装置增加的质量
E.燃烧消耗氧气的物质的量
(7)在整个实验开始之前,需先让D产生的气体通过整套装置一段时间,其目的是________________________________________________________________________。
9.泉港一中自主招生乙炔(C2H2)气体和氧气反应能产生高温火焰,工人师傅常用氧炔焰切割或焊接金属。乙炔可由碳化钙(块状固体,化学式为CaC2)与水反应生成,同时生成一种白色固体。
[提出问题] 白色固体是什么物质?
[作出猜想] 小明经过思考认为有以下几种可能:
猜想一:CaO;猜想二:________;猜想三:Ca(OH)2。
[交流反思] 经过同学们交流讨论,认为猜想一不成立。否定猜想一的理由是________________________________________________________________________
________________________________________________________________________。
[进行实验]
(1)取少量白色固体放入试管中,滴加稀盐酸,没有观察到____________,证明猜想二不成立。
(2)取少量白色固体加入到水中,取上层清液,____________________________,有白色沉淀出现,证明猜想三成立。
则碳化钙(CaC2)与水反应的化学方程式为
________________________________________________________________________。
结论:白色固体是Ca(OH)2。
[拓展应用]
(1)已知碳化钙与水反应非常剧烈,乙炔的密度比空气略小。实验室欲制备并收集纯净的乙炔,要求做到节约、安全、随时发生、随时停止,你选择的装置是________(填序号)。

图9-3
(2)写出乙炔在空气中完全燃烧的化学方程式:
________________________________________________________________________。
答案
1.D 棉花是天然纤维,而涤纶是合成纤维。
2.D 若聚四氟乙烯溶于食用油等有机溶剂,则在做饭时就会被破坏掉。
3.C 在甲酸(HCOOH)、乙醛(CH3CHO)和丙酮(CH3COCH3)三种有机物中C、H原子的个数比为1∶2,可以求得质量比m(C)∶m(H)=6∶1,而这三种物质中除碳、氢两种元素外只有氧元素,氢元素的质量分数为x%,则碳元素的质量分数为6x%,所以氧元素的质量分数为1-7x%。
4.BD 由有机物燃烧时所消耗氧气的关系式可以知道:每一个碳原子消耗1个氧分子,每4个氢原子消耗1个氧分子,所以对于一分子CxHy来说,当其充分燃烧时所消耗的氧分子的个数是x+,假设下列有机物各一个分子,分别比较所消耗的氧分子数。由此可以知道:
A中C2H2所消耗的氧分子数是2+=,C6H6所消耗的氧分子数是6+=,则等分子数燃烧时所消耗氧气质量不相等;B中C2H4所消耗的氧分子数是2+=3,C2H5OH因为本身含有一个氧原子,所以,所消耗的氧分子数是2+-=3,则等分子数燃烧时所消耗氧气质量相等;C中C3H8所消耗的氧分子数是3+=5,C3H6所消耗的氧分子数是3+=,则等分子数燃烧时所消耗氧气质量不相等;D中CH3CHO因为本身含有一个氧原子,所消耗的氧分子数是2+-=,C2H2所消耗的氧分子数是2+=,则等分子数燃烧时所消耗氧气质量相等。
5.B 由糖类物质的通式Cm(H2O)n可以知道,糖类物质中氢原子和氧原子的个数比是21,分析这五种物质:①苯酚(C6H6O)、②蔗糖(C12H22O11)、③纤维素(C6H10O5)n、④葡萄糖(C6H12O6)、⑤氨基乙酸(C2H5O2N),可以知道②③④中氢、氧元素的原子个数比为2∶1,所以蔗糖、纤维素、葡萄糖属于糖类。
6.CD 1个二氧化碳分子中含有1个碳原子,1个水分子中含有2个氢原子,当碳原子和氢原子的个数比是1∶2时,生成的二氧化碳分子和水分子的个数比是1∶1;当碳原子和氢原子的个数比小于1∶2时,生成的水分子比二氧化碳分子多;当碳原子和氢原子的个数比大于1∶2时,生成的水分子比二氧化碳分子少。
7.C 由2.3 g某有机物在足量的氧气中充分燃烧,生成4.4 g二氧化碳和2.7 g水,则有机物中一定含有C、H两种元素,
碳元素的质量为4.4 g×=1.2 g,
氢元素的质量为2.7 g×=0.3 g,
1.2 g+0.3 g=1.5 g<2.3 g,
则有机物中一定含有氧元素,且氧元素的质量为2.3 g-1.5 g=0.8 g,
有机物中C、H、O的原子个数比为=261,
即有机物的化学式为C2H6O。
8.(1)C、H、O
(2)gefhicd(或dc)ab(或ba)
(3)H2O2溶液、MnO2
(4)减小 (5)CHO2 (6)B
(7)排出装置内空气,减小实验误差
(1)现准确称取1.80 g有机物样品,经燃烧被吸收后A管质量增加1.76 g为生成二氧化碳气体的质量,则有机物中碳元素的质量为0.48 g,B管质量增加0.36 g为生成水的质量,则有机物中氢元素的质量为0.04 g。碳和氢元素质量之和=0.04 g+0.48 g=0.52 g,则1.80 g有机物样品中含有氧元素的质量为1.28 g,此有机物的组成元素是C、H、O。(2)D中生成的氧气中含有水蒸气,应先通过C中的浓硫酸干燥,在F中电炉加热时用纯氧气氧化管内样品,生成二氧化碳和水,如有一氧化碳生成,则F中CuO可与CO进一步反应生成二氧化碳,然后分别通入B(吸收水)、A(吸收二氧化碳)中,根据产物的质量推断有机物的组成,则产生的氧气按从左到右的流向,所选装置各导管的连接顺序是gefhicd(或dc)ab(或ba)。(3)装置D是提供氧气的装置,E中是液体,锥形瓶中为固体,混合反应生成氧气,则试剂为过氧化氢溶液和二氧化锰,E和D中应分别装有药品H2O2溶液和MnO2。(4)CuO的作用是把有机物不完全燃烧产生的CO转化为CO2,若将CuO网去掉,A管增加的质量将减小。(5)由N=得:N(C)N(H)N(O)=1∶1∶2,最简式为CHO2。(6)已经知道有机物的最简式,要确定其分子式,则还要知道样品的摩尔质量(或有机物的相对分子质量)。(7)因为装置内空气成分影响水、二氧化碳质量的测定,所以其目的是排出装置内空气,减小实验误差。
9.[作出猜想] CaCO3
[交流反思] CaO能与水反应生成 Ca(OH)2
[进行实验] (1)有气体产生
(2)通入二氧化碳气体(合理即可)
CaC2+2H2O===Ca(OH)2+C2H2↑
[拓展应用] (1)C、F
(2)2C2H2+5O24CO2+2H2O
【培优导学案】浙教版科学九年级全册:7、酸、碱、盐 学案(含解析): 这是一份【培优导学案】浙教版科学九年级全册:7、酸、碱、盐 学案(含解析),共12页。
【培优导学案】浙教版科学九年级全册:23、人体健康 学案(含解析): 这是一份【培优导学案】浙教版科学九年级全册:23、人体健康 学案(含解析),共8页。
【培优导学案】浙教版科学九年级全册:21、遗传与进化 学案(含解析): 这是一份【培优导学案】浙教版科学九年级全册:21、遗传与进化 学案(含解析),共8页。













