
新疆高考化学三年(2021-2023)模拟题汇编-06氧族元素及其化合物
展开新疆高考化学三年(2021-2023)模拟题汇编-06氧族元素及其化合物
一、单选题
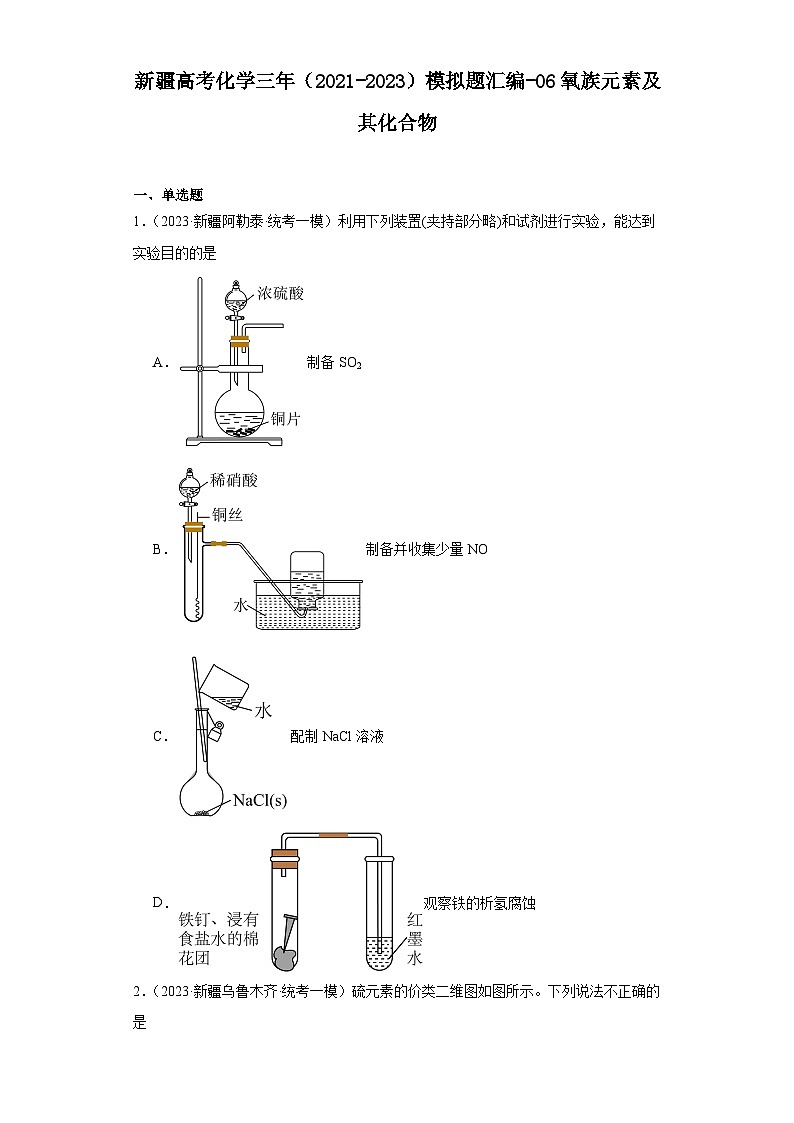
1.(2023·新疆阿勒泰·统考一模)利用下列装置(夹持部分略)和试剂进行实验,能达到实验目的的是
A.制备SO2
B.制备并收集少量NO
C.配制NaCl溶液
D.观察铁的析氢腐蚀
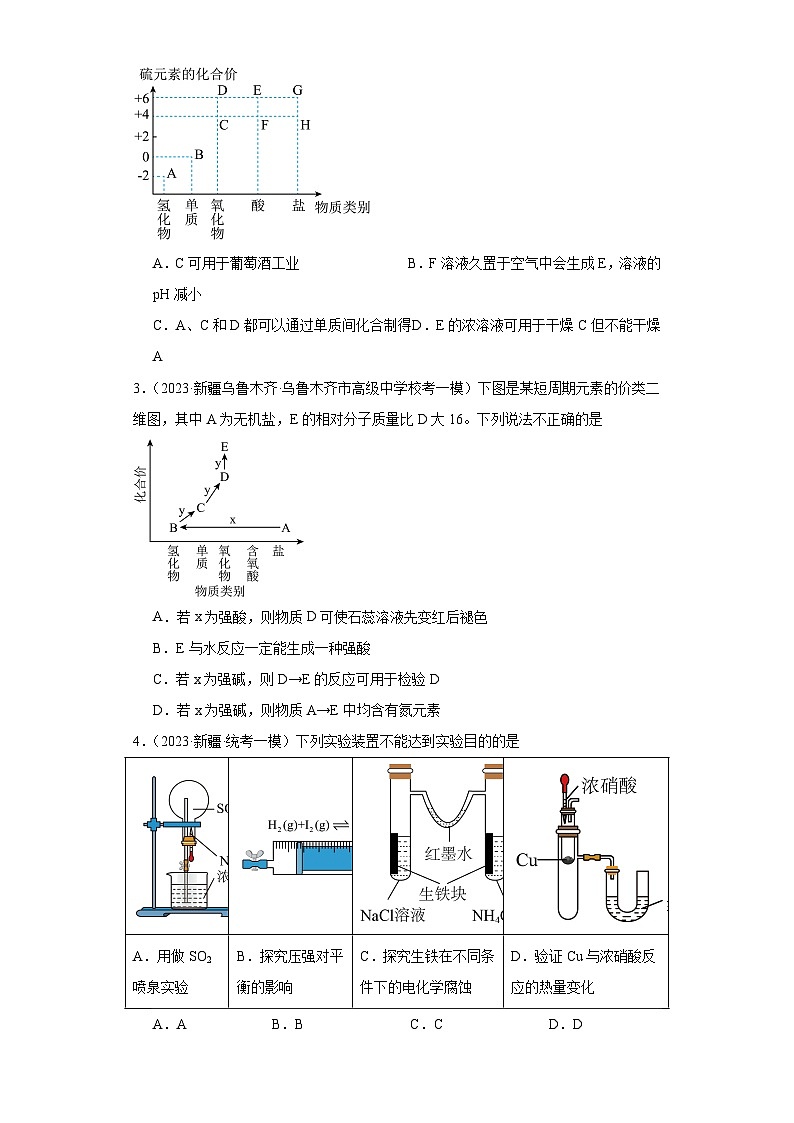
2.(2023·新疆乌鲁木齐·统考一模)硫元素的价类二维图如图所示。下列说法不正确的是
A.C可用于葡萄酒工业 B.F溶液久置于空气中会生成E,溶液的pH减小
C.A、C和D都可以通过单质间化合制得 D.E的浓溶液可用于干燥C但不能干燥A
3.(2023·新疆乌鲁木齐·乌鲁木齐市高级中学校考一模)下图是某短周期元素的价类二维图,其中A为无机盐,E的相对分子质量比D大16。下列说法不正确的是
A.若x为强酸,则物质D可使石蕊溶液先变红后褪色
B.E与水反应一定能生成一种强酸
C.若x为强碱,则D→E的反应可用于检验D
D.若x为强碱,则物质A→E中均含有氮元素
4.(2023·新疆·统考一模)下列实验装置不能达到实验目的的是
A.用做SO2喷泉实验
B.探究压强对平衡的影响
C.探究生铁在不同条件下的电化学腐蚀
D.验证Cu与浓硝酸反应的热量变化
A.A B.B C.C D.D
5.(2022·新疆·统考二模)化学与人类生活、社会可持续发展密切相关。下列说法不正确的是
A.目前汽油标准已由“国Ⅲ”提到“国Ⅳ”,这意味着汽车不再排放氮氧化物
B.用CO2合成可降解的聚碳酸酯塑料,可以实现“碳"的循环利用
C.“木活字”是由元代王祯创制的用于印刷的活字,“木活字”的主要成分是纤维素
D.“鹳鱼石斧图”彩陶缸是我国出土的一件珍贵历史文物,彩陶缸的主要成分是硅酸盐
6.(2022·新疆克拉玛依·统考三模)做好“碳达峰、碳中和”,需要从各个行业做起。下列措施不利于低碳生活的是
A.控制钢铁、水泥、焦炭等行业产能总量
B.将煤进行气化处理,提高煤的综合利用率
C.用脱硫处理的煤代替原煤做燃料
D.提高能源利用效率,大力发展循环经济
7.(2022·新疆·统考三模)20世纪80年代Townley首次提出利用电化学膜脱除烟气中SO2:将烟气预氧化使SO2转化为SO3,再将预氧化后的烟气利用如图所示原理进行净化。下列说法正确的是
A.预氧化时,可以用酸性KMnO4溶液来氧化SO2
B.阳极的电极反应式:2SO-4e-=2SO3↑+O2↑
C.电解过程中,硫酸根离子的物质的量在不断减少
D.工业上一般用蒸馏水吸收“扫出气”,得到的产物保存在棕色广口瓶中
8.(2022·新疆昌吉·统考二模)根据实验目的,设计相关实验,下列实验操作、现象解释及结论都正确的是
序号
操作
现象
解释或结论
A
在含0.1 mol的AgNO3溶液中依次加入NaCl溶液和KI溶液
溶液中先有白色沉淀生成,后来又变成黄色
Ksp(AgCl)>Ksp(AgI)
B
取FeSO4少许溶于水,加入几滴KSCN溶液
溶液变红色
FeSO4全部被氧化
C
将纯净的乙烯气体通入酸性KMnO4溶液
溶液紫色褪去
乙烯具有还原性
D
在Ca(ClO)2溶液中通入SO2气体
有沉淀生成
酸性: H2SO3> HClO
A.A B.B C.C D.D
9.(2022·新疆喀什·统考一模)下列变化不能通过一步化学反应实现的是( )
A.BaCl2→BaSO4 B.CuO→Cu(OH)2 C.NaOH→Na2SO3 D.MgSO4→Mg(OH)2
10.(2021·新疆昌吉·统考三模)用如图装置进行实验,下列叙述正确的是
A.试管中无明显现象 B.试管中出现白色沉淀
C.试管中出现蓝色沉淀 D.试管中溶液由无色变蓝色
11.(2021·新疆·统考模拟预测)下列由实验得出的结论正确的是
实验
结论
A
用小试管收集气体A做爆鸣实验,发现有爆鸣声
A一定是
B
某气体充入澄清石灰水中,有白色沉淀
气体一定是
C
对某溶液做焰色试验时,观察到黄色火焰
溶液中弈定含有,一定不含有
D
铁片投入到浓硫酸中,无现象
铁因钝化表面生成了氧化物保护膜
A.A B.B C.C D.D
12.(2021·新疆乌鲁木齐·统考三模)下列实验操作、现象及结论均正确的是
选项
操作
现象
结论
A
铝片先用砂纸打磨,再加入浓硝酸中
无明显现象
铝表面形成致密的氧化铝薄膜
B
向淀粉溶液中加适量20% H2SO4溶液,加热,冷却后加NaOH溶液至中性、再滴加少量碘水
溶液变蓝
淀粉未水解
C
将SO2缓慢通入滴有酚酞的NaOH溶液中
溶液红色褪去
SO2具有漂白性
D
向某溶液中滴加CCl4,振荡、静置
下层溶液显紫色
原溶液中有I-
A.A B.B C.C D.D
二、实验题
13.(2023·新疆·统考三模)硫代硫酸钠( Na2S2O3)俗称海波,广泛应用于照相定影及纺织业等领域。某实验小组制备硫代硫酸钠并探究其性质。
Ⅰ.硫代硫酸钠的制备
实验小组设计如下装置制备硫代硫酸钠
信息:Na2S2O3,中S元素的化合价分别为-2和+6
(1)仪器a的名称是 。B中发生的化学反应方程式为 (该反应理论上钠元素的利用率为100%)。
Ⅱ.产品纯度的测定
①溶液配制:准确称取该硫代硫酸钠样品8. 000 g,配制成50. 00 mL溶液。
②滴定:向锥形瓶中加入20. 00 mL 0.10 mol·L-1KIO3溶液,加入过量KI溶液和H2SO4溶液,然后加入淀粉作指示剂,用硫代硫酸钠样品溶液滴定碘单质,发生反应: I2+2 =2I-+
(2)生成碘单质的离子方程式为 。滴定终点现象为 , 消耗样品溶液25. 00 mL,则样品纯度为 %。
Ⅲ.硫代硫酸钠性质的探究
①取Na2S2O3晶体,溶解,配成0. 20 mol·L-1溶液。
②取4mL溶液,向其中加入1.0mL饱和氯水(pH=2.4),溶液立即出现浑浊,经检验浑浊物为S。
实验小组研究S产生的原因,提出了以下假设:
假设1:氧化剂氧化:Cl2、HClO等含氯的氧化性微粒氧化了-2价硫元素。
假设2:___________ ( 不考虑空气中氧气氧化)。
设计实验方案:
胶头滴管
现象
第①组
1.0 mL饱和氯水
立即出现浑浊
第②组
___________
一段时间后出现浑浊,且浑浊度比①组小
(3)假设2是 。
(4)第②组实验中胶头滴管加入的试剂是 。
(5)依据现象,S产生的主要原因是 。
(6)结合Ⅱ、Ⅲ分析纯度较低的原因是 。
14.(2021·新疆·统考二模)亚硝酰硫酸(NOSO4H)主要用于染料、医药等工业。通常状况下,它是一种液体,遇水水解,溶于浓硫酸不分解。实验室用如图装置(夹持装置略)制备少量NOSO4H回答下列问题:
(1)请写出NOSO4H遇水水解的化学方程式 。(已知:亚硝酸不稳定,易分解,发生反应2HNO2=NO2↑+NO↑+H2O)
(2)利用装置A制取SO2,下列最适宜的试剂是 (填下列选项字母)。
a.Na2SO3固体和20%硝酸
b.Na2SO3固体和20%硫酸
c.Na2SO3固体和20%盐酸
d.Na2SO3固体和70%硫酸
(3)装置C中浓HNO3和SO2在浓硫酸作用下反应制取NOSO4H。
①装置C中发生反应的化学方程式为 。三颈烧瓶置于冰水中,体系温度不宜过高的原因为 。
②若去掉装置D,会使NOSO4H的产量 (填“增大”“减少”或“无影响”)。
15.(2021·新疆喀什·统考一模)设计如下实验装置制备硫代硫酸钠晶体()(夹持仪器略),总反应为。已知:硫代硫酸钠晶体在中性或碱性溶液中较稳定,在酸性溶液中会产生浑浊;Na2S2O3稀溶液与BaCl2溶液混合无沉淀生成。
(1)仪器a的名称为 ,装置A中制备SO2的化学方程式为 。
(2)装置B的作用是 ;为保证Na2S2O3的产量,实验中通入的SO2不能过量,原因是 。
(3)装置C中可观察到溶液先变浑浊,后又变澄清,生成的浑浊物质的化学式为 。
(4)充分反应后,将装置C中溶液经过一系列操作可得硫代硫酸钠晶体()。准确称取7.00 g产品,溶于蒸馏水中配成100.00 mL溶液,取20.00 mL注入锥形瓶,以淀粉作指示剂,用0.10 mol/L的标准碘溶液滴定(杂质不参与反应)。已知:(无色)。
①标准碘溶液应盛放在 (填“酸式”或“碱式”)滴定管中。
②第一次滴定开始和结束时,滴定管中的液面如图,则消耗标准碘溶液的体积为 mL。
滴定次数
滴定前/mL
滴定后/mL
第二次
1.56
30.30
第三次
0.22
26.34
③重复上述操作三次,记录另两次数据如表,则产品中的质量分数为 %(保留四位有效数字)。
(5)若要检验固体硫代硫酸钠工业产品中是否含有Na2S2O3,需先加水配成稀溶液,再依次使用的试剂为 和品红溶液。
参考答案:
1.B
【详解】A.铜和浓硫酸在加热条件下才能反应生成二氧化硫气体,故不选A;
B.铜和稀硝酸反应生成硝酸铜、一氧化氮、水,NO难溶于水,用排水法收集NO,能达到实验目的,故选B;
C.配制NaCl溶液,不能直接在容量瓶中溶解氯化钠固体,故不选C;
D.铁钉在氯化钠溶液中发生吸氧腐蚀,不能达到实验目的,故不选D;
选B。
2.C
【详解】A.C为二氧化硫,可用于葡萄酒中杀菌消毒,还能起抗氧化的作用,可用于葡萄酒工业,A正确;
B.F溶液即H2SO3溶液,久置于空气中会被氧化生成H2SO4,亚硫酸是弱酸,硫酸是强酸,故溶液的pH减小,B正确;
C.A、C、D分别是H2S、SO2、SO3,氢气和S单质加热条件下反应生成H2S,硫单质与氧气反应只能生成二氧化硫,三氧化硫只能由二氧化硫在氧气中再次氧化而得到,故三氧化硫不能通过两种单质直接化合生成,C错误;
D.E为H2SO4,浓硫酸可以干燥二氧化硫但不能干燥硫化氢气体,二者会发生氧化还原反应,D正确;
故选C。
3.A
【分析】若x为强酸,由A为无机盐,E的相对分子质量比D大16可知,A为硫化物、B为硫化氢、C为S、D为二氧化硫、E为三氧化硫;若x为强碱,由A为无机盐,E的相对分子质量比D大16可知,A为铵盐、B为氨气、C为氮气、D为一氧化氮、E为二氧化氮。
【详解】A.由分析可知,若x为强酸,D为酸性氧化物二氧化硫,二氧化硫具有漂白性,但不能使酸碱指示剂石蕊溶液褪色,故A错误;
B.由分析可知,若x为强酸,E为三氧化硫,三氧化硫与水反应生成强酸硫酸,若x为强碱,E为二氧化氮,二氧化氮与水反应生成强酸硝酸和一氧化氮,则E与水反应一定能生成一种强酸,故B正确;
C.由分析可知,若x为强碱,D为一氧化氮,一氧化氮与氧气反应生成红棕色的二氧化氮,则D→E的反应可用于检验一氧化氮,故C正确;
D.由分析可知,若x为强碱,物质A→E的五种物质中均含有氮元素,故D正确;
故选A。
4.B
【详解】A.SO2易溶于浓NaOH溶液,可以用NaOH溶液做SO2喷泉实验,故不选A;
B.H2(g)+I2(g)2HI(g)反应前后气体系数和相等,压强对H2(g)+I2(g)2HI(g)平衡无影响,不能用H2(g)+I2(g)2HI(g)反应探究压强对平衡的影响,故选B;
C.铁在NaCl溶液中发生吸氧腐蚀,铁在NH4Cl溶液中发生析氢腐蚀,故不选C;
D.Cu与浓硝酸反应放热,大试管内气体膨胀,致使U形管内左侧液面降低、右侧液面升高,故不选D;
选B。
5.A
【详解】A.汽车尾气中的氮氧化物是氮气和氧气在高温条件下反应生成的,与汽油标准已由“国Ⅲ”提到“国Ⅳ”无关,故A错误;
B.用CO2合成的聚碳酸酯塑料,可降解生成CO2,有利于大气中“碳”的循环,故B正确;
C.木活字是木头制造的,其主要成分是纤维素,故C正确;
D.“鹳鱼石斧图”彩陶缸的主要成分是硅酸盐,故D正确;
故选A。
6.C
【分析】低碳生活就是指减少二氧化碳的排放,低能量、低消耗、低开支的生活方式。
【详解】A. 控制钢铁、水泥、焦炭等行业产能总量,可以减少碳煤的燃烧,减少二氧化碳的排放,A不符合题意;
B.将煤进行气化处理,提高煤的综合利用率,能达到节能目的,减少二氧化碳的排放,B不符合题意;
C.用脱硫处理的煤代替原煤做燃料,能减少二氧化硫的排放,不能减少二氧化碳的排放,C符合题意;
D.提高能源利用效率,大力发展循环经济,可以达到节能的目的,减少二氧化碳的排放,D不符合题意;
故选C。
7.B
【详解】A.若用酸性KMnO4溶液来氧化SO2,SO2被直接氧化成SO,A错误;
B.由图示可知,阳极扫出气有N2、O2和SO3,阳极电极反应式为:2SO-4e-=2SO3↑+O2↑,B正确;
C.由图示可知,阴极电极反应式为:2SO3+O2+4e-=2SO,阳极电极反应式为:2SO-4e-=2SO3↑+O2↑,电解过程中,硫酸根离子的物质的量不变,C错误;
D.工业上一般用浓硫酸来吸收SO3,得到的硫酸一般保存在细口试剂瓶中,D错误;
答案选B。
8.C
【详解】A.在含0.1 mol的AgNO3溶液中依次加入NaCl溶液和KI溶液,没有明确氯化钠是否过量,溶液中先有白色沉淀生成,后来又变成黄色,不能判断AgI沉淀是否由AgCl转化生成,所以不能得出Ksp(AgCl)>Ksp(AgI),故不选A;
B.取FeSO4少许溶于水,加入几滴KSCN溶液,溶液变红色,只能说明溶液中含有Fe3+,不能说明FeSO4全部被氧化,故不选B;
C.将纯净的乙烯气体通入酸性KMnO4溶液,溶液紫色褪去,说明高锰酸钾被还原,乙烯具有还原性,故选C;
D.在Ca(ClO)2溶液中通入SO2气体,SO2被氧化生成CaSO4沉淀,不能得出酸性H2SO3> HClO,故不选D;
选C。
9.B
【详解】A.BaCl2与H2SO4、Na2SO4等反应,均可生成BaSO4,故A不符合题意;
B.CuO不能与水反应生成Cu(OH)2,故B符合题意;
C.NaOH与SO2发生反应生成Na2SO3和H2O,故C不符合题意;
D.MgSO4与NaOH、Ba(OH)2等反应,均可生成Mg(OH)2,故D不符合题意。
综上所述,答案为B。
10.B
【详解】浓硝酸与Cu反应生成二氧化氮,二氧化氮与水反应生成硝酸,硝酸将氧化成,有硫酸钡白色沉淀生成,B项正确,故选:B。
11.D
【详解】A.有爆鸣声说明 是易燃易爆气体,除了H2,甲烷、乙烯等都是易燃易爆气体,在使用前都要验纯,A项不符合题意;
B.SO2是酸性氧化物,通入澄清石灰水中也能得到白色沉淀CaSO3,B项不符合题意;
C.K+的焰色试验需透过蓝色钴玻璃来观察,因为Na元素的黄色有遮盖作用,在该试验中,K+无法确定,C项不符合题意;
D.常温条件下,浓硫酸与Fe可以发生钝化,形成之谜的氧化物薄膜,阻止反应的进一步进行,D项符合题意;
故正确选项为D
12.A
【详解】A.常温下Al遇浓硝酸发生钝化,铝表面形成致密的氧化铝薄膜,无明显现象,故A正确;
B.水解后在碱性溶液中加银氨溶液检验葡萄糖,通过观察是否有银镜现象证明淀粉是否水解,故B错误;
C.二氧化硫为酸性氧化物,与NaOH溶液反应生成盐和水,溶液褪色,与漂白性无关,故C错误;
D.碘单质易溶于四氯化碳,下层溶液显紫色,证明原溶液中是有碘单质,不能说明有碘离子,故D错误;
故选A
13.(1) 三颈烧瓶 Na2CO3+2Na2S+4SO2 = 3Na2S2O3+CO2
(2) +5I-+6H+ =3I2+3H2O 滴入最后半滴硫代硫酸钠溶液,溶液由蓝色变为无色,且半分钟不复原 47.40
(3)酸性条件下, Na2S2O3与酸反应生成S单质
(4)1.0 mLpH=2.4的盐酸
(5)氯气等含氯元素的氧化性微粒将-2价硫氧化
(6)SO2可能过量,导致酸性环境,消耗Na2S2O3
【分析】A中70%的硫酸溶液与亚硫酸钠粉末反应生成SO2,SO2进入B装置与Na2S、Na2CO3混合溶液反应生成硫代硫酸钠,装置C为尾气处理装置,用于吸收多余的SO2。
【详解】(1)从图中可知,仪器a的名称为三颈烧瓶。B中SO2、Na2S、Na2CO3反应生成硫代硫酸钠,该反应理论上Na元素利用率为100%,则除了有硫代硫酸钠还有CO2生成,反应的化学方程式为Na2CO3+2Na2S+4SO2 = 3Na2S2O3+CO2。
(2)KIO3与KI在酸性条件下反应生成I2,离子方程式为+5I-+6H+ =3I2+3H2O,KIO3先与KI在酸性条件下反应生成碘单质,加入淀粉为指示剂,再用硫代硫酸钠滴定碘单质,随着硫代硫酸钠的加入,碘逐渐被消耗,滴定终点的现象为滴入最后半滴硫代硫酸钠溶液,溶液由蓝色变为无色,且半分钟内不复原。根据离子方程式+5I-+6H+ =3I2+3H2O,生成的碘单质有0.02L×0.1mol/L×3=0.006mol,根据方程式I2+2 =2I-+ ,消耗的硫代硫酸钠有0.012mol,已知消耗样品溶液25mL,样品溶液中含有硫代硫酸钠样品4g,则样品纯度为0.012mol×158g/mol÷4g=47.4%
(3)硫代硫酸钠溶液中加入饱和氯水,溶液立即出现浑浊,该浑浊物为S,同时氯水呈酸性,另一种可能的原因为酸性条件下,硫代硫酸钠与酸反应生成硫单质。
(4)通过两组实验要验证假设1、2,第①组实验中加入了饱和氯水,则第②组实验中需要加入酸,则第②组实验中胶头滴管加入的试剂为1.0mLpH=2.4的盐酸。
(5)对比①②两组实验可知,硫代硫酸钠中加入饱和氯水,立即出现浑浊,加入等量的盐酸,一段时间后出现浑浊且浑浊度小于①组,说明S产生的主要原因为氯气等含氯元素的氧化性微粒将-2价的硫氧化。
(6)从Ⅲ中可知,酸性条件下,硫代硫酸钠反应生成S单质,Ⅱ中经过计算可知硫代硫酸钠样品的纯度较低,可能的原因为通入了过量的SO2,导致B溶液酸性较强,酸性条件下消耗了Na2S2O3。
14.(1)2NOSO4H+H2O=2H2SO4+NO↑+NO2↑
(2)d
(3) HNO3+SO2NOSO4H 温度过高,浓硝酸易挥发和分解 减少
【分析】装置A制取SO2,经B中五氧化二磷干燥后,在装置C中浓HNO3和SO2在浓硫酸作用下反应制取NOSO4H,D中碱石灰用于吸收空气中水份防止C中NOSO4H遇水水解、并吸收多余二氧化硫及挥发的硝酸以防空气污染。
【详解】(1)已知亚硝酸不稳定,易分解,发生反应2HNO2=NO2↑+NO↑+H2O。NOSO4H遇水分解时N元素化合价既升高又降低得到NO2、NO,则反应的化学方程式:2NOSO4H+H2O=2H2SO4+NO↑+NO2↑。
(2)a.硝酸易挥发,且具有强氧化性,Na2SO3溶液与HNO3反应难以得到二氧化硫,故a错误;
b.强酸可制备弱酸、二氧化硫易溶于水,故Na2SO3固体与浓硫酸反应生成硫酸钠和二氧化硫和水,20%硫酸中水含量高难以逸出大量二氧化硫,故b错误;
c.强酸可制备弱酸,但盐酸具有挥发性,会导致二氧化硫中混有氯化氢,故c错误;
d.强酸可制备弱酸,Na2SO3固体与70%的浓硫酸反应生成硫酸钠和二氧化硫和水,故d正确;
故答案为:d。
(3)①装置B中浓HNO3与SO2在浓H2SO4作用下反应制得NOSO4H,反应方程式为:HNO3+SO2NOSO4H,因温度过高,浓硝酸易挥发和分解,所以装置B中的三颈烧瓶应放在冷水浴中。
②NOSO4H遇水水解,若去掉装置D,空气中的水蒸气会进入C中使NOSO4H水解解,会使NOSO4H的产量减少。
15.(1) 分液漏斗
(2) 防止溶液倒吸 若SO2过量,溶液显酸性产物会分解
(3)S
(4) 酸式 26.10 92.50
(5)氯化钡溶液、盐酸
【解析】(1)
根据装置图可知:仪器a的名称是分液漏斗;
在装置A中浓硫酸与Na2SO3发生复分解反应产生SO2气体,反应方程式为:;
(2)
装置B的作用是防止溶液倒吸;
为保证Na2S2O3的产量,实验中通入的SO2不能过量,这是由于SO2溶于水反应产生H2SO3,使溶液显酸性,酸性环境导致产物分解;
(3)
在装置C中SO2、Na2S在溶液中反应产生S单质,S是淡黄色不溶于水的物质,因此看到溶液变浑浊;后发生反应:,产生物质是可溶性的,因此溶液又变澄清;
(4)
①标准碘溶液具有强氧化性,会腐蚀碱式滴定管的橡胶管,故应盛放在酸式滴定管中;
②根据滴定管滴定前后两次刻度数值可知:第一次滴定时反应消耗标准碘溶液体积是26.10 mL;第二次滴定时反应消耗标准碘溶液体积是(30.30-1.56) mL=28.74 mL;第三次滴定时反应消耗标准碘溶液体积是(26.34-0.22) mL=26.12 mL,显然第二次实验数据偏差较大,应该舍弃,则反应消耗标准碘溶液平均体积V=。n(I2)=0.10 mol/L× 26.11 mL× 10-3 L/mL=2.611× 10-3 mol,根据反应转化关系可知n(Na2S2O3)=2n(I2)=5.222× 10-3 mol,m()=5.222× 10-3 mol×248 g/mol=1.295 g,则产品中的纯度为:;
(5)
Na2CO3、Na2S混合溶液中通入SO2气体可制得Na2S2O3,同时其中常含有少量杂质Na2SO4,检验其中是否含有Na2S2O3时,先向样品溶于水配制成稀溶液,然后向其中加入足量BaCl2溶液,Na2SO4会变为BaSO4沉淀,Na2S2O3稀溶液与BaCl2溶液混合不反应,然后过滤,向滤液中加入稀HCl,看到有沉淀生成,同时有刺激性气味的气体放出,该气体能够使品红溶液褪色,说明样品中含有Na2S2O3,加入盐酸时发生反应为:Na2S2O3+2HCl=2NaCl+S↓+SO2↑+H2O,所以若要检验固体硫代硫酸钠工业产品中是否含有Na2S2O3,需使用的试剂为氯化钡溶液、盐酸、品红溶液。
山西高考化学三年(2021-2023)模拟题汇编-06氧族元素及其化合物: 这是一份山西高考化学三年(2021-2023)模拟题汇编-06氧族元素及其化合物,共22页。试卷主要包含了单选题,工业流程题,实验题,元素或物质推断题等内容,欢迎下载使用。
山西高考化学三年(2021-2023)模拟题汇编-06氧族元素及其化合物: 这是一份山西高考化学三年(2021-2023)模拟题汇编-06氧族元素及其化合物,共22页。试卷主要包含了单选题,工业流程题,实验题,元素或物质推断题等内容,欢迎下载使用。
吉林高考化学三年(2021-2023)模拟题汇编-06氧族元素及其化合物: 这是一份吉林高考化学三年(2021-2023)模拟题汇编-06氧族元素及其化合物,共15页。试卷主要包含了单选题,实验题等内容,欢迎下载使用。












