

- 新教材2023高中化学第三章晶体结构与性质章末整合提升新人教版选择性必修2 试卷 试卷 0 次下载
- 新教材2023高中化学第三章晶体结构与性质第一节物质的聚集状态与晶体的常识课时1物质的聚集状态晶体与非晶体同步测试新人教版选择性必修2 试卷 0 次下载
- 新教材2023高中化学第三章晶体结构与性质第三节金属晶体与离子晶体同步测试新人教版选择性必修2 试卷 0 次下载
- 新教材2023高中化学第三章晶体结构与性质第二节分子晶体与共价晶体课时1分子晶体同步测试新人教版选择性必修2 试卷 0 次下载
- 新教材2023高中化学第三章晶体结构与性质第二节分子晶体与共价晶体课时2共价晶体同步测试新人教版选择性必修2 试卷 0 次下载
化学选择性必修2第三章 晶体结构与性质第一节 物质的聚集状态与晶体的常识课时作业
展开第一节物质的聚集状态与晶体的常识
课时2 晶胞 晶体结构的测定
【基础巩固】
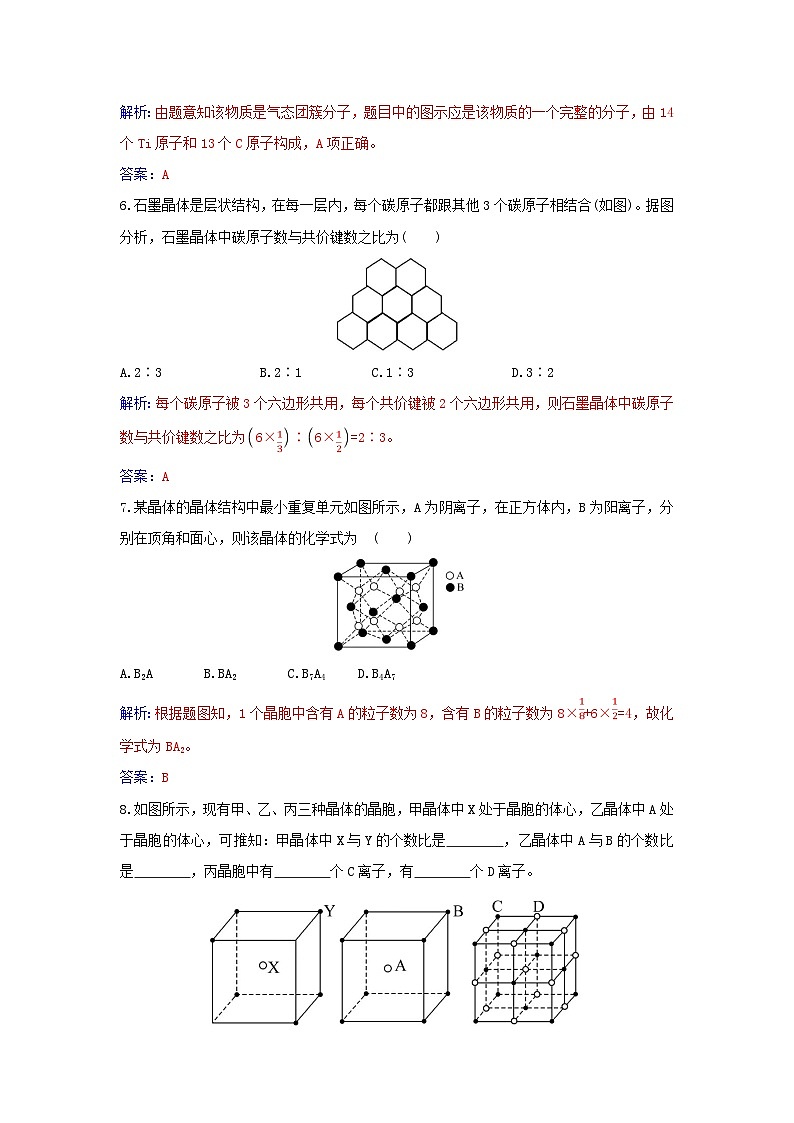
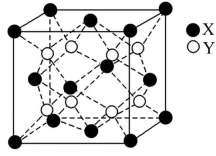
1.某物质的晶体中含X、Y、Z三种元素,其排列方式如图所示,晶胞中X、Y、Z的原子个数比为 ( )
A.1∶3∶1 B.2∶3∶1 C.1∶2∶1 D.1∶3∶3
解析:该晶体结构单元中含X的个数为8×![]() =1,含Y的个数为4×
=1,含Y的个数为4×![]() =2,含Z的个数为1,因此N(X)∶N(Y)∶N(Z)=1∶2∶1,故C项正确。
=2,含Z的个数为1,因此N(X)∶N(Y)∶N(Z)=1∶2∶1,故C项正确。
答案:C
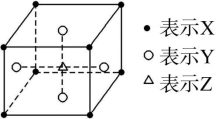
2.钛酸钡的热稳定性好,介电常数高,在小型变压器、话筒和扩音器中都有应用。钛酸钡晶体结构示意图如图所示,它的化学式是 ( )
A.BaTi8O12 B.BaTi4O5 C.BaTi2O4 D.BaTiO3
解析:观察钛酸钡晶体结构示意图可知,Ba在立方体的中心,完全属于该晶胞;Ti处于立方体的8个顶角,每个Ti有![]() 属于该晶胞;O处于立方体的12条棱的中点,每个O有
属于该晶胞;O处于立方体的12条棱的中点,每个O有![]() 属于该晶胞。即晶体中N(Ba)∶N(Ti)∶N(O)=1∶
属于该晶胞。即晶体中N(Ba)∶N(Ti)∶N(O)=1∶![]() 8×
8×![]()
![]() ∶
∶![]() 12×
12×![]()
![]() =1∶1∶3。
=1∶1∶3。
答案:D
3.下列是晶体结构中具有代表性的最小重复单元(晶胞)的排列方式,其对应的化学式正确的是(图中:![]() -X,
-X,![]() -Y,
-Y,![]() -Z) ( )
-Z) ( )
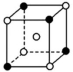
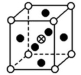
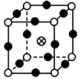
A.X2Y B.XY3C.XY3Z D.XYZ
解析:A项所示的晶胞中X的个数为1,Y的个数为8×![]() =1,化学式为XY;B项所示的晶胞中X的个数为1+4×
=1,化学式为XY;B项所示的晶胞中X的个数为1+4×![]() =
=![]() ,Y的个数为4×
,Y的个数为4×![]() =
=![]() ,化学式为X3Y;C项所示的晶胞中X的个数为8×
,化学式为X3Y;C项所示的晶胞中X的个数为8×![]() =1,Y的个数为6×
=1,Y的个数为6×![]() =3,Z的个数为1,化学式为XY3Z;D项所示的晶胞中X的个数为8×
=3,Z的个数为1,化学式为XY3Z;D项所示的晶胞中X的个数为8×![]() =1,Y的个数为12×
=1,Y的个数为12×![]() =3,Z的个数为1,化学式为XY3Z。
=3,Z的个数为1,化学式为XY3Z。
答案:C
4.已知CsCl晶体的密度为d g·cm-3,NA为阿伏加德罗常数的值,相邻两个Cs+的核间距为a cm,如图所示,则CsCl的摩尔质量可以表示为 ( )
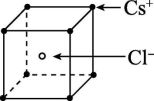
A.NA·a3·d g·mol-1 B.![]() g·mol-1
g·mol-1
C.![]() g·mol-1 D.
g·mol-1 D.![]() g·mol-1
g·mol-1
解析:根据晶胞中粒子个数的计算知,1个CsCl晶胞中含1个Cs+和1个Cl-,M=d·V·NA mol-1=d·a3·NA g·mol-1。
答案:A
5.一种钛原子和碳原子构成的气态团簇分子的结构如图所示,顶角和面心的原子是钛原子,棱的中心和体心的原子是碳原子,它的化学式为 ( )
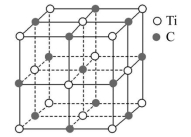
A.Ti14C13 B.TiC C.Ti4C4 D.Ti4C3
解析:由题意知该物质是气态团簇分子,题目中的图示应是该物质的一个完整的分子,由14个Ti原子和13个C原子构成,A项正确。
答案:A
6.石墨晶体是层状结构,在每一层内,每个碳原子都跟其他3个碳原子相结合(如图)。据图分析,石墨晶体中碳原子数与共价键数之比为( )
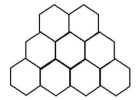
A.2∶3 B.2∶1 C.1∶3 D.3∶2
解析:每个碳原子被3个六边形共用,每个共价键被2个六边形共用,则石墨晶体中碳原子数与共价键数之比为![]() 6×
6×![]()
![]() ∶
∶![]() 6×
6×![]()
![]() =2∶3。
=2∶3。
答案:A
7.某晶体的晶体结构中最小重复单元如图所示,A为阴离子,在正方体内,B为阳离子,分别在顶角和面心,则该晶体的化学式为 ( )
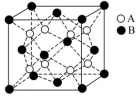
A.B2A B.BA2 C.B7A4 D.B4A7
解析:根据题图知,1个晶胞中含有A的粒子数为8,含有B的粒子数为8×![]() +6×
+6×![]() =4,故化学式为BA2。
=4,故化学式为BA2。
答案:B
8.如图所示,现有甲、乙、丙三种晶体的晶胞,甲晶体中X处于晶胞的体心,乙晶体中A处于晶胞的体心,可推知:甲晶体中X与Y的个数比是 ,乙晶体中A与B的个数比是 ,丙晶胞中有 个C离子,有 个D离子。
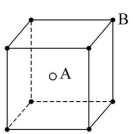

甲乙丙
解析:甲晶体的晶胞中并不是8个顶角上都有Y,而只有6个顶角上存在Y原子。甲晶体中N(X)∶N(Y)=1∶![]() 6×
6×![]()
![]() =4∶3;乙晶体中N(A)∶N(B)=1∶
=4∶3;乙晶体中N(A)∶N(B)=1∶![]() 8×
8×![]()
![]() =1∶1;丙晶胞中C的个数为8×
=1∶1;丙晶胞中C的个数为8×![]() +6×
+6×![]() =4,D的个数为12×
=4,D的个数为12×![]() +1=4。
+1=4。
答案:4∶3 1∶1 4 4
9.(2022·广东东莞)某晶体的晶胞结构如图所示,请回答下列问题。
(1)晶体中每个Y粒子同时吸引着 个X粒子,每个X粒子同时吸引着 个Y粒子,该晶体的化学式为 。
(2)晶体中每个X粒子周围与它最近且距离相等的X粒子共有
个。
(3)设该晶体的摩尔质量为M g·mol-1,晶体密度为ρ g·cm-3,阿伏加德罗常数为NA mol-1,则晶体中两个最近的X粒子间的距离为
cm。
解析: (1)由题图可得,晶体中每个Y粒子同时吸引着4个X粒子;在题图所示晶胞中,以面心处的X粒子为研究对象,每个X粒子同时吸引着4个Y粒子,而每个X粒子被2个晶胞所共用,则在晶体中每个X粒子同时吸引着4×2=8个Y粒子;一个晶胞中含有X粒子的数目为8×![]() +6×
+6×![]() =4,含有Y粒子的数目为8,X、Y粒子数目之比为1∶2,故该晶体的化学式为XY2或Y2X。
=4,含有Y粒子的数目为8,X、Y粒子数目之比为1∶2,故该晶体的化学式为XY2或Y2X。
(2)由晶胞结构可知,以顶点的X粒子为研究对象,一个晶胞内与之距离最近且相等的X粒子位于面心处,有3个,而每个顶点X粒子被8个晶胞所共用,每个面心X粒子被2个晶胞所共用,则晶体中与X粒子距离最近且相等的X粒子的数目为8×3×![]() =12。
=12。
(3)设该晶胞的边长为a cm,则可得a3cm3×ρg·cm-3×NA mol-1=4×M g·mol-1,解得a=![]() ,晶胞的边长为晶体中两个最近的X粒子间距离的
,晶胞的边长为晶体中两个最近的X粒子间距离的![]() 倍,则晶体中两个最近的X粒子间的距离为
倍,则晶体中两个最近的X粒子间的距离为![]() ×
×![]() cm。
cm。
答案:(1)4 8 XY2(或Y2X) (2)12 (3)![]() ×
×![]()
【拓展提高】
10.科学家发现钇钡铜氧化合物在90 K具有超导性,若该化合物的结构如图所示,则该化合物的化学式可能是 ( )
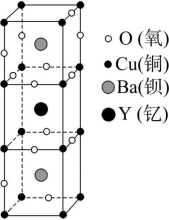
A.YBa2Cu3O8 B.YBa2Cu2O5C.YBa2Cu3O5 D.YBaCu4O4
解析:由题图所示晶胞可知,一个晶胞中有1个Y,2个Ba;晶胞最上方、最下方分别有4个Cu,它们分别被8个晶胞所共用,晶体中间立方体的8个顶角各有一个Cu,它们分别被4个晶胞共用,因此该晶胞中的Cu的数目为8×![]() +8×
+8×![]() =3;晶胞棱上共有6个O,分别被4个晶胞共用,晶胞面上共有7个O,它们分别被2个晶胞共用,因此该晶胞中的O的个数为6×
=3;晶胞棱上共有6个O,分别被4个晶胞共用,晶胞面上共有7个O,它们分别被2个晶胞共用,因此该晶胞中的O的个数为6×![]() +7×
+7×![]() =5。所以晶体中Y、Ba、Cu、O原子个数比为1∶2∶3∶5,化学式为YBa2Cu3O5。
=5。所以晶体中Y、Ba、Cu、O原子个数比为1∶2∶3∶5,化学式为YBa2Cu3O5。
答案:C
11.氯化钠晶体是由钠离子(图中的“●”)和氯离子(图中的“![]() ”)构成的,且均为等距离的交错排列。已知氯化钠的密度是2.2 g·cm-3,阿伏加德罗常数为6.02×1023 mol-1。在氯化钠晶体中两个距离最近的钠离子中心间的距离最接近于 ( )
”)构成的,且均为等距离的交错排列。已知氯化钠的密度是2.2 g·cm-3,阿伏加德罗常数为6.02×1023 mol-1。在氯化钠晶体中两个距离最近的钠离子中心间的距离最接近于 ( )
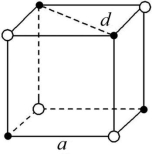
A.3.0×10-8 cm B.3.5×10-8 cm
C.4.0×10-8 cm D.5.0×10-8 cm
解析:如题图所示,a表示其边长,d表示两个Na+中心间的距离。每个小立方体含Na+的个数为![]() ×4=
×4=![]() ,含Cl-的个数为
,含Cl-的个数为![]() ×4=
×4=![]() ,即每个小立方体含Na+-Cl-离子对
,即每个小立方体含Na+-Cl-离子对![]() 个。则有:a3×2.2 g·cm-3=
个。则有:a3×2.2 g·cm-3=![]() ,又因为d=
,又因为d=![]() a,故解得氯化钠晶体中两个距离最近的Na+中心间的距离约为4.0×10-8 cm。
a,故解得氯化钠晶体中两个距离最近的Na+中心间的距离约为4.0×10-8 cm。
答案:C
12.(1)某镍白铜合金的立方晶胞结构如图所示。晶胞中铜原子与镍原子的数量比为 。
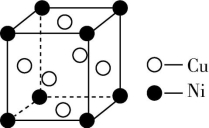
(2)Cu2O为半导体材料,在其立方晶胞内部有4个氧原子,其余氧原子位于面心和顶点,则该晶胞中有 个铜原子。
解析: (1)Cu原子位于面心,个数为6×![]() =3。Ni原子位于顶角,个数为8×
=3。Ni原子位于顶角,个数为8×![]() =1,铜原子与镍原子的数量比为3∶1。
=1,铜原子与镍原子的数量比为3∶1。
(2)根据“均摊法”计算,1个晶胞中含有的氧原子数为4+6×![]() +8×
+8×![]() =8,再结合化学式Cu2O知,1个晶胞中含有16个铜原子。
=8,再结合化学式Cu2O知,1个晶胞中含有16个铜原子。
答案:(1)3∶1 (2)16
13.用晶体的X射线衍射法可以测得阿伏加德罗常数。对金属铜的测定得到以下结果:晶胞结构如图,边长为361 pm。又知铜的密度为9.00 g·cm-3,则铜晶胞的体积约为 cm3,晶胞的质量约为 g,阿伏加德罗常数为 [已知Ar(Cu)=63.6]。
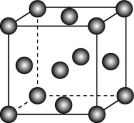
解析:铜的一个晶胞能分摊到4个Cu原子;1 pm=10-10 cm,故一个晶胞的体积为(361×10-10 cm)3≈4.70×10-23 cm3;一个晶胞的质量为4.7×10-23 cm3×9.00 g·cm-3=4.23×10-22 g,由m=![]() ×M,得NA≈6.01×1023 mol-1。
×M,得NA≈6.01×1023 mol-1。
答案:4.70×10-23 4.23×10-22 6.01×1023 mol-1
【挑战创新】
14.如图所示为某些晶体的结构示意图:
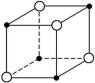
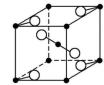
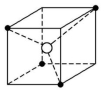
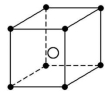
A B C D
![]()
(1)以M代表阳离子,以N代表阴离子,写出各晶体的组成表达式。
A: 、B: 、C: 、D: 。
(2)已知FeS2晶体(黄铁矿的主要成分)具有A的晶体结构。
①FeS2晶体中具有的化学键类型是 。
②若晶体结构A中相邻的阴、阳离子间的距离为a cm,且用NA代表阿伏加德罗常数的值,则FeS2晶体的密度是 g·cm-3。
解析:(1)对于A晶体,阴离子位于立方体4个顶角,因此阴离子在该立方体内只有4×![]() =
=![]() 个,同理阳离子也只有
个,同理阳离子也只有![]() 个,组成上为
个,组成上为![]() ∶
∶![]() =1∶1,表达式为MN;对于B晶体,阴离子在立方体内有4×
=1∶1,表达式为MN;对于B晶体,阴离子在立方体内有4×![]() +2=4个,阳离子在立方体内有8×
+2=4个,阳离子在立方体内有8×![]() +1=2个,组成为MN2;对于C晶体,阴离子在立方体内有1个,阳离子在立方体内有4×
+1=2个,组成为MN2;对于C晶体,阴离子在立方体内有1个,阳离子在立方体内有4×![]() =
=![]() 个,组成为MN2;对于D晶体,阴离子在立方体内有1个,阳离子在立方体内有8×
个,组成为MN2;对于D晶体,阴离子在立方体内有1个,阳离子在立方体内有8×![]() =1个,组成为MN。
=1个,组成为MN。
(2)FeS2晶体中的化学键为离子键和硫硫之间的非极性共价键。密度ρ=![]() ,由立方体内阴、阳离子个数和摩尔质量可求出m,而由立方体的边长即阴、阳离子间的距离可求出立方体体积,故ρ=
,由立方体内阴、阳离子个数和摩尔质量可求出m,而由立方体的边长即阴、阳离子间的距离可求出立方体体积,故ρ=![]() g·cm-3=
g·cm-3=![]() g·cm-3。
g·cm-3。
答案:(1)MN MN2 MN2 MN
(2)①离子键、非极性共价键 ②![]()
化学第三章 晶体结构与性质第一节 物质的聚集状态与晶体的常识练习: 这是一份化学第三章 晶体结构与性质第一节 物质的聚集状态与晶体的常识练习,共10页。试卷主要包含了下列说法不正确的是,下列途径不能得到晶体的是,下列关于晶体的说法正确的是等内容,欢迎下载使用。
高中第一节 物质的聚集状态与晶体的常识练习: 这是一份高中第一节 物质的聚集状态与晶体的常识练习,共6页。
高中化学人教版 (2019)选择性必修2第一节 物质的聚集状态与晶体的常识第2课时课后练习题: 这是一份高中化学人教版 (2019)选择性必修2第一节 物质的聚集状态与晶体的常识第2课时课后练习题,共7页。试卷主要包含了某离子化合物的晶胞如图所示,冰晶石的晶体结构单元如图所示,如图为氯化钠的晶胞结构示意图等内容,欢迎下载使用。













