




2023年高考真题和模拟题化学分项汇编(全国通用)专题12+工艺流程综合题
展开专题12 工艺流程综合题
1.(2023·全国甲卷)是一种压电材料。以为原料,采用下列路线可制备粉状。
回答下列问题:
(1)“焙烧”步骤中碳粉的主要作用是_______。
(2)“焙烧”后固体产物有、易溶于水的和微溶于水的。“浸取”时主要反应的离子方程式为_______。
(3)“酸化”步骤应选用的酸是_______(填标号)。
a.稀硫酸 b.浓硫酸 c.盐酸 d.磷酸
(4)如果焙烧后的产物直接用酸浸取,是否可行?_______,其原因是_______。
(5)“沉淀”步骤中生成的化学方程式为_______。
(6)“热分解”生成粉状钛酸钡,产生的_______。
2.(2023·全国乙卷)LiMn2O4作为一种新型锂电池正极材料受到广泛关注。由菱锰矿(MnCO3,含有少量Si、Fe、Ni、Al等元素)制备LiMn2O4的流程如下:
已知:Ksp[Fe(OH)3]=2.8×10-39,Ksp[Al(OH)3]=1.3×10-33,Ksp[Ni(OH)2]=5.5×10-16。
回答下列问题:
(1)硫酸溶矿主要反应的化学方程式为_______。为提高溶矿速率,可采取的措施_______(举1例)。
(2)加入少量MnO2的作用是_______。不宜使用H2O2替代MnO2,原因是_______。
(3)溶矿反应完成后,反应器中溶液pH=4,此时c(Fe3+)=_______mol·L-1;用石灰乳调节至pH≈7,除去的金属离子是_______。
(4)加入少量BaS溶液除去Ni2+,生成的沉淀有_______。
(5)在电解槽中,发生电解反应的离子方程式为_______。随着电解反应进行,为保持电解液成分稳定,应不断_______。电解废液可在反应器中循环利用。
(6)缎烧窑中,生成LiMn2O4反应的化学方程式是_______。
3.(2023·新课标卷)铬和钒具有广泛用途。铬钒渣中铬和钒以低价态含氧酸盐形式存在,主要杂质为铁、铝、硅、磷等的化合物,从铬钒渣中分离提取铬和钒的一种流程如下图所示:
已知:最高价铬酸根在酸性介质中以Cr2O存在,在碱性介质中以CrO存在。
回答下列问题:
(1)煅烧过程中,钒和铬被氧化为相应的最高价含氧酸盐,其中含铬化合物主要为___________(填化学式)。
(2)水浸渣中主要有SiO2和___________。
(3)“沉淀”步骤调pH到弱碱性,主要除去的杂质是___________。
(4)“除硅磷”步骤中,使硅、磷分别以MgSiO3和MgNH4PO4的形式沉淀,该步需要控制溶液的pH≈9以达到最好的除杂效果,若pH<9时,会导致___________;pH>9时,会导致___________。
(5)“分离钒”步骤中,将溶液pH调到1.8左右得到V2O5沉淀,V2O5在pH<1时,溶解为VO或VO3+在碱性条件下,溶解为VO或VO,上述性质说明V2O5具有___________(填标号)。
A.酸性 B.碱性 C.两性
(6)“还原”步骤中加入焦亚硫酸钠(Na2S2O5)溶液,反应的离子方程式为___________。
4.(2023·北京卷)以银锰精矿(主要含、、)和氧化锰矿(主要含)为原料联合提取银和锰的一种流程示意图如下。
已知:酸性条件下,的氧化性强于。
(1) “浸锰”过程是在溶液中使矿石中的锰元素浸出,同时去除,有利于后续银的浸出:矿石中的银以的形式残留于浸锰渣中。
①“浸锰”过程中,发生反应,则可推断:__________(填“>”或“<”)。
②在溶液中,银锰精矿中的和氧化锰矿中的发生反应,则浸锰液中主要的金属阳离子有__________。
(2) “浸银”时,使用过量和的混合液作为浸出剂,将中的银以形式浸出。
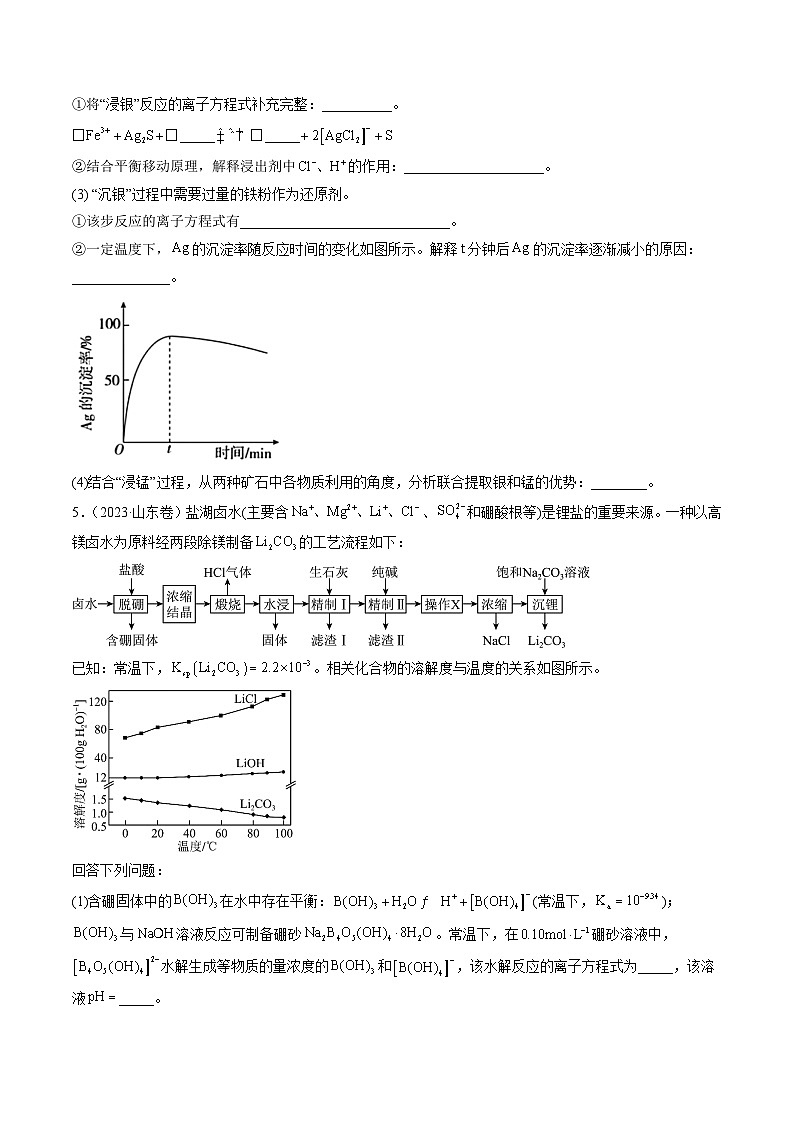
①将“浸银”反应的离子方程式补充完整:__________。
②结合平衡移动原理,解释浸出剂中的作用:____________________。
(3) “沉银”过程中需要过量的铁粉作为还原剂。
①该步反应的离子方程式有______________________________。
②一定温度下,的沉淀率随反应时间的变化如图所示。解释分钟后的沉淀率逐渐减小的原因:______________。
(4)结合“浸锰”过程,从两种矿石中各物质利用的角度,分析联合提取银和锰的优势:________。
5.(2023·山东卷)盐湖卤水(主要含、和硼酸根等)是锂盐的重要来源。一种以高镁卤水为原料经两段除镁制备的工艺流程如下:
已知:常温下,。相关化合物的溶解度与温度的关系如图所示。
回答下列问题:
(1)含硼固体中的在水中存在平衡:(常温下,);与溶液反应可制备硼砂。常温下,在硼砂溶液中,水解生成等物质的量浓度的和,该水解反应的离子方程式为_____,该溶液_____。
(2)滤渣Ⅰ的主要成分是_____(填化学式);精制Ⅰ后溶液中的浓度为,则常温下精制Ⅱ过程中浓度应控制在_____以下。若脱硼后直接进行精制Ⅰ,除无法回收外,还将增加_____的用量(填化学式)。
(3)精制Ⅱ的目的是_____;进行操作时应选择的试剂是_____,若不进行该操作而直接浓缩,将导致_____。
6.(2023·湖北卷)是生产多晶硅的副产物。利用对废弃的锂电池正极材料进行氯化处理以回收Li、Co等金属,工艺路线如下:
回答下列问题:
(1)Co位于元素周期表第_______周期,第_______族。
(2)烧渣是LiCl、和的混合物,“500℃焙烧”后剩余的应先除去,否则水浸时会产生大量烟雾,用化学方程式表示其原因_______。
(3)鉴别洗净的“滤饼3”和固体常用方法的名称是_______。
(4)已知,若“沉钴过滤”的pH控制为10.0,则溶液中浓度为_______。“850℃煅烧”时的化学方程式为_______。
(5)导致比易水解的因素有_______(填标号)。
a.Si-Cl键极性更大 b.Si的原子半径更大
c.Si-Cl键键能更大 d.Si有更多的价层轨道
7.(2023·湖南卷)超纯是制备第三代半导体的支撑源材料之一,近年来,我国科技工作者开发了超纯纯化、超纯分析和超纯灌装一系列高新技术,在研制超纯方面取得了显著成果,工业上以粗镓为原料,制备超纯的工艺流程如下:
已知:①金属的化学性质和相似,的熔点为;
②(乙醚)和(三正辛胺)在上述流程中可作为配体;
③相关物质的沸点:
物质
沸点/
55.7
34.6
42.4
365.8
回答下列问题:
(1)晶体的晶体类型是_______;
(2)“电解精炼”装置如图所示,电解池温度控制在的原因是_______,阴极的电极反应式为_______;
(3)“合成”工序中的产物还包括和,写出该反应的化学方程式:_______;
(4)“残渣”经纯水处理,能产生可燃性气体,该气体主要成分是_______;
(5)下列说法错误的是_______;
A.流程中得到了循环利用
B.流程中,“合成”至“工序X”需在无水无氧的条件下进行
C.“工序X”的作用是解配,并蒸出
D.用核磁共振氢谱不能区分和
(6)直接分解不能制备超纯,而本流程采用“配体交换”工艺制备超纯的理由是_______;
(7)比较分子中的键角大小:_______(填“>”“<”或“=”),其原因是_______。
8.(2023·辽宁卷)某工厂采用如下工艺处理镍钴矿硫酸浸取液含(和)。实现镍、钴、镁元素的回收。
已知:
物质
回答下列问题:
(1)用硫酸浸取镍钴矿时,提高浸取速率的方法为_______(答出一条即可)。
(2)“氧化”中,混合气在金属离子的催化作用下产生具有强氧化性的过一硫酸,中过氧键的数目为_______。
(3)“氧化”中,用石灰乳调节,被氧化为,该反应的离子方程式为_______(的电离第一步完全,第二步微弱);滤渣的成分为、_______(填化学式)。
(4)“氧化”中保持空气通入速率不变,(Ⅱ)氧化率与时间的关系如下。体积分数为_______时,(Ⅱ)氧化速率最大;继续增大体积分数时,(Ⅱ)氧化速率减小的原因是_______。
(5)“沉钴镍”中得到的(Ⅱ)在空气中可被氧化成,该反应的化学方程式为_______。
(6)“沉镁”中为使沉淀完全,需控制不低于_______(精确至0.1)。
1.(2023·陕西安康·统考三模)以菱锌矿(主要含有ZnCO3,另含有少量CaO、Fe2O3、FeO、CoO、CuO、SiO2等)为原料电解制Zn的流程如图:
相关难溶物溶度积常数如下表:
物质
Fe(OH)3
Zn(OH)2
MgF2
CaF2
Ksp
2.7×10−39
1.3× 10−17
5.2×10−11
3.9×10−9
(1)“酸浸”时为提高锌的浸出率,可采取的措施有___________(写出一种即可)。
(2)“调pH过滤”中,物质X最适宜选择___________(填标号)。
A.NaOH B.Ca(OH)2 C.NH3·H2O
(3)“氧化过滤”中,Fe2+转化为Fe(OH)3的离子方程式为___________。若反应结束时,溶液pH为5,则残留的c(Fe3+)=___________mol·L−1。
(4)H2O2是常见的氧化剂,其电子式为___________, “氧化过滤”时H2O2需稍多加,其原因是_______。
(5)“脱钙镁过滤”后,溶液中=___________。
(6)“电解”装置示意如图。
开始通电时,阳极表面形成PbO2,保护阳极不被酸性电解液腐蚀,相应的电极反应式为___________。
2.(2023·江西景德镇·统考三模)工业上以铬铁矿(FeO·Cr2O3,含Al2O3、SiO2等杂质)为主要原料制备红矾钠的工艺流程以及可溶性组分物质的量浓度c与pH的关系分别如图a、b。当c≦1.0×10-5mol·L-1时,可认为已除尽。回答下列问题:
(1)焙烧时将矿料磨碎且气体与矿料逆流而行,其目的是___________。
(2)焙烧的目的是将FeO·Cr2O3转化为Na2CrO4并将Al、Si氧化物转化为可溶性钠盐,写出焙烧时FeO·Cr2O3发生的化学方程式___________。
(3)中和时pH的理论范围为___________;酸化的目的是___________。
(4)副产品主要是___________。
(5)此方法生产过程中会产生大量含的酸性废水,可以用如图c装置处理。向废水中加入适量的NaCl进行电解,被还原为Cr3+然后生成Cr(OH)3沉淀除去,废水则可以达到排放标准。已知Ksp(Cr(OH)3)=1.0×10-32;写出阳极的电极方程式:___________;若电解一段时间后,调节pH测得溶液中c(Fe3+)=1.0×10-12mol·L-1,则此时c(Cr3+)=___________mol·L-1。
3.(2023·辽宁本溪·本溪高中校考模拟预测)对废催化剂进行回收可有效利用金属资源。某废催化剂主要含铝()、钼()、镍()等元素的氧化物,一种回收利用工艺的部分流程如下:
已知:该工艺中,时,溶液中元素以的形态存在。
(1)“焙烧”中,有生成,其中元素的化合价为___________。
(2)“沉铝”中,生成的沉淀X的离子方程式___________。
(3)“沉钼”中,为7.0。生成的离子方程式为___________。
(4)①滤液Ⅲ中,主要存在的钠盐有和Y,Y为___________(填化学式)。
②往滤液Ⅲ中添加适量固体后,通入足量___________(填化学式)气体,再通入足量,可析出Y。
(5)高纯(砷化铝)可用于芯片制造。芯片制造中的一种刻蚀过程如图所示,图中所示致密保护膜为一种氧化物,可阻止刻蚀液与下层(砷化镓)反应。
①该氧化物为___________。
②已知:和同族,和同族。在与上层的反应中,元素的化合价变为+5价,则该反应的氧化剂与还原剂物质的量之比为___________。
4.(2023·福建·校联考三模)金属镓被称为“电子工业脊梁”,与铝同族,性质与铝相似。氮化镓是5G技术中广泛应用的新型半导体材料。利用粉煤灰(主要成分为、、,还有少量等杂质)制备镓和氮化镓的流程如下:
常温下,相关元素可溶性组分的物质的量浓度的对数与pH的关系如下图所示,当溶液中可溶性组分浓度时,可认为已除尽。
回答下列问题:
(1)“焙烧”过程中变为,则与纯碱反应的化学方程式为____________。
(2)“碱浸”后滤渣的主要成分为___________(写化学式)。用惰性电极电解含的溶液可得到金属Ga,阴极的电极反应式为___________。
(3)常温下,反应的平衡常数_________。
(4)“碱浸”后溶液的主要成分为、、。请补充完整流程中“操作”过程的步骤(在方框内填入试剂的化学式或pH值):
滤液滤液滤渣 溶液
_______,_______,_______。
(实验中须使用的试剂:0.1 溶液、0.1 NaOH溶液)
(5)用石墨为电极电解熔融得到Ga单质,电极材料需要定期补充的是___________极(填“阴”或“阳”)。
5.(2023·重庆万州·重庆市万州第二高级中学校考模拟预测)富硼渣中含有镁硼酸盐(2MgO·B2O3)、镁硅酸盐(2MgO·SiO2)及少量Al2O3、FeO等杂质。由富硼渣湿法制备硫酸镁晶体和硼酸(H3BO3)晶体的一种工艺流程如下:
已知生成相应氢氧化物沉淀的pH(金属离子的起始浓度为0.1mol/L)如下:
Fe(OH)3
Al(OH)3
Fe(OH)2
Mg(OH)2
开始沉淀时
1.9
3.4
7.0
9.1
完全沉定时
3.2
4.7
9.0
11.1
(1)酸浸时发生反应:2MgO·SiO2+2H2SO4=2MgSO4+SiO2+2H2O,2MgO·B2O3+2H2SO4=2H3BO3+2MgSO4。
①根据上述反应可知,酸性:H2SO4___________(填“>”或“<”)H3BO3。
②已知硼酸与过量NaOH溶液发生中和反应的离子方程式为:H3BO3+OH-=。下列关于硼酸的说法正确的是___________(填字母)
A.硼酸是一元酸
B.向NaHCO3固体中滴加饱和硼酸溶液,有气泡产生
C.硼酸的电离方程式可表示为H3BO3+H2O+H+
(2)检验褐色浸出液中的杂质离子:取少量浸出液,___________(填操作和现象),证明溶液中含有Fe2+。
(3)除去浸出液中的杂质离子:用MgO调节溶液的pH至___________以上,使杂质离子转化为___________(填化学式)沉淀,过滤。
(4)获取晶体:
ⅰ.浓缩滤液,使MgSO4溶液和H3BO3溶液接近饱和;
ⅱ.控制温度使两种晶体分别从溶液中结晶。结合图中溶解度曲线,简述ⅱ的方法:将浓缩液加入高压釜中升温结晶得到___________晶体,分离后,再将母液降温结晶,分离得到另一种物质的晶体。
6.(2023·四川攀枝花·统考三模)从铜电解液分离出的粗硫酸镍晶体中含有大量的杂质元素(Cu、Fe、As、Ca、Zn等),我国科学家对粗硫酸镍进行精制提纯,其工艺流程如下。
已知:i.含镍溶液中的主要离子有:Ni2+、、Cu2+、Fe2+、、Ca2+和Zn2+
ii.部分物质的电离常数和溶度积常数如下表
物质
电离常数
物质
溶度积常数
物质
溶度积常数
H2S
Ka1=1.1×10-7
Ka2=1.3×10-13
CuS
6.3×10-36
CaF2
4.0×10-11
NiS
3.2×10-19
NiF2
2.6×10-4
FeS
6.3×10-18
Fe(OH)3
2.8×10-39
Ni(OH)2
5.5×10-16
回答下列问题:
(1)将粗硫酸镍溶液的pH调小至0.5,加入的试剂是___________。
(2)滤渣1中除CuS外,还含有As2S3和S。反应生成As2S3和S的离子方程式是________。
(3)解释“氧化除杂”时,加入Cl2和Ni(OH)2能析出Fe(OH)3的原因___________。
(4)用沉淀溶解平衡原理解释用NiF2能够“氟化除杂”的原因___________。
(5)结合下图分析,“P204萃取”时,应调整水溶液的pH为___________(填选项字母)。
A.1.2 B.2.1 C.3.3 D.4.5
(6)“硫化除杂”之后,若溶液pH=0.5,溶液中c(H2S)=0.1mol/L,理论上溶液中c(Cu2+)=_______mol/L[计算结果保留两位有效数字]。
(7)精制硫酸镍溶液得到硫酸镍晶体后,一种综合利用“母液”的方法是:___________。
7.(2023·湖南岳阳·统考模拟预测)ZnO在化学工业中主要用作橡胶和颜料的添加剂,医药上用于制软膏、橡皮膏等。工业上可由菱锌矿[主要成分为ZnCO3,还含有Cd(II)、Fe(II)、 Mn[(II)等杂质]制备。工艺如图所示:
相关金属离子[c(Mn+ )=0.1 mol·L-1]形成氢氧化物沉淀的pH范围如表:
金属离子
Fe3+
Fe2+
Zn2+
Cd2+
Mn2+
开始沉淀的pH
1.5
6.3
6.2
7.4
8.1
沉淀完全的pH
2.8
8.3
8.2
9.4
10.1
已知:①“溶浸”后的溶液中金属离子主要有: Zn2+、 Fe2+、 Cd2+、 Mn2+。
②弱酸性溶液中KMnO4能将Mn2+氧化生成MnO2。
回答下列问题:
(1)“溶浸”过程中,提高浸出率的措施有_______ 。(写一条即可)
(2)“调pH”是将“溶浸”后的溶液调节至弱酸性(pH约为5),若pH过低,对除杂的影响是_______。
(3)加KMnO4“氧化除杂”发生反应的离子方程式分别是2MnO+3Mn2++2H2O=5MnO2↓+4H+和_____
(4)“还原除杂”中镉置换率与的关系如图所示,其中Zn的理论用量以溶液中Cd2+的量为依据。
若需置换出112.0kgCd,且使镉置换率达到98%,实际加入的Zn应为_______ kg。
(5)“沉锌”生成碱式碳酸锌[ZnCO3·2Zn(OH)2·2H2O]沉淀,写出加入Na2CO3溶液沉锌的化学方程式_______。形成的沉淀要用水洗,检查沉淀是否洗涤干净的方法是_______。
(6)ZnO可与NH3·H2O、NH4HCO3反应生成可溶性的[Zn (NH3)n]CO3和H2O。若有1molZnO溶解,则在该转化反应中参加反应的NH3·H2O和NH4HCO3物质的量之比的最大值为_______(已知: 1≤n≤4 )。
8.(2023·河南·校联考三模)铝酸铋[Bi(AlO2)3]主要用作抗酸药及抗溃疡药,具有中和胃酸和收敛作用。以辉铋矿(主要成分为Bi2S3,含有SiO2、Cu2S、FeS2杂质)为原料制备铝酸铋的一种工艺流程如图所示:
已知:①常温下,Cu(OH)2、Fe(OH)2、Fe(OH)3和Bi(OH)3的Ksp分别为2.0×10-20、4.0×10-16、.4.0×10-38和8.0×10-31,lg2=0.3。
②Cu(OH)2能溶于氨水生成[Cu(NH3)4]2+。
③Sn2+和Sn4+在碱性溶液中分别以[Sn(OH)4]2-和[Sn(OH)6]2-的形式存在。
请回答下列问题:
(1)铋与氮同主族,铋元素在元素周期表中的位置是___________。
(2)滤渣1中除了硫单质,还含另一种物质,30g该物质中含共价键的数目是___________,FeCl3与Cu2S反应中氧化剂与还原剂的物质的量之比为___________。
(3)“还原”时,加入铋的目的是___________。
(4)“沉淀”前,若滤液中Cu2+浓度为0.005mol·L-1,Fe2+浓度为0.01mol·L-1,则“沉淀”时调pH的最大值应小于___________。
(5)在碱性溶液中,可用[Sn(OH)4]2-鉴定Bi3+存在,Bi3+被还原为Bi写出该反应的离子方程式:___________。
(6)在氢氧化钠溶液中,次氯酸钠能将Bi(OH)3氧化为NaBiO3,写出该反应的化学方程式:___________。
专题13 化学实验综合题- 2023年高考真题和模拟题化学分项汇编(全国通用): 这是一份专题13 化学实验综合题- 2023年高考真题和模拟题化学分项汇编(全国通用),文件包含专题13化学实验综合题解析版docx、专题13化学实验综合题学生版docx等2份试卷配套教学资源,其中试卷共48页, 欢迎下载使用。
专题12 工艺流程综合题- 2023年高考真题和模拟题化学分项汇编(全国通用): 这是一份专题12 工艺流程综合题- 2023年高考真题和模拟题化学分项汇编(全国通用),文件包含专题12工艺流程综合题解析版docx、专题12工艺流程综合题学生版docx等2份试卷配套教学资源,其中试卷共42页, 欢迎下载使用。
2023年高考真题和模拟题化学分项汇编(全国通用)专题13+化学实验综合题: 这是一份2023年高考真题和模拟题化学分项汇编(全国通用)专题13+化学实验综合题,文件包含专题13化学实验综合题解析版docx、专题13化学实验综合题原卷版docx等2份试卷配套教学资源,其中试卷共45页, 欢迎下载使用。












