
高考化学一轮复习讲练 第5章 专题突破20 寻找“等电子”微粒的思维方法及应用 (含解析)
展开专题突破20 寻找“等电子”微粒的思维方法及应用
1.寻找“10电子”微粒和“18电子”微粒的方法
(1)“10电子”微粒
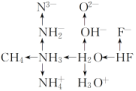
![]()
(2)“18电子”微粒
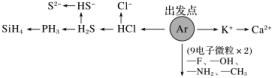
CH3—CH3、H2N—NH2、HO—OH、F—F、F—CH3、CH3—OH……
2.记忆其他等电子微粒
(1)“14电子”微粒:Si、N2、CO、C2H2、C。
(2)“16电子”微粒:S、O2、C2H4、HCHO。
3.质子数和核外电子数分别相等的两种微粒关系
(1)可以是两种原子,如同位素原子。
(2)可以是两种分子,如CH4、NH3等。
(3)可以是两种带电荷数相同的阳离子,如NH、H3O+。
(4)可以是两种带电荷数相同的阴离子,如OH-、F-。
![]()
1.(2020·淮南期末)下列离子化合物中,阴、阳离子的电子层结构相同的是( )
A.NaCl B.LiCl C.MgO D.Na2S
答案 C
解析 A项,NaCl中钠离子核外有10个电子、氯离子核外有18个电子,氯离子电子层比钠离子多一个,电子层结构不同,错误;B项,LiCl中锂离子核外有2个电子、氯离子核外有18个电子,氯离子电子层比锂离子多2个,电子层结构不同,错误;C项,氧化镁中氧离子和镁离子核外电子数都是10,其阴阳离子电子层结构相同,正确;D项,Na2S中钠离子核外有10个电子、硫离子核外有18个电子,硫离子比钠离子多1个电子层,电子层结构不同,错误。
2.用A+、B-、C2-、D、E、F、G和H分别表示含有18个电子的八种微粒(离子或分子),请回答:
(1)A元素是______________、B元素是________________________________________、
C元素是________(用元素符号表示)。
(2)D是由两种元素组成的双原子分子,其分子式为______________________________。
(3)E是所有含18个电子的微粒中氧化能力最强的分子,其分子式为________。
(4)F是由两种元素组成的三原子分子,其分子式为_____________________________。
(5)G分子中含有4个原子,其分子式是________。
(6)H分子中含有8个原子,其分子式是________。
答案 (1)K Cl S (2)HCl (3)F2 (4)H2S
(5)H2O2(或PH3) (6)C2H6
解析 (1)因A+、B-、C2-都含有18个电子,故A为钾(K)元素、B为氯(Cl)元素、C为硫(S)元素。
(2)D是由两种元素组成的双原子分子,则其分子式应为HCl。
(3)因为E是所有含18个电子微粒中氧化能力最强的分子,根据元素周期律知识知E应是氟气(F2)。
(4)F是由两种元素组成的三原子分子,其分子式为H2S。
(5)G分子中含有4个原子,其分子式为PH3或H2O2。
(6)H分子中含有8个原子,其分子式为C2H6。
3.已知A、B、C、D是中学化学中常见的四种不同粒子,它们之间存在如图所示的转化关系(反应条件已经略去):
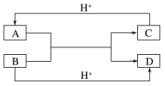
(1)如果A、B、C、D均是10电子的粒子,请写出A、D的电子式:A____________;D____________。
(2)如果A和C是18电子的粒子,B和D是10电子的粒子,请写出:
①A与B在溶液中反应的离子方程式为____________________________________________。
②根据上述离子方程式,可以判断C与B结合质子的能力大小是______________________(用化学式或离子符号表示)。
答案 (1)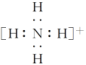 (或
(或![]() )
) ![]()
(2)①HS-+OH-===S2-+H2O ②OH->S2-
高考化学一轮复习讲练 第12章 专题突破38 晶胞参数、坐标参数的分析与应用 (含解析): 这是一份高考化学一轮复习讲练 第12章 专题突破38 晶胞参数、坐标参数的分析与应用 (含解析),共5页。试卷主要包含了晶胞有两个基本要素,铜与氧元素形成的晶胞如下图所示等内容,欢迎下载使用。
高考化学一轮复习讲练 第11章 专题突破35 卤代烃在有机合成中的应用 (含解析): 这是一份高考化学一轮复习讲练 第11章 专题突破35 卤代烃在有机合成中的应用 (含解析),共4页。试卷主要包含了连接烃和烃的衍生物的桥梁,改变官能团的个数,改变官能团的位置,对官能团进行保护等内容,欢迎下载使用。
高考化学一轮复习讲练 第11章 专题突破34 有序思维突破同分异构体的书写及数目判断 (含解析): 这是一份高考化学一轮复习讲练 第11章 专题突破34 有序思维突破同分异构体的书写及数目判断 (含解析),共4页。试卷主要包含了同分异构体的书写规律,同分异构体数目的判断方法等内容,欢迎下载使用。












