

【暑假初升高】人教版化学初三(升高一)暑假预习-第04讲 氧化还原反应——概念及电子转移表示 讲学案
展开第04讲 氧化还原反应——概念及电子转移表示
【学习目标】
1.认识有化合价变化的反应是氧化还原反应,知道氧化反应、还原反应,氧化剂及还原剂的概念。
2.能从电子得失或电子对偏移的角度理解氧化还原反应的本质,学会用双线桥及单线桥表示电子转移的方向和数目。
3.能利用氧化还原反应概念对常见的反应进行分类和分析说明。
【基础知识】
刚泡的绿茶
放置一段时间后后
刚切的苹果
放置一段时间后后
月饼小包装中的脱氧剂
上述现象中,有的物质发生了氧化还原反应。
历史上氧化还原反应概念主要经历了三个阶段:
拉瓦锡
弗兰克兰
丹尼尔
汤姆生
1 777年,拉瓦锡发现了氧气,人们把物质和氧气的反应叫氧化反应,后来进一步把物质结合氧元素的反应也叫氧化反应;十九世纪随着工业发展,需要大量的金属,而金属多数以矿物存在,需把矿物中氧化物中的金属提炼出来即发生了还原,人们把物质失去氧元素的反应叫还原反应;1 852年,弗兰克兰根据其研究,从化合价升降的外部特征,定义了氧化还原反应;1 836年丹尼尔发明商用的原电池,1 897年汤姆生发现了电子,科学家从电子转移的本质,定义了氧化还原反应。
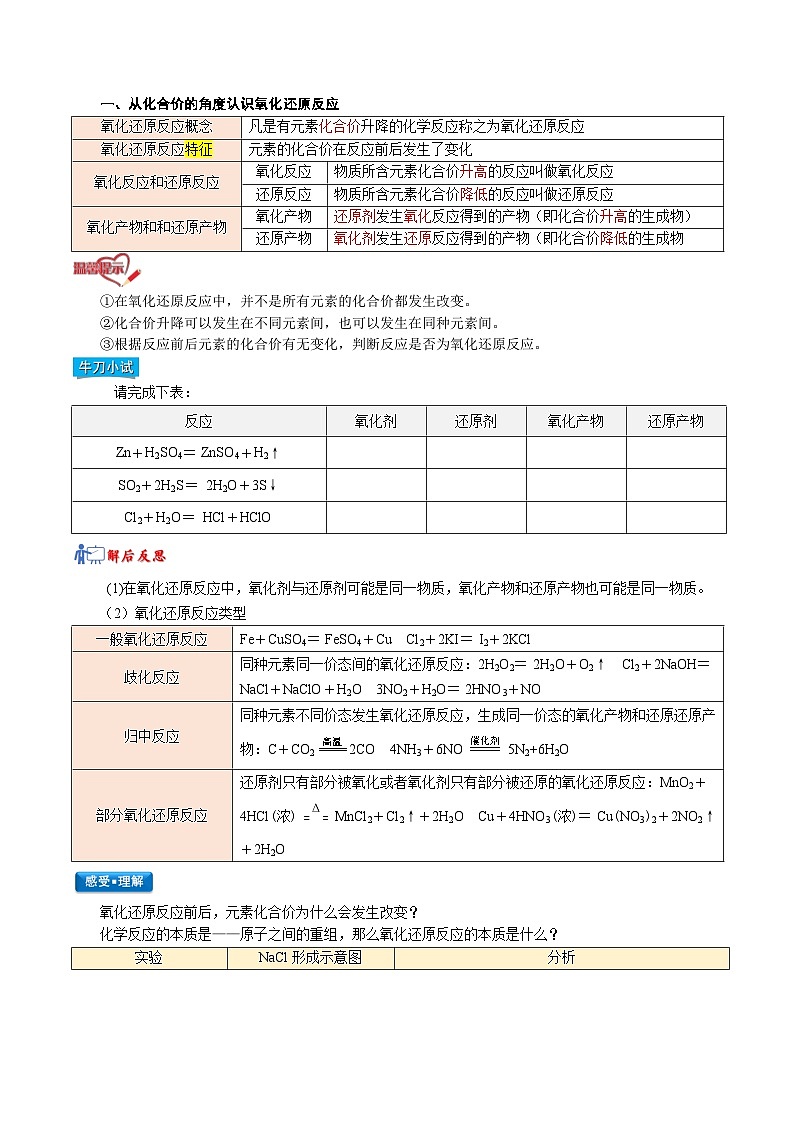
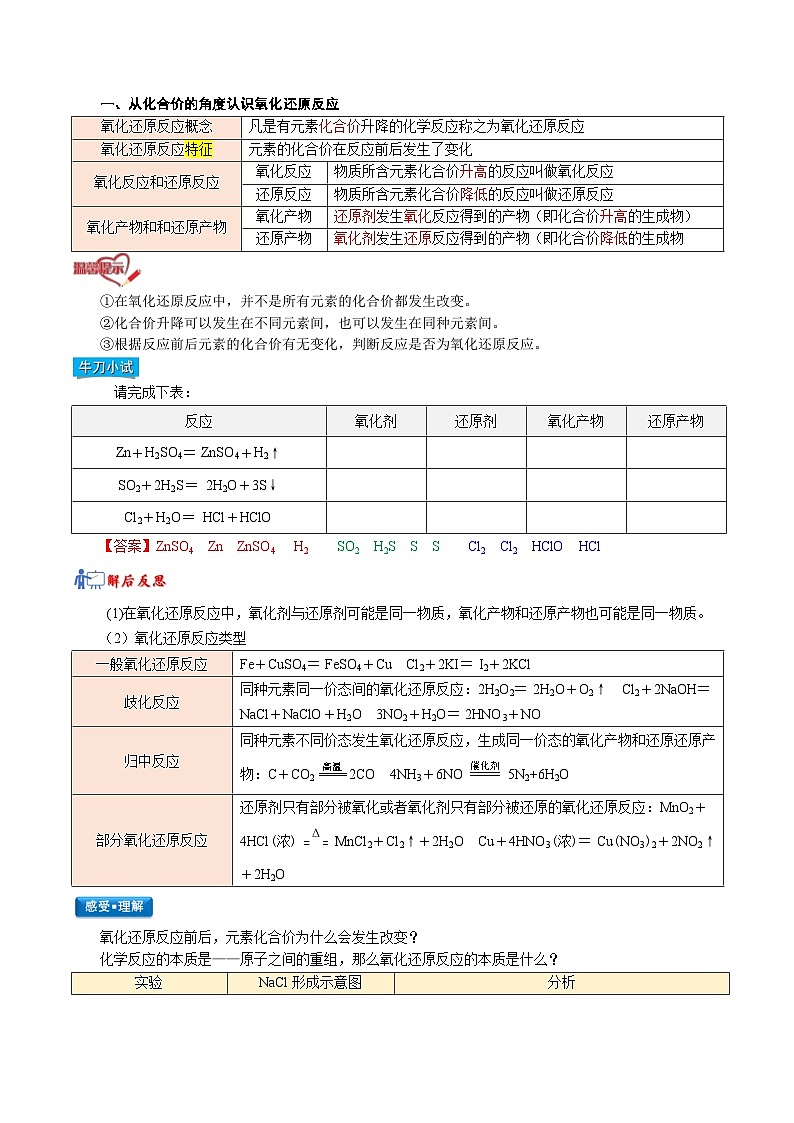
一、从化合价的角度认识氧化还原反应
氧化还原反应概念
凡是有元素化合价升降的化学反应称之为氧化还原反应
氧化还原反应特征
元素的化合价在反应前后发生了变化
氧化反应和还原反应
氧化反应
物质所含元素化合价升高的反应叫做氧化反应
还原反应
物质所含元素化合价降低的反应叫做还原反应
氧化产物和和还原产物
氧化产物
还原剂发生氧化反应得到的产物(即化合价升高的生成物)
还原产物
氧化剂发生还原反应得到的产物(即化合价降低的生成物
①在氧化还原反应中,并不是所有元素的化合价都发生改变。
②化合价升降可以发生在不同元素间,也可以发生在同种元素间。
③根据反应前后元素的化合价有无变化,判断反应是否为氧化还原反应。
请完成下表:
反应
氧化剂
还原剂
氧化产物
还原产物
Zn+H2SO4=ZnSO4+H2↑
SO2+2H2S=2H2O+3S↓
Cl2+H2O=HCl+HClO
【答案】ZnSO4 Zn ZnSO4 H2 SO2 H2S S S Cl2 Cl2 HClO HCl
(1)在氧化还原反应中,氧化剂与还原剂可能是同一物质,氧化产物和还原产物也可能是同一物质。
(2)氧化还原反应类型
一般氧化还原反应
Fe+CuSO4=FeSO4+Cu Cl2+2KI=I2+2KCl
歧化反应
同种元素同一价态间的氧化还原反应:2H2O2=2H2O+O2↑ Cl2+2NaOH=NaCl+NaClO+H2O 3NO2+H2O=2HNO3+NO
归中反应
同种元素不同价态发生氧化还原反应,生成同一价态的氧化产物和还原还原产物:C+CO22CO 4NH3+6NO5N2+6H2O
部分氧化还原反应
还原剂只有部分被氧化或者氧化剂只有部分被还原的氧化还原反应:MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O
氧化还原反应前后,元素化合价为什么会发生改变?
化学反应的本质是——原子之间的重组,那么氧化还原反应的本质是什么?
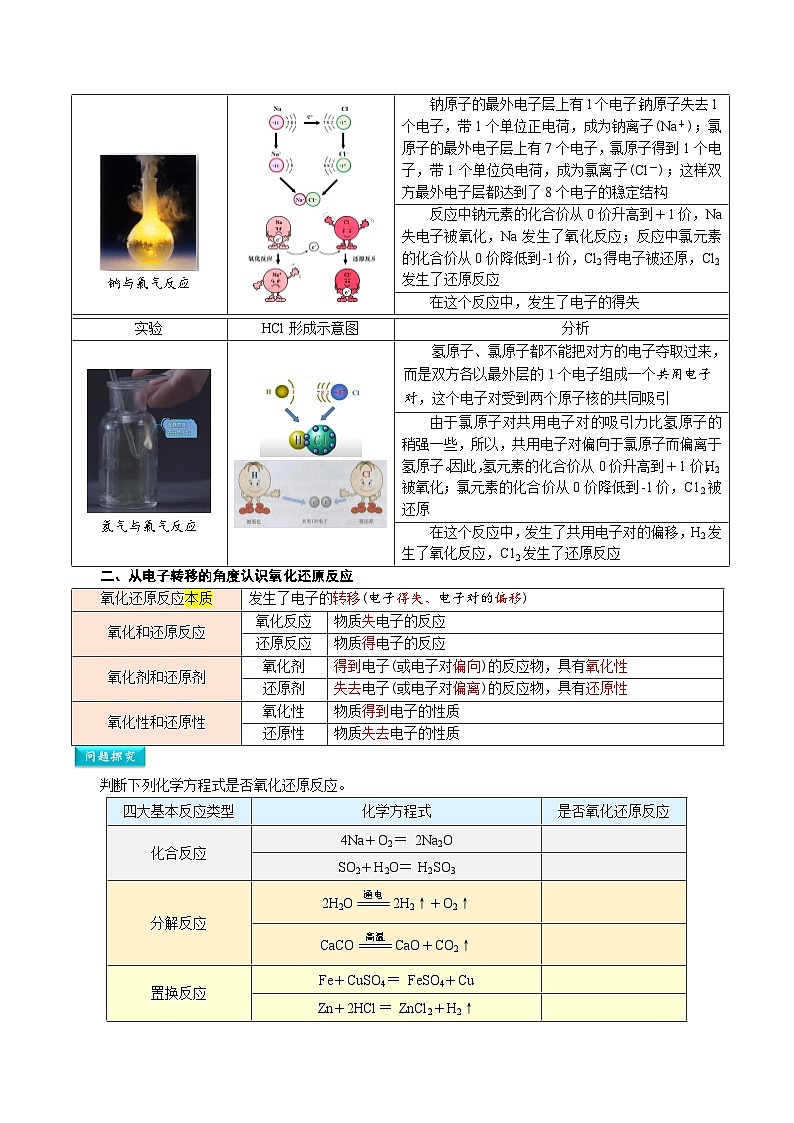
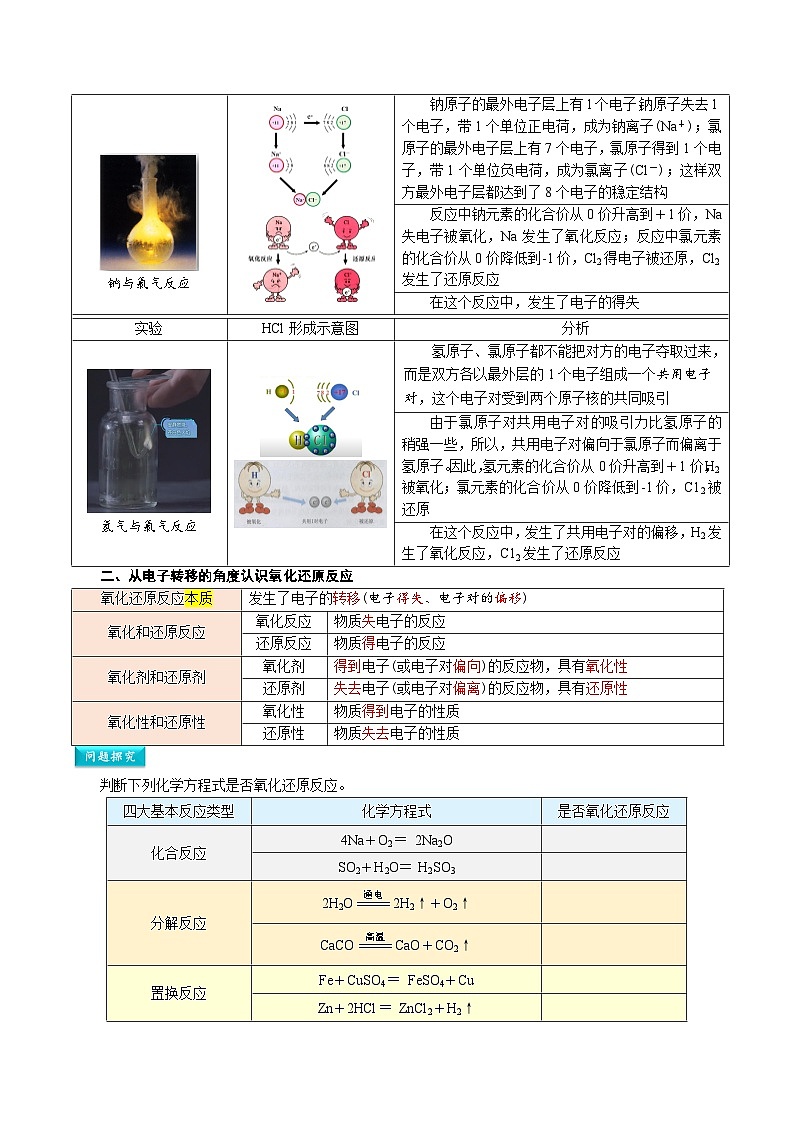
实验
NaCl形成示意图
分析
钠与氯气反应
钠原子的最外电子层上有1个电子,钠原子失去1个电子,带1个单位正电荷,成为钠离子(Na+);氯原子的最外电子层上有7个电子,氯原子得到1个电子,带1个单位负电荷,成为氯离子(Cl-);这样双方最外电子层都达到了8个电子的稳定结构
反应中钠元素的化合价从0价升高到+1价,Na失电子被氧化,Na发生了氧化反应;反应中氯元素的化合价从0价降低到-1价,Cl2得电子被还原,Cl2发生了还原反应
在这个反应中,发生了电子的得失
实验
HCl形成示意图
分析
氢气与氯气反应
氢原子、氯原子都不能把对方的电子夺取过来,而是双方各以最外层的1个电子组成一个共用电子对,这个电子对受到两个原子核的共同吸引
由于氯原子对共用电子对的吸引力比氢原子的稍强一些,所以,共用电子对偏向于氯原子而偏离于氢原子。因此,氢元素的化合价从0价升高到+1价,H2被氧化;氯元素的化合价从0价降低到-1价,C12被还原
在这个反应中,发生了共用电子对的偏移,H2发生了氧化反应,C12发生了还原反应
二、从电子转移的角度认识氧化还原反应
氧化还原反应本质
发生了电子的转移(电子得失、电子对的偏移)
氧化和还原反应
氧化反应
物质失电子的反应
还原反应
物质得电子的反应
氧化剂和还原剂
氧化剂
得到电子(或电子对偏向)的反应物,具有氧化性
还原剂
失去电子(或电子对偏离)的反应物,具有还原性
氧化性和还原性
氧化性
物质得到电子的性质
还原性
物质失去电子的性质
判断下列化学方程式是否氧化还原反应。
四大基本反应类型
化学方程式
是否氧化还原反应
化合反应
4Na+O2=2Na2O
SO2+H2O=H2SO3
分解反应
2H2O2H2↑+O2↑
CaCOCaO+CO2↑
置换反应
Fe+CuSO4=FeSO4+Cu
Zn+2HCl=ZnCl2+H2↑
复分解反应
NaOH+HCl=NaCl+H2O
BaCl2+Na2SO4=BaSO4↓+2NaCl
【答案】√、× √、× √、√ ×、×
三、氧化还原反应与四种基本反应类型的关系
有单质参加或生成的反应不一定是氧化还原反应,如:C(石墨)C(金刚石),无化合价变化,不属于氧化还原反应。
反应
装置
操作
现象
结论
Zn+H2SO4=ZnSO4+H2↑
盛有稀硫酸的烧杯中,插入锌片和铜片;将锌片与电流计的负极相连,铜片与电流计的正极相连
电流计的指针发生偏转
反应中有电子转移
氧化还原反应中确实有电子发生了转移,如何来表示呢?
四、氧化还原反应中电子转移的表示方法
1.双线桥法
表示反应前后同一元素由反应物转化为生成物时电子转移的情况——表示谁变谁。
(1)画法——三步骤
(2)通式
①箭头必须由反应物指向生成物中的同种元素。
②在“桥”上标明电子“得到”与“失去”,且得到与失去的电子总数必须相等。
③采用“a×be-”形式表示得失电子数,a为得失电子的原子总数,b为每个原子得失电子数,当a或b是“1”时省略“1”。
2.单线桥法
表示反应过程中不同元素原子间的电子转移情况——表示谁给谁。
(1)画法——三步骤
(2)通式
①单线桥从还原剂中失电子的元素指向氧化剂中得电子的元素,表示氧化剂和还原剂中变价元素原子间电子的转移情况。
②箭头已标明电子转移的方向,因此不需再标明“得”或“失”,只标明电子转移数目。
氧化还原反应的相关概念及其关系
【考点剖析】
考点一:氧化还原反应的判断
例1.(2022年江苏省扬州市邗江区期中)下列反应既是化合反应,又是氧化还原反应的是
A.2CO+O22CO2 B.CaO+H2O=Ca(OH)2
C.C+H2OCO+H2 D.CO2+Ca(OH)2=CaCO3↓+H2O
【答案】A
【解析】A项,2CO+O22CO2是化合反应,反应中C、O元素的化合价发生了变化,是氧化还原反应,正确;B项,CaO+H2O=Ca(OH)2是化合反应,反应中各元素的化合价未发生变化,不属于氧化还原反应,错误;C项,C+H2OCO+H2属于置换反应,反应中C、O元素的化合价在反应前后发生变化,属于氧化还原反应,错误;D项,CO2+Ca(OH)2=CaCO3↓+H2O不属于基本反应类型,反应中反应前后各元素的化合价都没有发生变化,不属于氧化还原反应,错误。
考点二:氧化还原反应中的概念辨析
例2.(2022年湖北省孝感市期中)下列有关氧化还原反应的叙述不正确的是
A.在氧化还原反应中肯定有一种元素被氧化,另一种元素被还原
B.在氧化还原反应中,失去电子的物质中一定有元素化合价升高
C.氧化还原反应的本质是电子的转移
D.在氧化还原反应中不一定所有元素的化合价都发生变化
【答案】A
【解析】A项,在氧化还原反应中,也存在同一种元素既可被氧化,又可被还原,如2H2O2=2H2O+O2↑中,过氧化氢即表现氧化性,也表现还原性,错误;B项,在氧化还原反应中,失去电子元素化合价升高,发生氧化反应,正确;C项,氧化还原反应过程中有电子的得失或共用电子对的偏移,因此本质是电子的转移,正确;D项,在氧化还原反应中一定有元素的化合价发生变化,但不一定是所有元素的化合价都发生变化,正确。
考点三:氧化还原转化中所需物质的判断
例3.(2022年江苏省徐州市第七中学期中)下列转化中,需要加入氧化剂才能实现的是
A.I2→I- B.HCO3-→CO2
C.Fe2+→Fe3+ D.MnO4-→MnO2
【答案】C
【解析】A项,I2→I-,I化合价由0价→-1价,化合价降低,被还原,需要加还原剂,不符合题意;B项,HCO3-→CO2,化合价不变,不需要加氧化剂,不符合题意;C项,Fe2+→Fe3+,Fe化合价由+2→+3,化合价升高,被氧化,需要加氧化剂,符合题意;D项,MnO4-→MnO2,Mn的化合价由+7→+4,化合价降低,被还原,需加还原剂,不符合题意。
考点四:基本反应类型与氧化还原反应的关系
例4.(2022年河北省唐山市遵化市期中)氧化还原反应与四种基本反应类型的关系如图所示。下列化学反应中属于阴影部分的是
A.4NH3+5O2=4NO+6H2O B.4Fe(OH)2+O2+2H2O=4Fe(OH)3
C.2NaHCO3=Na2CO3+H2O+CO2↑ D.Cl2+2NaBr=2NaCl+Br2
【答案】A
【解析】由图中阴影位置可知,阴影部分属于氧化还原反应,但不是置换反应、化合反应、也不是分解反应。
A项,4NH3+5O2=4NO+6H2O反应中N、O元素的化合价发生变化,为氧化还原反应,生成物中没有单质,不属于置换反应,反应物有2种,不属于分解反应,生成物有2种,不属于化合反应,符合题意;B项,4Fe(OH)2+O2+2H2O=4Fe(OH)3反应中Fe、O元素的化合价发生变化,为氧化还原反应,但该反应为化合反应,不符合题意;C项,2NaHCO3=Na2CO3+H2O+CO2↑反应中没有元素的化合价发生变化,不属于氧化还原反应,不符合题意;D项,Cl2+2NaBr=2NaCl+Br2反应中Cl、Br元素的化合价发生变化,为氧化还原反应,但该反应属于置换反应,不符合题意。
考点五:画双线桥与单线桥
例5.(2022年江苏省扬州市邗江区期中节选)“中国芯”的主要原料是高纯单晶硅,反应SiCl4(g)+2H2(g)Si(s)+4HCl(g)可用于纯硅的制备。
(1)反应物SiCl4中硅的化合价是___________,被氧化的元素是___________(写元素名称)。
(2)用双线桥法表示该反应电子转移的方向和数目:SiCl4(g)+2H2(g)Si(s)+4HCl(g)
________________________________________。
【答案】(1)+4 氢元素 (2)
【解析】(1)反应物SiCl4中Cl的化合价为-1,硅的化合价是+4。氢元素化合价由0价升高到+1价,被氧化;(2)氢元素化合价由0价升高到+1价,失去4e-;Si元素化合价由+4价降到0价,得到4e-,故为。
考点六:氧化还原反应综合训练
例6.(2022年北京市房山区期中)纳米级Fe3O4可用于以太阳能为能源分解水制H2,过程如下图所示。下列说法中,不正确的是
A.过程I的反应:2Fe3O46FeO+O2↑
B.过程II的反应:2H2O2H2↑+O2↑
C.两个转化过程都发生了氧化还原反应
D.整个过程实现了太阳能向化学能的转化
【答案】B
【解析】A项,根据图知,过程I在太阳能的作用下Fe3O4分解生成FeO和O2,则反应方程式为2Fe3O46FeO+O2↑,正确;B项,过程II中FeO与水反应生成H2和Fe3O4,反应方程式为3FeO+H2O=H2↑+Fe3O4,错误;C项,第一个反应中部分Fe元素化合价由+3价变为+2价、O元素化合价由-2价变为0价,第二个方程式中部分Fe元素化合价由+2价变为+3价、H元素化合价由+1价变为0价,这两个反应中都有元素化合价升降,所以这两个转化过程都发生了氧化还原反应,正确;D项,过程I方程式为:2Fe3O46FeO+O2↑;过程II方程式为:3FeO+H2O=H2↑+Fe3O4,将I+II×2,整理可得:2H2O=2H2↑+O2↑,在整个过程实现了太阳能向化学能的转化,Fe3O4为整个过程的催化剂,正确。
【真题演练】
1.(2022年江苏省苏州市期中)下列反应不属于四种基本反应类型,但属于氧化还原反应的是
A.Fe+CuSO4=FeSO4+Cu
B.Na2CO3+BaCl2=BaCO3↓+2NaCl
C.Fe2O3+3CO2Fe+3CO2
D.2H2O22H2O+O2↑
【答案】C
【解析】A项,该反应为置换反应,属于四种基本反应类型,错误;B项,该反应为复分解反应,属于四种基本反应类型,错误;C项,不反应不属于四种基本反应类型,且存在Fe、C元素化合价变化,属于氧化还原反应,正确;D项,该反应为分解反应,属于四种基本反应类型,错误。
2.(2022年江苏省宿迁市沭阳县期中)下列变化中需要加入氧化剂才能实现的是。
A.2H+―→H2 B.Fe3+―→Fe2+
C.H2S―→SO2 D.CO32-―→CO2
【答案】C
【解析】A项,2H+―→H2,氢元素化合价由+1→0,化合价降低,应加入还原剂,错误;B项,Fe3+―→Fe2+,铁元素化合价由+3→+2,化合价降低,应加入还原剂,错误;C项,H2S―→SO2,硫元素化合价由-2价升高到+4价,应加入氧化剂,正确;D项,CO32-―→CO2碳元素化合价无变化,错误。
3.(2022年江苏省徐州市第七中学期中)化学与生活、社会发展息息相关,下列有关说法不正确的是
A.“青蒿一握,以水二升渍,绞取汁”,诗句中体现屠呦呦对青蒿素的提取,属于化学变化
B.“熬胆矾铁釜,久之亦化为铜”,该过程发生了置换反应
C.“霾尘积聚难见路人”,雾霾所形成的气溶胶有丁达尔效应
D.“春蚕到死丝方尽,蜡炬成灰泪始干”诗句中涉及氧化还原反应
【答案】A
【解析】A项,屠呦呦对青蒿素的提取涉及到萃取的操作,没有生成新物质,为物理过程,不涉及化学变化,错误;B项,“熬胆矾铁釜,久之亦化为铜”,涉及铁与硫酸铜生成铜的反应为置换反应,正确;C项,雾霾的粒子直径在1 nm~100 nm之间,在空气中所形成的分散系为胶体,属于气溶胶胶体能产生丁达尔效应,正确;D项,燃烧属于氧化还原反应正确。
4.(2022年江苏省盐城市响水中学期中)国自主研制的第五代单座双发隐形战斗机歼31使用了高强度、耐高温的钛合金,工业上炼钛的原理是在880℃~950℃下的氩气气氛发生反应:TiCl4 +2MgTi+2MgCl2 ,下列有关该反应的说法中正确的是
A.TiCl4是还原剂
B.氩气在反应体系中做保护气,防止镁与其他元素反应
C.TiCl4中氯元素被氧化
D.每1个TiCl4被还原时转移2个电子
【答案】B
【解析】A项,反应中Ti元素化合价降低,则TiCl4为氧化剂,错误;B项,反应中Mg失去电子化合价升高,则Mg被氧化,Mg易被氧气氧化,所以为防止Mg被氧化该反应可在氩气流中进行,正确;C项,反应前后Cl元素化合价不变,则TiCl4中氯元素没有被氧化,错误;D项,Ti元素化合价从+4变为0,化合价降低4价,则每1个TiCl4被还原时转移4个电子,错误。
5.(2022年湖北省期中)分别用下列方法制氯气:
①MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O
②2KMnO4+16HCl(浓)=2KCl+2MnCl2+8H2O+5Cl2↑
③KClO+2HCl(浓)=KCl+Cl2↑+H2O
若制得的氯气的质量相同,则反应①②③中电子转移数目之比为
A.1∶5∶3 B.3∶5∶1
C.1∶1∶1 D.2∶2∶1
【答案】D
【解析】反应①中,生成1个 Cl2,转移2个e-;反应②中,生成个Cl2,转移2个e-;反应③中,生成1个Cl2,转移1个e-。所以制得相同质量的氯气,反应①②③中电子转移数目之比为2∶2∶1,故选D项。
6.(2022年天津市五校联考期中)高铁酸钾(K2FeO4)是一种高效的净水剂,可用次氯酸盐氧化法制备,原理如下:
① 2FeCl3+10NaOH+3NaClO=2Na2FeO4+9NaCl+5H2O
② Na2FeO4+2KOH=K2FeO4+2NaOH。下列说法正确的是
A.反应①②均为氧化还原反应
B.反应①中FeCl3是还原剂
C.反应②中氧化剂和还原剂的个数之比为1∶2
D.每生成1个K2FeO4,转移电子数为1个
【答案】B
【解析】A项,反应②中各元素化合价均没有变化,反应②为非氧化还原反应,不符合题意;B项,反应①,FeCl3中铁元素化合价升高,FeCl3是还原剂,符合题意;C项,反应②中各元素化合价均没有变化,反应②为非氧化还原反应,不符合题意;D项,铁元素化合价由+3升高为+6,每生成1个K2FeO4,转移电子的个数为3个,不符合题意。
7.(2022年安徽省池州市贵州区期中)下列单、双线桥的表示方法正确的是
A. B.
C. D.
【答案】C
【解析】A项,该反应中C原子失去电子,Si原子得到电子,转移的电子数为4e-,正确的表示方法为,错误;B项,该反应中Cl元素的化合价既升高又降低,转移的电子数为e-,则该方程式电子转移表示方法为,错误;C项,该反应中钠失去电子,氢得到电子,转移的电子数为2,则该方程式电子转移表示方法为,正确;D项,该反应中碘元素化合价由-1价升高到0价,失电子,锰元素化合价由+7价降低到+2价,得电子,根据电子得失守恒,则该方程式电子转移表示方法为,错误。
8.(2022年天津市五校联考期中)把Cl2通入浓氨水中,发生如下反应:3Cl2+8NH3=6NH4Cl+N2。
①用双线桥表示反应的电子转移方向和数目:_____________________________________________。
②反应中氧化剂与还原剂的个数之比为:___________。
【答案】① ②3∶2
【解析】3Cl2+8NH3=6NH4Cl+N2反应,氯气中氯元素化合价由0降低为-1、氨气中氮元素化合价由-3升高为0。
①用双线桥表示反应的电子转移方向和数目为。
②氯气中氯元素化合价降低,氯气是氧化剂;氨气中氮元素化合价升高,氨气是还原剂,8个氨气分子中有2个氮原子化合价升高发生氧化反应,反应中氧化剂与还原剂的个数之比为3∶2。
【过关检测】
1.(2022年湖北省孝感市期中)我国“四大发明”在人类发展史上起到了非常重要的作用,其中黑火药的爆炸反应:2KNO3+S+3CK2S+N2↑+3CO2↑。该反应中被氧化的元素是
A.C B.N C.N和S D.N和C
【答案】A
【解析】根据反应方程式2KNO3+S+3CK2S+N2↑+3CO2↑,N元素的化合价由+5价降至0价,化合价降低被还原,S元素的化合价由0价降至-2价,化合价降低被还原,C元素的化合价由0价升至+4价,化合价升高被氧化,因此被氧化的元素是C,答案选A项。
2.(2022年江苏省扬州市期末)碳铵受热易发生反应NH4HCO3NH3↑+CO2↑+H2O,下列说法正确的是
A.NH4HCO3属于有机化合物 B.NH4HCO3属于氧化物
C.该反应是氧化还原反应 D.该反应是分解反应
【答案】D
【解析】A项,NH4HCO3虽然含有碳元素,但其结构和性质更类似于无机物,因此属于无机化合物,错误;B项,由两种元素组成其中一种是氧元素的化合物是氧化物,NH4HCO3属于盐,错误;C项,反应中没有元素的化合价发生变化,该反应不是氧化还原反应,错误;D项,一种物质生成多种物质的反应是分解反应,因此该反应是分解反应,正确。
3.(2022年黑龙江省大庆外国语学校期中)宋代著名法医学家宋慈的《洗冤集录》中有“银针验毒”的记载,“银针验毒”的原理是4Ag+2H2S+O2=2Ag2S+2H2O,下列说法错误的是
A.O2是氧化剂,被还原 B.反应中H2S被氧化
C.银针验毒时,Ag元素化合价升高 D.银针验毒时,空气中氧气得到电子
【答案】B
【解析】反应4Ag+2H2S+O2=2Ag2S+2H2O中,Ag元素化合价由0价升高到+1价,被氧化,O元素化合价由0价降低到-2价,被还原,S元素化合价不变。
A项,根据上述分析可知氧气是氧化剂,被还原,正确;B项,反应中S和H元素化合价在反应前后均不变,H2S既未被氧化也未被还原,错误;C项,Ag元素化合价由0价升高到+1价,正确;D项,反应过程中氧气化合价降低,说明得电子被还原,正确。
4.(2022年江苏省扬州市邗江区期中改编)工业上通过2Al2O3+3C+6Cl2=4AlCl3+3CO2制取无水氯化铝,下列说法正确的是
A.AlCl3是氧化产物 B.Cl2是氧化剂
C.每生成1个CO2,转移2个电子 D.C发生还原反应
【答案】B
【解析】A项,反应中Cl元素的化合价降低,被还原,则AlCl3是还原产物,错误;B项,反应中Cl元素的化合价降低,被还原,则氯气为氧化剂,正确;C项,反应中C的化合价从0价升高到+4价,则每生成1个CO2,转移4个电子,错误;D项,反应中C元素的化合价升高,被氧化,发生氧化反应,错误。
5.(2022年安徽省池州市贵池区期中)下列有水参加的反应中,属于氧化还原反应,但水既不是氧化剂也不是还原剂的是
A.2Na+2H2O=2NaOH+H2↑ B.HCl+NaOH=NaCl+H2O
C.Na2O+H2O=2NaOH D.Cl2+H2O=HCl+HClO
【答案】D
【解析】有元素化合价变化的反应为氧化还原反应,水中H、O元素的化合价不变,则水既不是氧化剂又不是还原剂。
A项,金属钠和水反应生成氢氧化钠和氢气,Na元素的化合价升高,水中H元素的化合价降低,则水为氧化剂,不符合题意;B项,HCl+NaOH=NaCl+H2O,没有元素的化合价变化,不属于氧化还原反应,不符合题意;C项,氧化钠和水反应生成NaOH,没有元素的化合价变化,不属于氧化还原反应,不符合题意;D项,Cl2+H2O=HCl+HClO,Cl2中Cl元素的化合价变化,为氧化还原反应,水中H、O元素的化合价不变,则水既不是氧化剂又不是还原剂,符合题意。
6.(2022年安徽省池州市贵州区期中)ClO2是新一代饮用水的消毒剂,许多发达国家的自来水厂采用ClO2代替Cl2来进行自来水消毒。我国最近成功研制出制取ClO2的新方法,其反应的微观过程如下所示:
下列有关该反应的叙述中正确的是
A.该反应是复分解反应
B.该反应的化学方程式Cl2+2NaClO2=2ClO2+2NaCl
C.该反应中Cl2是氧化剂
D.NaClO2和ClO2中Cl元素的化合价相同
【答案】BC
【解析】A项,由图可知,反应物为氯气和NaClO2,氯气为单质,则该反应一定不是复分解反应,错误;B项,由图可知,反应物为氯气和NaClO2,生成物为ClO2和NaCl,该反应的化学方程式为Cl2+2NaClO2=2ClO2+2NaCl,正确;C项,反应Cl2+2NaClO2=2ClO2+2NaCl中,Cl2中Cl元素的化合价降低,则Cl2为氧化剂,正确;D项,NaClO2中Cl的化合价为+3价,ClO2中Cl的化合价为+4价,错误。
7.(2022年广东省汕头市澄海中学期中)化学实验中若使某步中的有害产物作为另一步的反应物,形成一个循环,则可不再向环境排放该种有害物质。在如图所示有编号的反应中,属于氧化还原反应的有
A. B.5个 C.4个 D.3个
【答案】D
【解析】由转化流程图可知,反应①中Cr的化合价降低了,是氧化还原反应;反应②中元素的化合价未改变,是非氧化还原反应;反应③元素的化合价未改变,是非氧化还原反应;反应④Cr的化合价升高了,是氧化还原反应;反应⑤中Cr元素的化合价降低了,是氧化还原反应;反应⑥元素的化合价未改变,是非氧化还原反应。综上所述,有①④⑤三个反应属于氧化还原反应,故答案为D项。
8.(2022年安徽省池州市贵池区期中)近期学习了物质的分类及转化,请用所学习的知识试写出三种制取CuCl2的方法,并用化学方程式表示,并标明反应类型(填四种基本反应类型或氧化还原反应)。
(1)方程式:_________________________________________,反应类型:____________________。
(2)方程式:_________________________________________,反应类型:____________________。
(3)方程式:_________________________________________,反应类型:____________________。
【答案】(1)Cu+Cl2CuCl2 氧化还原反应或化合反应 (2)CuO+2HCl=CuCl2+H2O 复分解反应 (3)CuSO4+BaCl2=BaSO4↓+CuCl2 复分解反应
【解析】(1)用氯气与铜反应生成氯化铜,Cu+Cl2CuCl2,反应类型为化合反应或氧化还原反应;(2)用氧化铜与盐酸反应生成氯化铜和水,CuO+2HCl=CuCl2+H2O,反应类型复分解反应;(3)用硫酸铜与氯化钡反应生成氯化铜和硫酸钡,CuSO4+BaCl2=BaSO4↓+CuCl2,反应类型复分解反应。
9.(2022年江苏省常熟市期中改编)一个体重50 kg的健康人含铁2 g,这2 g铁在人体中不是以金属单质的形式存在,而是以Fe2+和Fe3+的形式存在.亚铁离子易被吸收,给贫血者补充铁时,应给予含亚铁离子的亚铁盐,如硫酸亚铁。
(1)工业盐的主要成分是NaNO2,以前有许多起因误食NaNO2而中毒的事件,其原因是NaNO2把人体内的Fe2+转化为Fe3+而失去与O2结合的能力,这说明NaNO2具有_________性。工业盐中毒后,可服用维生素C来缓解中毒状况,这说明维生素C具有___________性。
(2)在Fe+4HNO3=Fe(NO3)3+NO↑+2H2O的反应中,还原剂是___________,反应中HNO3表现的作用为________________。
【答案】(1)氧化 还原 (2)氧化剂和酸性
【解析】(1)NaNO2把人体内的Fe2+转化为Fe3+,说明Fe2+被氧化,则NaNO2在转化中作氧化剂,表现了氧化性;工业盐中毒后,可服用维生素C来缓解中毒状况,说明Fe3+又转化为Fe2+,Fe3+被还原,则维生素C作还原剂,表现还原性;(2)Fe+4HNO3=Fe(NO3)3+NO↑+2H2O的反应中,Fe的价态升高,Fe作还原剂;参加反应的4个HNO3中,有一个HNO3中N的价态降低,作氧化剂,另3个HNO3生成了Fe(NO3)3,表现了酸性。
10.(2022年湖北省期中改编)现有下列10种物质:①铝,②纯醋酸,③CO2,④H2SO4,⑤NaOH,⑥硫酸铜溶液,⑦熔融的NaCl,⑧NaHSO4,⑨硝酸钾晶体,⑩乙醇。
(1)上述物质中属于非电解质的有___________(填序号);①②⑥⑦⑨⑩这六种物质中能导电的有___________(填序号)。
(2)向⑥中加入铁粉,氧化产物是_____________。
(3)⑧在水中的电离方程式为_________________________________。
(4)上述物质中有两种物质在水溶液中发生的反应可用离子反应H++OH-=H2O表示,请写出该离子反应对应的其中一个化学方程式___________________________________。
(5)用双线桥表示该反应电子转移情况:CaH2+2H2O=Ca(OH)2+2H2↑,_____________________。
【答案】(1)③⑩ ①⑥⑦ (2)硫酸亚铁 (3)NaHSO4=Na++H++SO42- (4)2NaOH+H2SO4=Na2SO4+2H2O (5)
【解析】(1)非电解质是指在水溶液里和熔融状态下都不能导电的化合物,故为③CO2,⑩乙醇;导电需要自由移动的离子或者金属,故为①铝,⑥硫酸铜溶液,⑦熔融的NaCl;(2)发生的反应为CuSO4+Fe=FeSO4+Cu,Fe的价态升高被氧化为FeSO4,则氧化产物为FeSO4;(3)NaHSO4属于强电解质,所以为NaHSO4=Na++H++SO42-;(4)由题意可知,是强酸强碱的中和反应,所以为2NaOH+H2SO4=Na2SO4+2H2O;(5)反应CaH2+2H2O=Ca(OH)2+2H2↑中,CaH2中H元素由-1价变成0价,H2O中H元素由+1变成0价,所以电子转移为。
【暑假初升高】人教版化学初三(升高一)暑假预习-第17讲 元素周期表 讲学案: 这是一份【暑假初升高】人教版化学初三(升高一)暑假预习-第17讲 元素周期表 讲学案,文件包含暑假初升高人教版化学初三升高一暑假预习-第17讲元素周期表解析版docx、暑假初升高人教版化学初三升高一暑假预习-第17讲元素周期表原卷版docx等2份学案配套教学资源,其中学案共24页, 欢迎下载使用。
【暑假初升高】人教版化学初三(升高一)暑假预习-第16讲 原子结构与核素 讲学案: 这是一份【暑假初升高】人教版化学初三(升高一)暑假预习-第16讲 原子结构与核素 讲学案,文件包含暑假初升高人教版化学初三升高一暑假预习-第16讲原子结构与核素解析版docx、暑假初升高人教版化学初三升高一暑假预习-第16讲原子结构与核素原卷版docx等2份学案配套教学资源,其中学案共24页, 欢迎下载使用。
【暑假初升高】人教版化学初三(升高一)暑假预习-第15讲 金属材料 讲学案: 这是一份【暑假初升高】人教版化学初三(升高一)暑假预习-第15讲 金属材料 讲学案,文件包含暑假初升高人教版化学初三升高一暑假预习-第15讲金属材料解析版docx、暑假初升高人教版化学初三升高一暑假预习-第15讲金属材料原卷版docx等2份学案配套教学资源,其中学案共34页, 欢迎下载使用。












