
所属成套资源:2024届高三新高考化学大一轮专题练习(46份)
2024届高三新高考化学大一轮专题练习:原电池
展开这是一份2024届高三新高考化学大一轮专题练习:原电池,共20页。试卷主要包含了单选题,多选题,非选择题等内容,欢迎下载使用。
2024届高三新高考化学大一轮专题练习:原电池
一、单选题
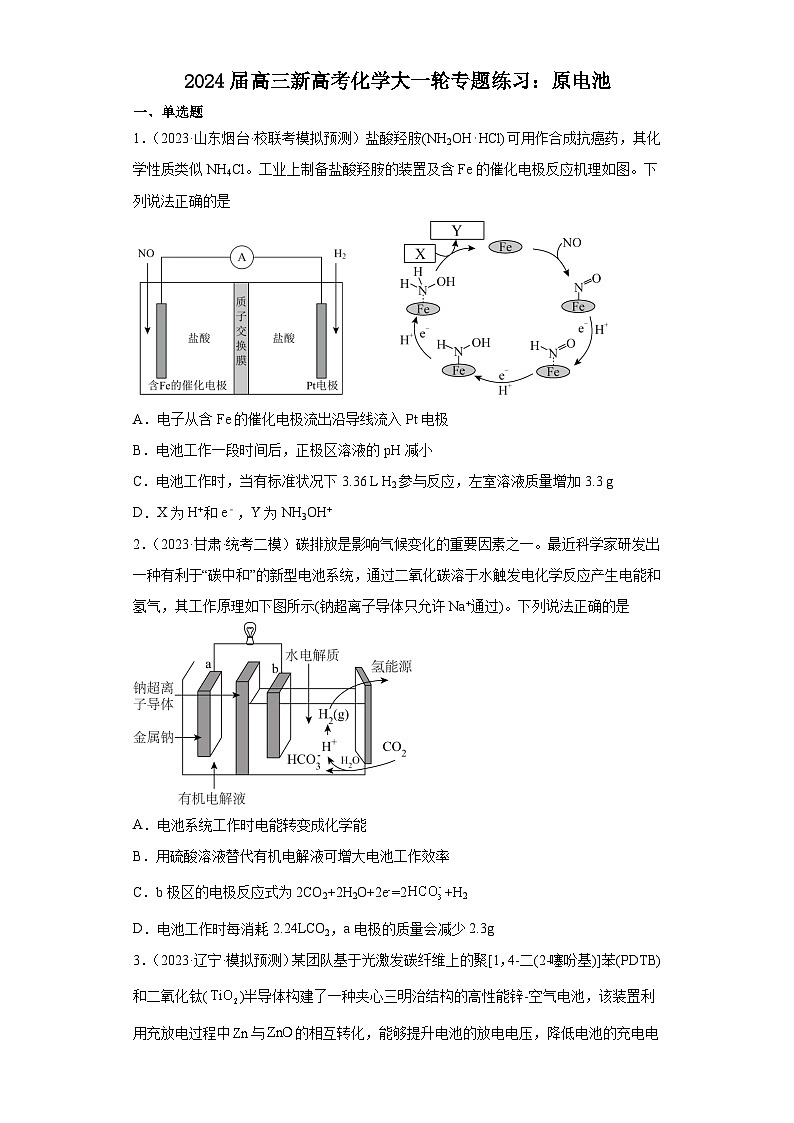
1.(2023·山东烟台·校联考模拟预测)盐酸羟胺(NH2OH⋅HCl)可用作合成抗癌药,其化学性质类似NH4Cl。工业上制备盐酸羟胺的装置及含Fe的催化电极反应机理如图。下列说法正确的是
A.电子从含Fe的催化电极流出沿导线流入Pt电极
B.电池工作一段时间后,正极区溶液的pH减小
C.电池工作时,当有标准状况下3.36 L H2参与反应,左室溶液质量增加3.3 g
D.X为H+和e﹣,Y为NH3OH+
2.(2023·甘肃·统考二模)碳排放是影响气候变化的重要因素之一。最近科学家研发出一种有利于“碳中和”的新型电池系统,通过二氧化碳溶于水触发电化学反应产生电能和氢气,其工作原理如下图所示(钠超离子导体只允许Na+通过)。下列说法正确的是
A.电池系统工作时电能转变成化学能
B.用硫酸溶液替代有机电解液可增大电池工作效率
C.b极区的电极反应式为2CO2+2H2O+2e-=2+H2
D.电池工作时每消耗2.24LCO2,a电极的质量会减少2.3g
3.(2023·辽宁·模拟预测)某团队基于光激发碳纤维上的聚[1,4-二(2-噻吩基)]苯(PDTB)和二氧化钛()半导体构建了一种夹心三明治结构的高性能锌-空气电池,该装置利用充放电过程中与的相互转化,能够提升电池的放电电压,降低电池的充电电压,其工作原理如图所示。下列有关说法错误的是
A.该装置可实现光能向电能和化学能的转化
B.电极电势:
C.开关K置于M处时,电子由极通过导线流向PDTB极
D.开关K置于N处时,极的电极反应式为
4.(2023春·重庆九龙坡·高三重庆市育才中学校考期中)下列关于如图所示电池的说法中不正确的是
A.甲烧杯溶液质量基本保持不变
B.若换成阴离子交换膜,从甲烧杯移向乙烧杯
C.装置中发生的总反应是
D.电池工作一段时间,乙烧杯成了混合溶液
5.(2023春·四川达州·高三统考期中)氨可用于燃料电池,氨易液化,运输和储存方便,安全性能更高。新型NH3-O2燃料电池的装置如图所示,电池工作时的总反应为4NH3+3O2=2N2+6H2O,下列说法正确的是
A.电极a作负极 B.NH3发生还原反应
C.OH-向电极b方向迁移 D.当消耗2.24LO2时,电路中转移电子0.4mol
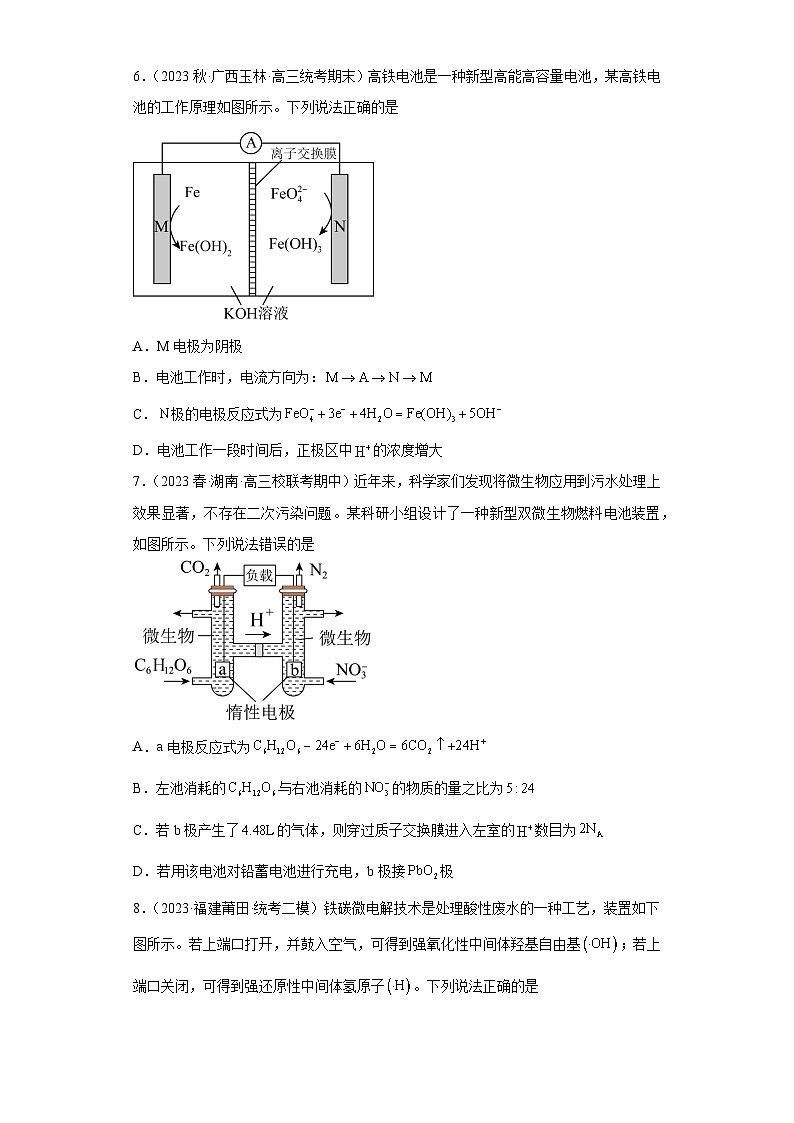
6.(2023秋·广西玉林·高三统考期末)高铁电池是一种新型高能高容量电池,某高铁电池的工作原理如图所示。下列说法正确的是
A.M电极为阴极
B.电池工作时,电流方向为:
C.极的电极反应式为
D.电池工作一段时间后,正极区中的浓度增大
7.(2023春·湖南·高三校联考期中)近年来,科学家们发现将微生物应用到污水处理上效果显著,不存在二次污染问题。某科研小组设计了一种新型双微生物燃料电池装置,如图所示。下列说法错误的是
A.a电极反应式为
B.左池消耗的与右池消耗的的物质的量之比为
C.若b极产生了的气体,则穿过质子交换膜进入左室的数目为
D.若用该电池对铅蓄电池进行充电,b极接极
8.(2023·福建莆田·统考二模)铁碳微电解技术是处理酸性废水的一种工艺,装置如下图所示。若上端口打开,并鼓入空气,可得到强氧化性中间体羟基自由基;若上端口关闭,可得到强还原性中间体氢原子。下列说法正确的是
A.无论上端口是关闭还是打开,正极反应式均为:
B.完全转化为羟基自由基时转移了电子
C.若处理含酚类的酸性废水,则上端口应关闭
D.若处理含的酸性废水,则上端口应打开并鼓入空气
9.(2023春·山东潍坊·高三统考期中)电池(KOH为电解液)的工作原理如图所示。下列说法错误的是
A.工作时,电流方向为NiOOH电极→导线→Zn电极→电解质溶液→NiOOH电极
B.工作一段时间后,电解液pH减小
C.负极电极反应式为
D.当电路中转移时,电解液质量增加6.5g
10.(2023春·江苏南通·高三统考阶段练习)某同学利用如图所示装置探究原电池原理。下列说法正确的是
A.Zn电极是该电池的正极
B.Cu电极表面产生的气体是H2
C.电子经导线由Cu电极流入Zn电极
D.该装置可将电能转化为化学能
11.(2023春·辽宁葫芦岛·高三校联考阶段练习)下列装置能将化学能转化为电能的是
A. B.
C. D.
12.(2023春·宁夏银川·高三银川唐徕回民中学校考阶段练习)微生物电池是指在微生物的作用下将化学能转化为电能的装置,其工作原理如图所示。下列有关微生物电池的说法错误的是
A.正极反应中有H2O生成
B.微生物参与的反应中无电子的转移
C.质子通过交换膜从负极区移向正极区
D.电池总反应为
二、多选题
13.(2023春·江西九江·高三江西省湖口中学校考期中)科学家设计出质子()膜燃料电池,实现了利用废气资源回收能量并得到单质硫。质子膜燃料电池的结构示意图,如下图所示。(注:质子膜只允许通过)下列说法错误的是
A.外电路中电流方向由电极a→b
B.电路中每通过4 mol电子,在正极消耗标准状况下22.4L
C.电极b上发生的电极反应:
D.每17g 参与反应,有1 mol 经质子膜进入正极区
三、非选择题
14.(2023春·重庆·高三校联考期中)回答下列问题
(1)下列过程中属于吸热反应的是___________。
①灼热的木炭中通入CO2 ②碘升华 ③石灰石受热分解 ④水蒸气液化⑤Mg+2HCl=MgCl2+H2↑ ⑥CH4+2O2CO2+2H2O ⑦HCl+NaHCO3=NaCl+H2O+CO2↑ ⑧Ba(OH)2·8H2O与NH4Cl的反应
(2)已知14g乙烯完全燃烧应生成CO2(g)和H2O(l)放出放出的热量是705.5kJ的热量, 请写出乙烯燃烧的热化学方程式是:___________。
(3)汽车发动机工作时会引发N2和O2反应,生成NOX等污染大气,其中生成NO的能量变化如图所示,则图中三种分子最稳定的是___________。若反应生成2molNO气体(“吸收”或“放出”)___________热量。
(4)如果将燃料燃烧设计成燃料电池就可避免NOX的生成,某种燃料电池的工作原理示意如图所示,a、b均为惰性电极。
①使用时,空气从___________口通入(填“A”或“B”);当外电路通过0.4mol的电子时,消耗O2的体积___________L(标况下)。
②假设使用的“燃料”是甲烷(CH4),a极的电极反应式为___________。
15.(2023春·山西朔州·高三怀仁市第一中学校校考期中)I.某化学兴趣小组为了探索铝电极在原电池中的作用,设计并进行了以下一系列实验,实验结果记录如下:
编号
电极材料
电解质溶液
电流表指针偏转方向
1
Mg、Al
稀盐酸
偏向Al
2
Al、Cu
稀盐酸
偏向Cu
3
Al、石墨
稀盐酸
偏向石墨
4
Mg、Al
NaOH溶液
偏向Mg
根据上表中记录的实验现象,回答下列问题。
(1)实验1、2中Al电极的作用是否相同?___________。
(2)实验3中铝为___________极,电极反应式为;
(3)实验4中的铝为___________极,写出铝电极的电极反应式:___________。
(4)根据以上实验结果,在原电池中相对活泼的金属作正极还是作负极受到哪些因素的影响?___________。
Ⅱ.某种燃料电池的工作原理示意如图所示(a、b均为石墨电极)。
(5)假设使用的“燃料”是氢气(),则b极的电极反应式为___________。
(6)假设使用的“燃料”是甲烷(),则通入甲烷气体的电极反应式为:___________电池工作一段时间后,电解液的碱性将___________(填“增强”、“减弱”或“不变”)。
(7)若消耗标准状况下的甲烷4.48L,假设化学能完全转化为电能,则转移电子的数目为___________(用表示)。
16.(2023春·江苏镇江·高三江苏省镇江中学校考期中)铁元素的纳米材料因具备良好的电学特性和磁学特性,而引起了广泛的研究。纳米零价铁可用于去除水体中的六价铬与硝酸盐等污染物。
(1)用溶液与(H元素为-1价)溶液反应制备纳米零价铁的化学方程式:。当生成时,反应中转移电子的物质的量为___________。
(2)纳米铁碳微电技术是一种利用铁和碳的原电池反应去除水中污染物的技术达到无害排放,该技术处理酸性废水中时,正极电极反应式为___________。
(3)我国科学家研究出USTB工艺制取金属钛,其原理如图。该方法使用的固溶体为具有导电性的,电解质为氯化钙熔盐,电解时阳极发生的主要电极反应为___________。
(4)聚合硫酸铁广泛用于水的净化。以为原料,经溶解、氧化、水解聚合等步骤,可制备聚合硫酸铁。测定聚合硫酸铁样品中铁的质量分数:准确称取液态样品,置于锥形瓶中,加入适量稀盐酸,加热,滴加稍过量的溶液(将还原为),充分反应后,除去过量的。用溶液滴定至终点(滴定过程中与反应生成和),消耗溶液。
①上述实验中若不除去过量的,样品中铁的质量分数的测定结果将___________(填“偏大”或“偏小”或“无影响”)。
②计算该样品中铁的质量分数(写出计算过程)___________。
17.(2023春·山东济宁·高三统考期中)I.“神舟九号”飞船的电源系统共有3种,分别是太阳能电池帆板、镉镍蓄电池和应急电池。
(1)飞船在光照区运行时,太阳能电池帆板将______能转化为______能,除供给飞船使用外,多余部分用镉镍蓄电池储存起来。其工作原理为,当飞船运行到地影区时,镉镍蓄电池开始为飞船供电,负极的电极反应式为______,此时正极附近溶液的碱性______(填“增大”、减小”或“不变”)。
(2)紧急状况下,应急电池会自动启动,工作原理为,其负极的电极反应式为______。
II.甲烷-空气燃料电池是一种高效能、轻污染的车载电池,其工作原理如图:
(3)图中左侧电极为电源______极,该电极的电极反应式为______。
(4)当电池消耗甲烷时,消耗的的体积为______标况下)。
18.(2023春·山东济宁·高三统考期中)电池是人类生产和生活中的重要能量来源,根据原电池原理,人们研制出了性能各异的化学电池。
(1)生活中利用原电池原理生产了各种各样的电池,下列有关电池的叙述正确的是___________(填字母)。
A.锌锰电池工作一段时间后碳棒会变细
B.氢氧燃料电池先将化学能转变为热能,再将热能转化为电能
C.太阳能电池将太阳能直接转化为电能
D.铅蓄电池正极是PbO2,负极是Pb
(2)下图(a)装置中,Al片上看到的现象为___________,(b)装置中Al片上发生反应的电极反应式为___________。
(3)某电池装置下图(c),工作一段时间后,左边ZnSO4的浓度___________(填“变大”、“变小”或“不变”,下同),右边电极质量___________。
(4)航天技术上使用的氢氧燃料电池具有高能,轻便和不污染环境等优点。上图(d)所示的电池总反应式为:2H2+O2=2H2O,工作一段时间后,A电极附近碱性减弱,请回答下列问题。
①A电极的名称为___________(填正极或负极)。
②当消耗H2的体积为33.6L(标准状况下)时,假设电池的能量转化率为80%,则导线中转移电子的数目为___________。
参考答案:
1.C
【分析】由图可知,氢气在Pt电极失电子,Pt电极为负极,电极反应式为H2﹣2e﹣=2H+,含Fe的催化电极上NO→NH2OH⋅HCl,N元素化合价降低,为正极,电极反应式为NO+3e﹣+4H++Cl﹣=NH2OH⋅HCl,据此作答。
【详解】A.由分析知,Pt电极为负极,含Fe的催化电极为正极,原电池中电子从负极流出,流入正极,即电子从Pt电极流出沿导线流入含Fe的催化电极,故A错误;
B.由分析知,含Fe的催化电极为正极,正极电极反应为:NO+3e﹣+4H++Cl﹣=NH2OH⋅HCl,正极区H+浓度减小,pH增大,故B错误;
C.由分析知,负极上H2~2e﹣,正极上NO~3e﹣,当有标准状况下3.36LH2(即0.15molH2)参与反应时,根据得失电子守恒可知,左室中含Fe的催化电极上参与反应的NO为0.1mol,电极反应式为NO+3e﹣+4H++Cl﹣=NH2OH⋅HCl,左室增加的质量为0.1molNO和从右室迁移过来的0.3mol H+的质量,即0.1mol×30g/mol+0.3mol×1g/mol=3.3g,故C正确;
D.由题意“盐酸羟胺(NH2OH⋅HCl)的化学性质类似NH4Cl”可知,NH2OH具有和氨气类似的弱碱性,可以和盐酸反应生成盐酸羟胺(NH2OH⋅HCl),所以图中缺少的一步反应为NH2OH+H+=NH3OH+,图2中则X为H+,Y为NH3OH+,故D错误;
故选:C。
2.C
【分析】钠为活泼金属,发生氧化反应为负极,则b极为正极;
【详解】A.新型电池系统,通过二氧化碳溶于水触发电化学反应产生电能和氢气,故存在化学能转化为电能的过程,A错误;
B.钠为活泼金属,会和稀硫酸反应,故不能用硫酸溶液替代有机电解液,B错误;
C.b极为正极,二氧化碳、水得到电子生成氢气和碳酸氢根离子,电极反应式为2CO2+2H2O+2e-=2+H2,C正确;
D.没有标况,不能计算消耗二氧化碳的物质的量,不能计算电子转移的量,D错误;
故选C。
3.B
【详解】A.由图可知,开关K置于M处时,该装置为原电池,需要利用光能,开关K置于N处时,该装置为电解池,也需要光能,则该装置可实现光能向电能和化学能的转化,选项A正确;
B.原电池中正极的电势大于负极,则电极电势:,电解池中阳极的电势大于阴极,则电极电势:,选项B错误;
C.原电池工作时,电子由负极通过导线流向正极,则开关K置于M处时,电子由极通过导线流向极,选项C正确;
D.开关K置于N处时,该装置为电解池,极为阴极,其电极反应式为,选项D正确;
答案选B。
4.B
【分析】该装置为原电池,Zn的金属性比Cu活泼,Zn为负极,Cu为正极,据此分析。
【详解】A.Zn为负极,锌失去电子生成锌离子,同时溶液中的锌离子经过阳离子交换膜进入乙烧杯,结合电荷守恒,甲烧杯溶液质量基本保持不变,故A正确
B.若换成阴离子交换膜,乙烧杯放电,从乙烧杯移向甲烧杯,故B错误;
C.根据反应原理,装置中发生的总反应是,故C正确;
D.为平衡电荷,甲烧杯中的阳离子,即向乙烧杯移动,故乙烧杯成了混合溶液,故D正确;
故选B。
5.C
【详解】A.该装置为燃料电池,根据总反应方程式可知,通入氧气的a电极作正极,电极反应式为,发生还原反应,A错误;
B.通入氨气的b电极作负极,电极反应式为,发生氧化反应,B错误;
C.a电极作正极,b电极作负极,OH-向电极b方向迁移,C正确;
D.气体不一定在标况下,无法计算转移电子数,D错误。
答案选C。
6.C
【详解】A.极为负极,极为正极,故错误;
B.原电池中,电流方向由正极经过外电路流向负极,再经过电解质溶液中的离子流向正极,电流方向为:,故B错误;
C.极为正极,电极反应式为,故C正确;
D.正极生成氢氧根离子,正极区中的浓度减小,故D错误;
故答案选C。
7.C
【分析】a电极上C6H12O6转化为CO2,C元素化合价升高,被氧化,为原电池的负极,电极反应为;b极上硝酸根离子得电子产生氮气,被还原,为原电池的正极,电极反应为;H+定向移动到正极;
【详解】A.a电极上C6H12O6转化为CO2,C元素化合价升高,被氧化,电极反应式为,选项A正确;
B.a电极电极反应式为,b极电极反应式为,根据得失电子守恒可知,左池消耗的与右池消耗的的物质的量之比为,选项B正确;
C.b极电极方程式为:,当生成标准状况下气体使转移电子数为,但选项中为说明标准状况下,选项C错误;
D.b极为正极,若用该电池对铅蓄电池进行充电,b极接铅蓄电池的正极,即极,选项D正确;
答案选C。
8.B
【详解】A.正极发生得电子的反应,负极发生失电子的氧化反应,所以无论是否鼓入空气,Fe易失去电子生成Fe2+,作负极,电极反应为:Fe-2e-=Fe2+,A错误;
B.若上端口打开,并鼓入空气,可得到强氧化性的羟基自由基,电极反应为2H++2e-+O2=2OH·,所以完全转化为羟基自由基时转移了电子,B正确;
C.除去含酚类的酸性废水,需要氧化性的物质,所以上端口需要打开,可生成羟基自由基氧化酚类,C错误;
D. 在酸性条件下具有强氧化性,需要还原剂,所以需要上端口需要关闭,可得到强还原性中间体氢原子,D错误;
答案选B。
9.D
【分析】从图分析Zn→发生氧化反应Zn-2e- +4OH-=+2H2O,该极为负极。则NiOOH变为Ni(OH)2,发生还原反应:NiOOH+e-+H2O=Ni(OH)2+OH-,它为正极。总反应为Zn+2OH- +2NiOOH =+2Ni(OH)2。
【详解】A.电流从正极经外电路流向负极,即NiOOH电极→导线→Zn电极→电解质溶液→NiOOH电极,A项正确;
B.由上分析,电池消耗OH-,溶液的pH降低,B项正确;
C.由上分析负极反应为Zn-2e- +4OH-=+2H2O,C项正确;
D.从总反应分析每转移2mol电子时反应消耗2molOH-产生1mol即溶液增加(65+32)g/mol×1mol-2mol×17g/mol=63g。所以转移0.2mol电子时溶液增加6.3g,D项错误;
故选D。
10.B
【分析】,锌与硫酸自发发生氧化还原反应,故Zn为负极,Cu为正极,硫酸为电解质溶液;
【详解】A.根据分析,锌失电子为负极,A错误;
B.电解质溶液中的氢离子移动到铜电极表面,生成氢气,B正确;
C.负极失去电子,正极得电子,则Zn失电子,Cu得电子,C错误;
D.该装置为原电池,由化学能转化为电能,D错误;
故答案为:B。
11.B
【详解】A.铜和稀硫酸不反应,不能形成原电池,故A不符合题意;
B.铁活泼性比铜强,铁为负极,铜为正极,氯化铁为电解液,形成了原电池,故B符合题意;
C.酒精是非电解质,不能形成原电池,故C不符合题意;
D.没有形成闭合回路,不能形成原电池,故D不符合题意。
综上所述,答案为B。
12.B
【分析】该装置中,微生物为负极,发生反应:,为正极,反应为:。
【详解】A.为正极,反应为:,A正确;
B.微生物为负极,反应过程中失去电子,发生氧化反应,B错误;
C.在原电池中,阳离子向正极移动,所以质子()通过交换膜从负极区移向正极区,C正确;
D.负极反应:,正极反应:,总反应为:,D正确;
故选B。
13.AB
【分析】根据图知,该燃料电池中,a电极上H2S失电子生成S2和H+,为负极,负极反应式为2H2S-4e-=S2+4H+,b电极为正极,正极上O2得电子和氢离子反应生成H2O,电极反应式为,据此解答。
【详解】A.通过以上分析知,a电极为负极,外电路中电流方向由电极b→a,故A错误;
B.负极上H2S失电子发生氧化反应,根据反应2H2S-4e-=S2+4H+,每通过4mol电子,则负极消耗(标准状况下)44.8LH2S,故B错误;
C.b电极上氧气得电子和氢离子反应生成水,电极反应式为,故C正确;
D.n(H2S)=17g÷34g/mol=0.5mol,根据2H2S-4e-=S2+4H+知,每17gH2S参与反应,有1molH+经质子膜进入正极区,故D正确;
故选AB。
14.(1)①③⑦⑧
(2)
(3) N2 吸收
(4) B 2.24 CH4-8e-+10OH-=+7H2O
【详解】(1)常见的吸热反应有:大多数的分解反应、C或氢气作还原剂的氧化还原反应、氢氧化钡与氯化铵的反应等;常见的放热反应有:燃烧反应、中和反应、金属与水或酸的反应、铝热反应等,
①灼热的木炭中通入CO2 为吸热反应;②碘升华为吸热过程;③石灰石受热分解为吸热反应;④水蒸气液化为放热过程 ;⑤Mg+2HCl=MgCl2+H2↑ 为放热反应;⑥CH4+2O2CO2+2H2O为放热反应;⑦HCl+NaHCO3=NaCl+H2O+CO2↑为吸热反应;⑧Ba(OH)2·8H2O与NH4Cl反应为吸热反应; 属于吸热反应的是①③⑦⑧;
(2)14g乙烯完全燃烧放出705.5kJ的热量,则28g即1mol乙烯反应放出1411.0kJ能量,乙烯燃烧的热化学方程式为;
(3)键能越小化学键越易断裂,键能越大物质越稳定,则图中三种分子最稳定的是N2。N2(g)+ O2(g)=2NO(g)△H=946kJ·mol-1+498 kJ·mol-1-2×632 kJ·mol-1=+180 kJ·mol-1若反应生成2molNO气体吸收180 kJ热量;
(4)①由电子转移方向可知a为负极,发生氧化反应,应通入燃料,b为正极,发生还原反应,空气从B口通入,b为正极发生电极反应式为O2+H2O+4e-=4OH-,当外电路通过0.4mol的电子时,消耗0.1molO2,标况下氧气的体积为V=n∙Vm=0.1mol×22.4L/mol=2.24L;
②假设使用的“燃料”是CH4,则a为负极的电极反应式为CH4-8e-+10OH-=+7H2O。
15.(1)不相同
(2)负
(3) 负
(4)电极活泼性强弱有关,电解液种类有关
(5)
(6) 减弱
(7)1.6
【详解】(1)实验1中电流表偏向Al,则说明Al为正极,实验2中电流表偏向Cu,则说明Cu为正极,Al为负极,因此实验1、2中Al电极的作用是不相同;故答案为:不相同。
(2)根据实验1、2分析电流表偏向正极,因此实验3中石墨为正极,铝为负极,Al失去电子变为铝离子;故答案为:负。
(3)根据实验1、2分析电流表偏向正极,因此实验4中Mg为正极,Al为负极,该原电池为碱性电池,铝失去电子和氢氧根结合生成偏铝酸根,则铝电极的电极反应式:;故答案为:负;。
(4)根据以上实验结果,通过实验1、2、3说明在原电池中相对活泼的金属作正极还是作负极受到与电极活泼性强弱有关,通过实验1、4说明在原电池中相对活泼的金属作正极还是作负极受到与电解液种类有关;故答案为:电极活泼性强弱有关,电解液种类有关。
(5)假设使用的“燃料”是氢气(),根据图中信息得到a为负极,b为正极,b电极氧气得到电子变为氢氧根,则b极的电极反应式为;故答案为:。
(6)假设使用的“燃料”是甲烷(),甲烷在负极失去电子,和氢氧根结合得到碳酸根,则通入甲烷气体的电极反应式为:,电池工作一段时间后,根据总反应方程式,则电解液的碱性将减弱;故答案为:;减弱。
(7)若消耗标准状况下的甲烷4.48L即物质的量为0.2mol,假设化学能完全转化为电能,根据电极方程式,则转移电子的数目为1.6;故答案为:1.6。
16.(1)
(2)
(3)
(4) 偏大 12.32%
【详解】(1)根据反应:,,氢从-1价升高到0价,化合价升高8价,,氢从+1价降低到0价,化合价降6价,铁从+2价降低到0价,化合价降2,总共将8价,所以当生成1mol Fe时,反应中转移电子的物质的量为8mol;
(2)要使除水中污染物的技术达到无害排放,该技术处理酸性废水中时正极生成无毒气体,电极反应式为:;
(3)TiO·TiC固溶体作阳极,发生失电子的氧化反应,生成Ti2+和CO,其电极反应为TiO·TiC-4e-=2Ti2++CO;
(4)①Sn2+具有还原性,能被K2Cr2O7氧化,从而导致K2Cr2O7消耗偏多,则样品中铁的质量分数的测定结果将偏大;
②将亚铁离子氧化为铁离子,自身被还原为Cr3+,消耗一个转移6个电子,氧化一个亚铁离子转移一个电子,根据转移电子守恒可得关系式,则,Fe元素质量,则样品中铁的质量分数。
17.(1) 太阳 电 Cd-2e-+2OH-= Cd(OH)2 增大
(2)Zn-2e-+2OH-=Zn(OH)2
(3) 负极 CH4-8e-+2H2O=CO2+8H+
(4)6.72L
【详解】(1)太阳能电池帆板将太阳能转化为电能;镉镍蓄电池工作原理为,根据总反应式,镉镍蓄电池放电时,负极Cd失电子生成Cd(OH)2,负极的电极反应式为Cd-2e-+2OH-= Cd(OH)2;正极NiOOH得电子生成Ni(OH)2,正极反应式为NiOOH+e-+H2O=Ni(OH)2+OH-,正极附近溶液的碱性增大。
(2)应急电池工作原理为,根据总反应式,可知负极Zn失电子生成Zn(OH)2,负极的电极反应式为Zn-2e-+2OH-=Zn(OH)2。
(3)根据图示,氢离子由左向右移动,可知图中左侧电极为电源负极,负极甲烷失电子生成二氧化碳和氢离子,该电极的电极反应式为CH4-8e-+2H2O=CO2+8H+;
(4)电池总反应为CH4+2O2=CO2+2H2O,当电池消耗甲烷时,消耗的的物质的量为,氧气在标准状况下的体积为0.3mol×22.4L/mol=6.72L。
18.(1)CD
(2) 有(无色)气泡产生 Al-3e- + 4OH-= + 2H2O
(3) 变大 变小
(4) 负极 2.4NA (或1.4448×1024,1.44×1024)
【详解】(1)A.在锌锰干电池中,正极是碳棒,该电极上MnO2得电子发生还原反应,而碳棒不发生反应,质量不会减少,不会变细,故A错误;
B.氢氧燃料电池属于原电池的一种,是将化学能直接转化为电能的装置,不是将热能直接转变为电能,故B错误;
C.太阳能电池将太阳能直接转化成电能,故C正确;
D.铅蓄电池正极是PbO2,负极是Pb,故D正确。
故选:CD。
(2)图(a)装置中Mg、Al和稀硫酸构成原电池,Mg易失电子作负极,Al作正极,正极上H+得电子发生还原反应,电极反应式为2H++2e﹣=H2↑,因此在Al片上看到的现象为有(无色)气泡产生;
(b)装置中Mg、Al和NaOH溶液构成原电池,Mg不能与NaOH溶液反应,而Al能与NaOH溶液反应失去电子作负极,Mg作正极,负极上电极反应式为:Al-3e- + 4OH-= + 2H2O。
(3)由图示装置可知,Zn为负极,发生的电极反应式为:Zn-2e—=Zn2+;Pb为正极,发生的电极反应式为:PbSO4+2e—=Pb+,ZnSO4溶液为电解质溶液,电池工作时,从右边(正极)向左边(负极)迁移,因此右边ZnSO4浓度不变,左边ZnSO4浓度变大,右边电极上由PbSO4变为Pb,电极质量变小。故答案为变大;变小。
(4)根据题意可知,电池工作一段时间后,A电极附近碱性减弱,说明A电极消耗OH—,则A电极为负极,发生氧化反应,氢气失电子与OH—反应生成水,则反应式为H2-2e—+2OH—=2H2O,1mol H2~2mole—,当消耗H2的体积为33.6L(标准状况下)时,H2的物质的量为1.5mol, 电池的能量转化率为80%,则导线中转移电子的数目为1.5×2×80%×NA=2.4 NA。故答案为负极;2.4NA (或1.4448×1024,1.44×1024)。
相关试卷
这是一份2024届高三新高考化学大一轮专题练习:原电池,共20页。试卷主要包含了单选题,非选择题等内容,欢迎下载使用。
这是一份2024届高三新高考化学大一轮专题练习—原电池,共25页。试卷主要包含了单选题,原理综合题等内容,欢迎下载使用。
这是一份2024届高三新高考化学大一轮专题练习 原电池,共20页。试卷主要包含了多选题,单选题,非选择题等内容,欢迎下载使用。












