2024届高三新高考化学大一轮专题练习—原电池
展开2024届高三新高考化学大一轮专题练习—原电池
一、单选题
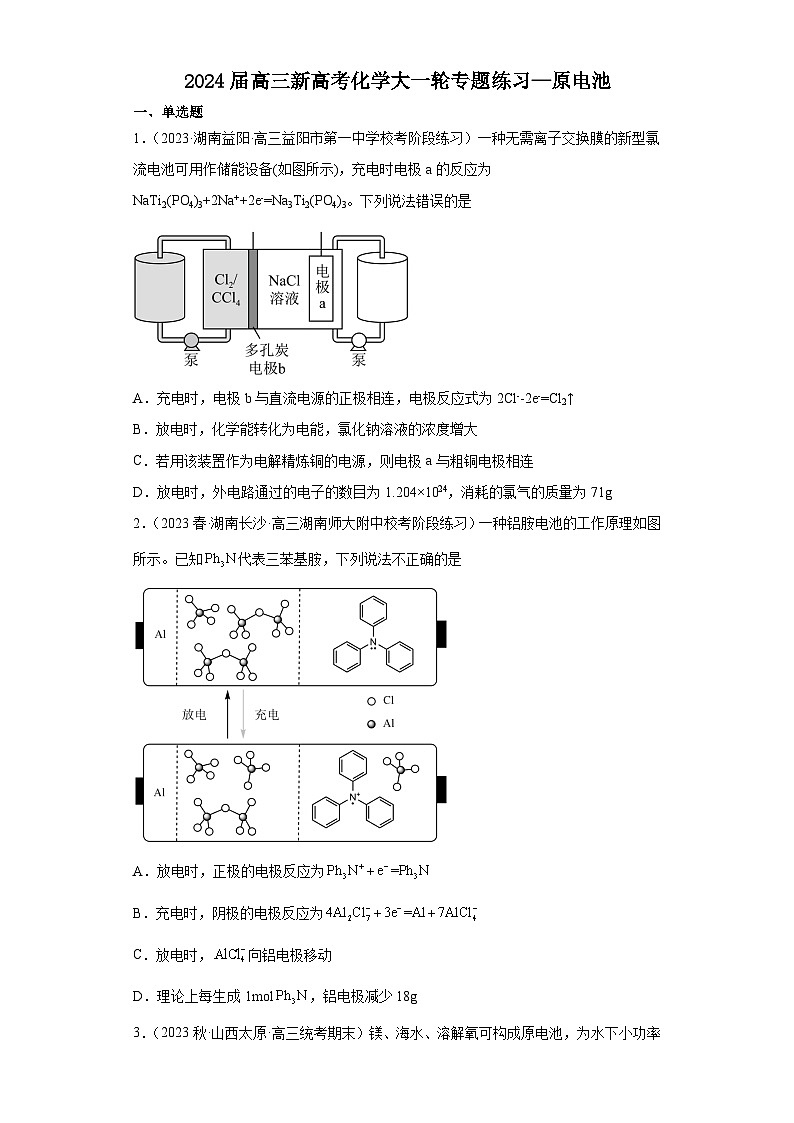
1.(2023·湖南益阳·高三益阳市第一中学校考阶段练习)一种无需离子交换膜的新型氯流电池可用作储能设备(如图所示),充电时电极a的反应为NaTi2(PO4)3+2Na++2e-=Na3Ti2(PO4)3。下列说法错误的是
A.充电时,电极b与直流电源的正极相连,电极反应式为2Cl--2e-=Cl2↑
B.放电时,化学能转化为电能,氯化钠溶液的浓度增大
C.若用该装置作为电解精炼铜的电源,则电极a与粗铜电极相连
D.放电时,外电路通过的电子的数目为1.204×1024,消耗的氯气的质量为71g
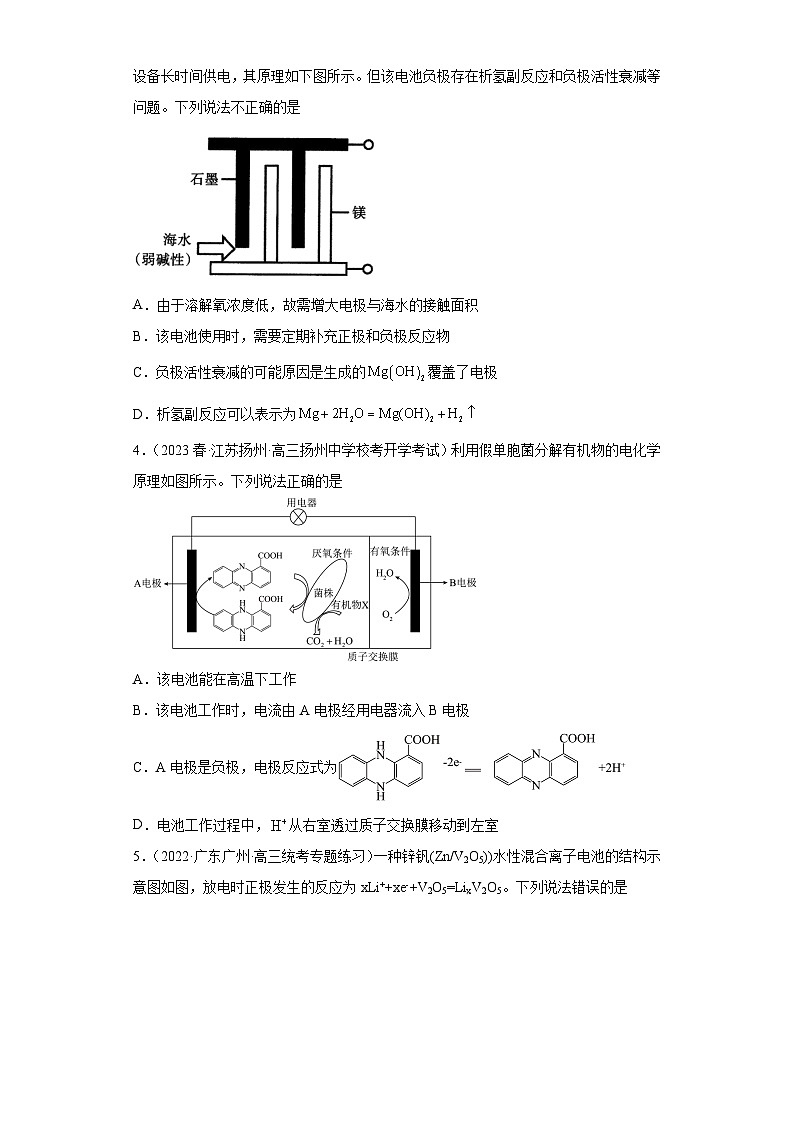
2.(2023春·湖南长沙·高三湖南师大附中校考阶段练习)一种铝胺电池的工作原理如图所示。已知代表三苯基胺,下列说法不正确的是
A.放电时,正极的电极反应为
B.充电时,阴极的电极反应为
C.放电时,向铝电极移动
D.理论上每生成1mol,铝电极减少18g
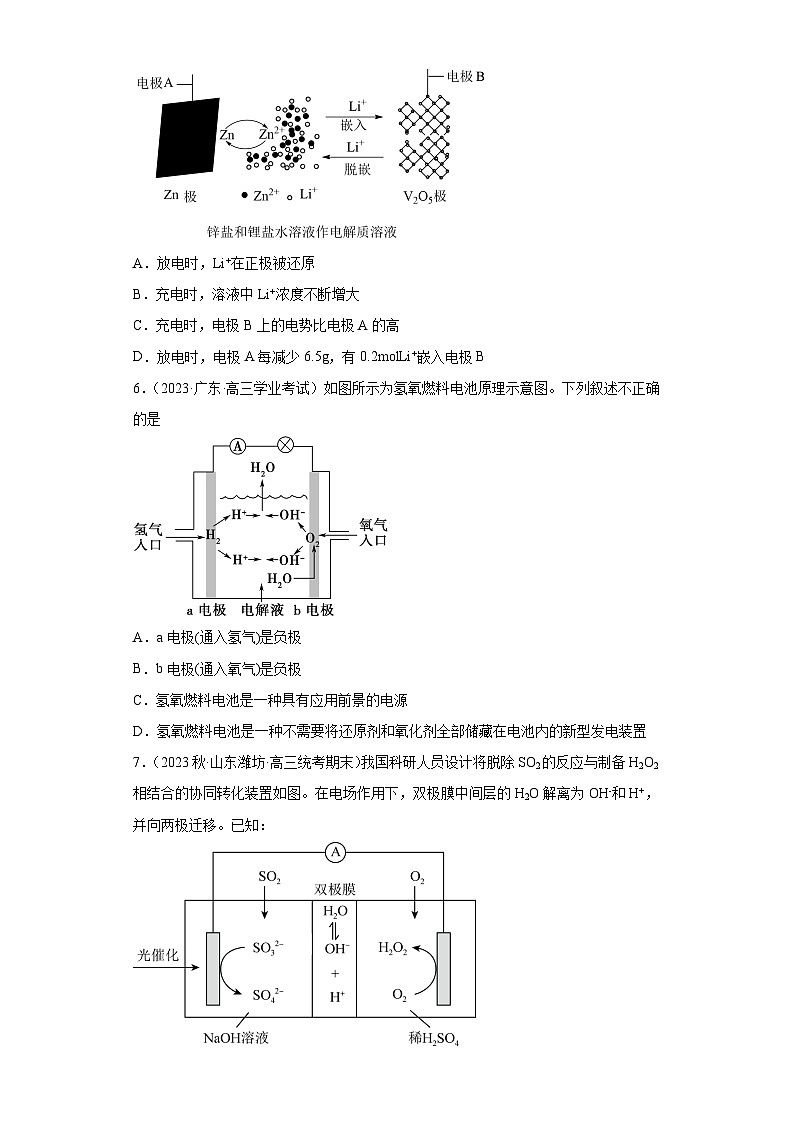
3.(2023秋·山西太原·高三统考期末)镁、海水、溶解氧可构成原电池,为水下小功率设备长时间供电,其原理如下图所示。但该电池负极存在析氢副反应和负极活性衰减等问题。下列说法不正确的是
A.由于溶解氧浓度低,故需增大电极与海水的接触面积
B.该电池使用时,需要定期补充正极和负极反应物
C.负极活性衰减的可能原因是生成的覆盖了电极
D.析氢副反应可以表示为
4.(2023春·江苏扬州·高三扬州中学校考开学考试)利用假单胞菌分解有机物的电化学原理如图所示。下列说法正确的是
A.该电池能在高温下工作
B.该电池工作时,电流由A电极经用电器流入B电极
C.A电极是负极,电极反应式为
D.电池工作过程中,从右室透过质子交换膜移动到左室
5.(2022·广东广州·高三统考专题练习)一种锌钒(Zn/V2O5))水性混合离子电池的结构示意图如图,放电时正极发生的反应为xLi++xe-+V2O5=LixV2O5。下列说法错误的是
A.放电时,Li+在正极被还原
B.充电时,溶液中Li+浓度不断增大
C.充电时,电极B上的电势比电极A的高
D.放电时,电极A每减少6.5g,有0.2molLi+嵌入电极B
6.(2023·广东·高三学业考试)如图所示为氢氧燃料电池原理示意图。下列叙述不正确的是
A.a电极(通入氢气)是负极
B.b电极(通入氧气)是负极
C.氢氧燃料电池是一种具有应用前景的电源
D.氢氧燃料电池是一种不需要将还原剂和氧化剂全部储藏在电池内的新型发电装置
7.(2023秋·山东潍坊·高三统考期末)我国科研人员设计将脱除SO2的反应与制备H2O2相结合的协同转化装置如图。在电场作用下,双极膜中间层的H2O解离为OH-和H+,并向两极迁移。已知:
①单独制备H2O2:,不能自发进行;
②单独脱除SO2:,能自发进行。
下列说法正确的是
A.正极的电极反应式:
B.单独脱除SO2的反应为吸热反应
C.反应过程中需补加稀H2SO4
D.协同转化总反应:
8.(2023秋·广东佛山·高三统考期末)电池具有优良的性能,其工作原理如图所示。下列说法正确的是
A.金属Li为正极
B.电子流动方向为:锂电极→有机电解液→石墨电极
C.石墨电极的电极反应式为
D.有机电解液可以换成水性电解液
9.(2023秋·福建三明·高三统考期末)中国科学院研究团队在碱性锌铁液流电池研究方面取得新进展,该电池的总反应为:。下列叙述正确的是
A.放电时,M极附近溶液变小
B.充电时,右侧贮液器中溶液浓度不变
C.充电时,N接电源负极,电极反应式为:
D.放电时,电路中每转移电子,负极区电解质溶液增重
10.(2022秋·四川成都·高三校联考期末)依据氧化还原反应:Cu2+(aq)+Zn(s)=Zn2+(aq)+Cu(s)设计的原电池如图所示。下列说法错误的是
A.X是Zn,Y溶液中含有Cu2+ B.外电路中的电子由X电极流向Cu电极
C.Cu电极是原电池的正极,发生氧化反应 D.溶液中Zn2+由甲池移向乙池
11.(2022秋·广东广州·高三广州市第二中学校考期末)我国科学家开发出了一种Zn—NO电池系统,该电池在对外供电的同时合成了氨,其工作原理如图所示。双极膜中间的和可通过双极膜,而两端隔室中的离子被阻挡不能进入双极膜中。下列叙述不正确的是
A.Zn/ZnO电极为负极,放电时发生氧化反应
B.正极反应式为
C.双极膜中的向左移动,向右移动
D.正极区溶液pH减小,负极区溶液pH增大
12.(2022秋·安徽·高三统考阶段练习)某一盐桥中吸附有饱和KCl溶液的原电池如图所示,下列说法错误的是
A.该原电池的负极反应为
B.电子流向:Cu棒—盐桥—Pt棒—电流表—Cu棒
C.甲烧杯中的逐渐减小
D.盐桥中的钾离子流向甲烧杯
13.(2023·天津南开·统考一模)一种3D打印机的柔性电池以碳纳米管作电极材料,以吸收ZnSO4溶液的有机高聚物为固态电解质,电池总反应为:。下列说法不正确的是
A.放电时,含有锌膜的碳纳米管纤维作电池负极
B.充电时,阴极反应:
C.有机高聚物中含有极性键、非极性键和氢键
D.合成有机高聚物的单体:
14.(2022·辽宁大连·高三统考学业考试)液氨作为一种潜在的清洁汽车燃料,它在安全性、价格等方面较化石燃料和氢燃料有着较大的优势。利用生物燃料电池原理研究室温下氨的合成,电池工作时在电极与酶之间传递电子,工作原理如图所示:下列说法正确的是
A.电极电势:A>B
B.交换膜为质子交换膜
C.负极的电极反应式为:
D.理论上每合成1mol,电路中转移6mol电子
二、原理综合题
15.(2023春·上海黄浦·高三格致中学校考阶段练习)合成氨是人类科学技术的一项重大突破。完成下列填空:
(1)如图表示未用催化剂时,和反应生成时的能量变化。写出该反应的热化学方程式:___________。在如图画出加入正催化剂后,反应的能量变化示意图______。
(2)该反应的熵变,则a___________0(填“>”或“<”),该反应能自发进行的温度(T)范围是___________(用含a的不等式表示)。
(3)在恒温、恒容密闭容器中进行上述反应,能说明该反应已达到平衡状态的是___________。(选填编号)
A.容器内、、的浓度之比为1∶3∶2
B.质量分数保持不变
C.容器内气体压强保持不变
D.混合气体的密度保持不变(4)在温度分别为、时,固定的投入量,起始的物质的量与平衡时的物质的量分数关系如图。
图像中和的关系是:___________。(选填“>”、“<”或“=”)
a、b、c、d四点中,转化率最高的是:___________。
(5)某温度下,向一4L恒容密闭容器中充入和。20min后,的浓度为,用表示的20min内平均反应速率为___________,此时浓度商(Q)的数值为___________。若此时,则Q___________K(填“>”、“<”或“=”,K表示该温度下反应的平衡常数)
(6)电化学法合成氨是常温合成氨的重要研究领域。如图是一种电化学合成氨过程的示意图。
该装置的电极a是___________极,b电极的电极反应式为___________。
16.(2023春·江苏南通·高三海安高级中学校考阶段练习)工厂烟气(主要污染物、NO)直接排放会造成空气污染,需处理后才能排放。
(1)氧化。反应物断键吸收的能量越少,反应速率越快,氧化、NO反应的能量变化如图1和如图2所示。
氧化、NO的反应为:
A.
B.
上述两反应中,反应速率较快的是___________ (填反应编号),反应A___________ (填“放热”或“吸热”) ___________。
(2)某化学兴趣小组构想将NO转化为脱除,装置如图3,电极为多孔惰性材料。则负极的电极反应式是___________。
(3)“纳米零价铁—”体系可将烟气中难溶的NO氧化为可溶的。
在一定温度下,将溶液和HCl溶液雾化后与烟气按一定比例混合,以一定流速通过装有纳米零价铁的反应装置,可将烟气中的NO氧化。
①催化分解产生,将NO氧化为的机理如图4所示,Y的化学式为___________。
②NO与反应生成的化学方程式为___________。
③纳米零价铁的作用是___________。
④NO脱除率随温度的变化如图5所示。温度高于120℃时,NO脱除率随温度升高呈现下降趋势的主要原因是___________。
17.(2023秋·福建龙岩·高三统考期末)氨是基本有机化学工业及氮肥生产的主要原料。回答以下问题:
(1)哈伯法合成氨是目前主流方法。
①该方法存在不少缺点,例如转化率低(10%~15%)、___________(写一条);
②哈伯法使用的氢源含有H2S气体,可以采用ZnO吸收法实现脱硫目的。已知:
;
;
。
脱硫反应的热化学方程式为___________。
(2)电化学合成氨有望解决哈伯法的不足,以NO为氮源通过电解法制取氨气成为研究热点之一、已知酸性溶液中反应时,该过程存在(a)、(b)两种反应历程且均通过五步完成,示意如下:
①两种途径最终ΔH(a)=ΔH(b),理由是___________。
②已知部分键能数据如表:
化学键
N-H
O-H
N-O
键能/kJ·mol-1
389
464
230
相同条件下,(a)、(b)途径中第一步反应的产物能量相对大小为:E(a)___________E(b)(填“>”“<”或“=”)。
③该电化学合成氨的阴极反应式为___________。
(3)我省专家对“氨-氢”燃料电池研究已经取得突破,工作原理如图所示。
①负极电极反应式为___________。
②电极电势较高的区域为___________(填“A”或“B”)。
③当外电路通过1mol电子时,消耗标况下氧气的体积为___________L。
18.(2023·河南·统考三模)为加快实现“双碳”目标,有效应对全球气候变化、构建低碳社会,CO₂资源化利用受到越来越多的关注。
I.Sabatier反应可实现CO₂甲烷化:
反应1 CO₂(g)+4H₂(g) CH₄(g)+2H₂O(g) ΔH=-165kJ⋅mol⁻¹
同时还发生的反应如下:
反应2 CO₂(g)+H₂(g) CO(g)+H₂O(g) ΔH=+41kJ⋅mol⁻¹
(1)已知键能是指气态原子形成1mol化学键释放的能量,上述反应中相关的化学键键能数据如下:
化学键
O-H
C-H
C=O
H-H
键能/(kJ·mol⁻¹)
463
414
802
436
则C(g)+O(g)=CO(g) ΔH=___________kJ⋅mol⁻¹。
(2)向某恒压密闭容器中充入5molCO₂和20molH₂,在不同温度下达到平衡时各含碳元素物质的物质的量n(X)与温度T的关系如下图所示。
①当反应1和反应2均达到化学平衡状态时,维持温度不变,增大容器体积,则反应2的平衡移动方向___________(填“正向移动”“逆向移动”或“不移动”),反应2的平衡常数___________(填“增大”“减小”或“不变”)。
②曲线Y表示的是___________(填含碳元素物质的化学式)的物质的量与温度的关系,曲线Z所表示的物质在800K~1100K之间物质的量增大的原因是___________。
③800K时,反应2的压强平衡常数Kp=___________(计算结果保留两位有效数字,用分压代替浓度,分压=物质的量分数×总压)。
Ⅱ.一种从高炉气回收CO₂制储氢物质HCOOH的综合利用示意图如下:
(3)铂电极上生成HCOOH的电极反应式为___________;电解过程中还伴随着析氢反应,若生成HCOOH的电解效率为80%,当电路中转移1mole⁻时,阴极室溶液的质量增加___________g(CO₂溶解量不计)[B的电解效率=]。
参考答案:
1.C
【详解】A.由题中信息充电时电极a得电子可知,电极a为阴极,则电极b为阳极,电极b与直流电源的正极相连,电极反应式为2Cl--2e-=Cl2↑,A正确;
B.放电时,化学能转化为电能,电极a 反应Na3Ti2(PO4)3-2e-= NaTi2(PO4)3+2Na+,电极b反应Cl2+2e-=2Cl-,氯化钠溶液的浓度增大,B正确;
C.若用该装置作为电解精炼铜的电源,电极a为负极,电极b为正极,则电极b与粗铜电极相连,C错误;
D.放电时,电极b反应Cl2+2e-=2Cl-,外电路通过的电子的数目为1.204×1024即2mol,消耗氯气1mol,质量为71g,D正确;
故答案选C。
2.D
【分析】由图可知,放电时上部铝极失去电子发生氧化反应为负极: ;则下部为正极,得到电子发生还原反应:Ph3N++e−=Ph3N;
【详解】A.由分析可知,放电时,正极的电极反应式为Ph3N++e−=Ph3N,A错误;
B.充电时,上部为阴极,得到电子发生还原反应,阴极的电极反应为,B正确;
C.放电时,阴离子向负极运动,故AlCl向上部电极移动,C正确;
D.Ph3N++e−=Ph3N,理论上每生成1mol Ph3N,铝极反应为,则铝极减少质量为mol×27g/mol=9g,D错误;
故选:D。
3.B
【分析】根据金属的电化学腐蚀原理,在弱碱性的海水中,该电池利用吸氧反应来供电,因此负极反应物为镁,正极反应物为溶解氧。负极反应生成的难溶于水,覆盖在镁电极表面影响电池供电,题目据此解答。
【详解】A.由于溶解氧浓度低,反应速率低,故可用增大电极与海水的接触面积来提高反应速率,故A正确;
B.正极电极反应式为,反应物为溶解氧,海水中含有足量的溶解氧,不需要定期补充,故B错误;
C.负极电极反应式为,生成的氢氧化镁覆盖在电极表面,阻隔电极与海水的接触,致使负极活性衰减,故C正确;
D.Mg较活泼,在合适条件下可直接与水发生析氢反应:,故D正确;
故选B。
4.C
【分析】由装置图可知,A电极上转化为,发生氧化反应,A电极为负极,B电极上发生得电子生成H2O,发生还原反应,B电极为正极。
【详解】A.该电池工作时有菌株参与,不能在高温下工作,A错误;
B.由分析可知,A电极为负极,电极B为正极,原电池工作时电流由正极(B电极)经用电器流入负极(A电极),B错误;
C.A电极是负极,电极上转化为,其电极反应式为,C正确;
D.由原电池工作原理可知,从左室透过质子交换膜移动到右室,D错误;
故答案为:C。
5.A
【分析】由放电时正极发生的反应可知,放电时,电极A为原电池的负极,电极B为正极,锂离子嵌入五氧化二钒中;充电时,与直流电源正极相连的B电极为电解池的阳极,电极A为阴极,锂离子从五氧化二钒中脱嵌。
【详解】A.电池放电时,嵌入电极,没有化合价变化,没有发生还原反应,故A错误;
B.由分析可知,充电时从电极脱嵌导致溶液中浓度不断增大,故B正确;
C.由分析可知,充电时,电极为电解池的阳极,电极A为阴极,所以电极B的电势比电极A的高,故C正确;
D.放电时,电极A每减少6.5g说明有0.1molZn转化为,由得失电子数目守恒可知,有0.2mol嵌入电极B,故D正确;
故选A。
6.B
【分析】氢氧燃料电池中通入燃料H2的一极为负极,电极反应为:H2-2e-=2H+,通入O2等氧化剂的一极为正极,电极反应为:O2+4e-+2H2O=4OH-,据此分析解题。
【详解】A.由分析可知,a电极(通入氢气)是负极,A正确;
B.由分析可知,b电极(通入氧气)是正极,B错误;
C.氢氧燃料电池的产物是水,环保无污染,能源利用率高,且氢来源广泛,是一种具有应用前景的绿色电源,C正确;
D.由图可知,氢氧燃料电池可以在正负极分别通氧气和氢气,则是一种不需要将还原剂和氧化剂全部储藏电池内的新型发电装置,D正确;
故答案为:B。
7.A
【分析】二氧化硫端:二氧化硫与氢氧化钠反应生成,再失去电子生成,为负极,其电极反应为:;氧气端:氧气得电子,与氢离子结合生成过氧化氢,为正极,其电极反应为。
【详解】A.根据分析可知氧气端为正极,正极反应为,A正确;
B.单独脱除SO2是一个熵减的过程,因为此反应可自发进行,因此该反应为放热反应,B错误;
C.反应过程中不需要补加稀硫酸,因为右侧消耗的氢离子数目等于从双极膜中迁移过来的氢离子数目,C错误;
D.根据正负极反应可知协同转化总反应:,D错误;
故选A。
8.C
【分析】石墨上发生,为还原反应,则石墨为正极。
【详解】A.石墨为正极,金属Li为负极,A错误;
B.电子不能在有机电解液中流动,电子流动方向为:锂电极→导线→石墨电极,B错误;
C. 石墨电极上转化为,S元素化合价降低,为还原反应,则电极反应式为,C正确;
D. Li能与水反应,有机电解液不可以换成水性电解液,D错误;
答案选C。
9.C
【分析】由图可知,碱性锌铁液流电池放电时,右侧N极为负极,Zn发生失电子的氧化反应生成,负极发生的电极反应为Zn-2e-+4OH-=,左侧M为正极,正极上发生得电子的还原反应,正极电极反应为+e-=,充电时电极反应和放电时相反。
【详解】A.放电时,M极为正极,发生反应为+e-=,M极附近溶液的pH变化不大,A错误;
B.充电时,N极为阴极,电极反应为+2e-=Zn+4OH-,右侧贮液器中浓度减小,B错误;
C.充电时,N极为阴极,电极反应为+2e-=Zn+4OH-,C正确;
D.放电时,负极区发生的电极反应为Zn-2e-+4OH-=,每转移2mol电子,溶解1molZn,但是有阳离子通过离子交换膜移向M极,因此负极区电解质溶液增重的质量小于65g,D错误;
故答案选C。
10.C
【详解】A.由反应可知,在反应中,Zn被氧化,失电子,应为原电池负极,即X为负极Zn,在正极上得电子被还原,Y溶液中含有,A项正确;
B.电子由负极流向正极,即外电路中的电子由X电极流向Cu电极,B项正确;
C.Cu电极是电池的正极,发生电极反应为,发生还原反应,C项错误;
D.甲池中发生反应,阳离子向正极移动,则溶液中由甲池移向乙池,D项正确;
答案选C。
11.D
【详解】A.该装置为原电池,Zn为活泼金属作负极,Zn失电子发生氧化反应,故A正确;
B.由图中信息可知正极NO得电子生成氨气,电极反应为:,故B正确;
C.双极膜中的向左侧负极移动,向右侧正极移动,故C正确;
D.负极发生反应:,氢氧根浓度减小,pH降低;正极反应式为,氢氧根浓度增大,pH升高,故D错误;
故选:D。
12.B
【分析】根据原电池结构知总反应是Cu与稀硝酸的反应,因此Cu作负极,Pt作正极。
【详解】A.负极Cu失电子生成,负极的电极反应式为:,A正确;
B.电子只能在导体中移动,因此电子流向是Cu棒→电流表→Pt棒,B错误;
C.Pt是惰性正极,正极反应物是稀硝酸,得电子被还原,因此甲烧杯中的逐渐减小,C正确;
D.甲烧杯中发生的反应为:,溶液中正电荷消耗多于负电荷,因此需要从盐桥中补充正电荷,故盐桥中的流向甲烧杯,D正确;
故选B。
13.B
【分析】由电池的总反应,可知Zn为负极,电极反应为:,正极反应式为:MnO2+e-+H2O=MnOOH+OH-,故充电时,与电源负极相连的是阴极,电极反应为:,与电源正极相连为阳极,电极反应为:MnOOH+OH- - e- = MnO2+H2O,据此分析解题。
【详解】A.根据总反应可知,Zn所在电极为负极,即放电时,含有锌膜的碳纳米管纤维作电池负极,A正确;
B.由分析可知,充电时,阴极反应:,B错误;
C.根据高聚物的结构可知,高聚物中存在作用力:极性键、非极性键和氢键,C正确;
D.有机高聚物的结构片段发现可知,是加成聚合产物,合成有机高聚物的单体是:,D正确;
故答案为:B。
14.B
【分析】由题中工作原理图可得电极A发生的反应为,电极B发生的反应为,电解池内部在氮气和氢气在酶的催化下反应生成氨气。
【详解】A.题中A电极上发生氧化反应,B电极发生还原反应,则A为负极,B为正极,正极电势高于负极电势,故电极电势B>A,A错误;
B.由题可知氢化酶上发生反应,固氮酶上发生的反应,左侧电极池中生成的氢离子通过离子交换膜到达右侧电极池,与氮气反应生成氨气,B正确;
C.负极上发生氧化反应,失电子,反应式应为,C错误;
D.生成氨气的总反应为,其中N化合价从0价降为-3价,H化合价从0价升为+1价,则每合成1mol氨气转移3mol电子,D错误;
故选B。
15.(1) N2(g)+3H2(g)=2NH3(g) △H=-92kJ/mol
(2) < T>K
(3)BCD
(4) > c
(5) 1.39 <
(6) 正 略
【详解】(1)由图可知和反应生成焓变△H=(300kJ/mol-254kJ/mol)×2=-92kJ/mol,所以该反应的热化学方程式N2(g)+3H2(g)=2NH3(g) △H=-92KJ/mol,加催化剂,降低活化能,焓变不变,;
(2)N2(g)+3H2(g)=2NH3(g)属于气体体积减小的反应,即熵减,所以a<0;由知K;
(3)A容器中N2、H2、NH3的浓度之比为1∶3∶2是反应可能达到的一个特殊状态,与该反应是否达到平衡状态无关; B反应达平衡前,N2质量分数逐渐减小,当N2质量分数不变时,说明该反应达到平衡状态; C该反应达到平衡前,压强逐渐减小,则容器内压强保持不变说明该反应达到平衡状态;D恒容容器,容积不变,容器内混合气体的质量不变,则混合气体的密度始终不变,故混合气体的密度保持不变不能作为该反应达平衡的标志;
故答案选BCD
(4)该反应为放热反应,其他条件不变,升高温度,平衡左移,的物质的量分数减小,所以T1>T2。起始时氢气的物质的量增加,氢气的浓度增加,平衡右移,N2的转化率增大,所以转化率c>b>a,起始时氢气的物质的量相同,温度由T1降低到T2,转化率增大,所以转化率d>a,故转化率最大的为c,答案:>;c;
(5)根据题意列三段式, 用表示的20min内平均反应速率为 ,此时浓度商的数值Q= ,若此时,反应正向进行,则Q
16.(1) B 放热 241.6
(2)
(3) 或 与HCl溶液反应产生 的分解速率随温度升高而加快,浓度减小,NO脱除率降低
【详解】(1)过渡态物质的总能量与反应物总能量的差值为活化能,即图中峰值越大则活化能越大,峰值越小则活化能越小,活化能越小反应越快,活化能越大反应越慢,决定总反应速率的是慢反应;由图可知,B反应的活化能较小,反应速率较快;反应A中生成物能量低于反应物能量,为放热,放出热量(299.8-58.2)=241.6。
(2)由图可知,左侧NO得到电子发生还原反应生成硝酸根离子,为负极,反应为;
(3)①催化分解产生,则X为,亚铁离子和过氧化氢发生氧化还原反应生成铁离子,则Y为或;
②NO与反应生成,过氧化氢发生还原反应生成水、一氧化氮发生氧化反应生产硝酸,化学方程式为。
③由图可知,反应中亚铁离子作为催化剂,纳米零价铁能和稀盐酸反应生成亚铁离子,提供反应的催化剂。
④过氧化氢不稳定受热易分解,的分解速率随温度升高而加快,浓度减小,NO脱除率降低,故温度高于120℃时,NO脱除率随温度升高呈现下降趋势。
17.(1) 能耗高(或其他合理答案) ZnO(s)+H2S(g)=ZnS(s)+H2O(l),△H=(b+2c-a)kJ·mol-1
(2) 反应的焓变与反应途径无关 < NO+5e-+5H+=NH3+H2O
(3) H2-2e-+O2-=H2O B 5.6
【详解】(1)实际生产中需考虑原料来源、价格、环保、能耗、反应条件,哈伯法合成氨需要高温、高压条件,首先高温能耗大;其次高压对生产设备要求高。ZnO金属氧化物与酸H2S反应为ZnO(s)+H2S(g)=ZnS(s)+H2O(l),由盖斯定律得该反应ΔH=。答案为能耗高(或其他合理答案);ZnO(s)+H2S(g)=ZnS(s)+H2O(l) ;
(2)盖斯定律,反应的焓变与反应途径无关,只与反应的始态和终态有关。无论是a还是b都是NO在酸性条件下转变为NH3和H2O。所以两个历程的焓变相同。a的第一步由NO→NOH即形成了O-H键需要释放出464kJ/mol的能量,而b的第一步由NO→HNO即形成N-H键需要释放出389 kJ/mol的能量。前者释放的能量多于后者,所以得到的产物能量E(a)
18.(1)1073
(2) 正向移动 不变 CO 反应1是放热反应,反应2是吸热反应,此温度范围内,升高温。度,反应1平衡左移使CO2增多的程度大于反应2平衡右移使CO2减少的程度,所以二氧化碳的量增大 0.34
(3) CO2+2H++2e-=HCOOH 18.4
【详解】(1)根据反应2:CO₂(g)+H₂(g) ⇌CO(g)+H₂O(g) ,用E表示键能,则可知
ΔH=2EC=O+EH-H-EC-O-2EH-O=41kJ/mol,代入表格中的数据,得802 kJ/mol×2+436 kJ/mol –
EC≡O-2×463 kJ/mol =41 kJ/mol,得EC≡O=1073 kJ/mol。故C(g)+O(g)=CO(g)的ΔH=1073 kJ/mol。
(2)①对于反应1来说,增加容器的体积相当于减小了各物质的浓度,平衡逆向移动,导致氢气的浓度增大,再对于反应2来说,氢气浓度增大,会导致平衡正向移动。由于温度不变,故反应2的平衡常数不变。
②随着温度的升高,Y的含量不断增加,即平衡正向移动,ΔH>0,故Y为CO的变化曲线;曲线Z表示的是二氧化碳,反应1是放热反应,反应2是吸热反应,此温度范围内,升高温度,反应1平衡左移使二氧化碳增多的程度大于反应2平衡右移使CO2减少的程度,所以二氧化碳的量增大。
③根据三段式,设反应1的转化量为amol,反应2的转化量为bmol,则
由图知平衡时的物质的量是nCO2=1mol=5-a-b,nCO=0.2mol=b,则a=3.8mol,则nH2=4.6mol,nH2O=7.8mol,则总物质的量为17.4mol,设总压为p,则各气体的分压为:
pCO2=,pH2=,pH2O=,pCO=,
则平衡常数Kp=
(3)铂电极上CO2和氢气得到电子生成甲酸,其电极反应为CO2+2H++2e-=HCOOH,当电路中转移1mole⁻时,电解率只有80%,则实际所用的电子只有0.8mol。
根据电极方程式,生成的甲酸的质量为46g/mol×0.4=18.4g,即阴极室溶液的质量增加18.4g
2024届高三新高考化学大一轮专题练习--原电池: 这是一份2024届高三新高考化学大一轮专题练习--原电池,共19页。试卷主要包含了单选题,多选题,非选择题等内容,欢迎下载使用。
2024届高三新高考化学大一轮专题练习:原电池: 这是一份2024届高三新高考化学大一轮专题练习:原电池,共20页。试卷主要包含了单选题,非选择题等内容,欢迎下载使用。
2024届高三新高考化学大一轮专题练习 原电池: 这是一份2024届高三新高考化学大一轮专题练习 原电池,共20页。试卷主要包含了多选题,单选题,非选择题等内容,欢迎下载使用。












