

所属成套资源:2024届高三化学一轮复习培优训练题(67份)
2024届高三化学一轮复习培优--化学反应速率训练
展开这是一份2024届高三化学一轮复习培优--化学反应速率训练,共13页。试卷主要包含了单选题,实验题等内容,欢迎下载使用。
2024届高三化学一轮复习培优--化学反应速率训练
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.在 2A(g)+B(g) ⇌ 3C(g)+4D(g)反应中,下面表示的反应速率最快的是( )
A.v(A)=0.5 mol/(L•s)
B.v(B)=0.005 mol/(L•s)
C.v(C)=0.8 mol/(L•min)
D.v(D)=1.0 mol/(L•min)
2.某化学反应中,反应物B的物质的量浓度在10s内,从4.0mol/L变成了2.0mol/L,则这10s内B的反应速率为
A.0.2mol/(L·s) B.0.5mol/(L·min) C.0.02mol/(L·s) D.0.05mol/L
3.下列为可逆反应: A(g)+ 3B(g) 2C(g)+2D(g)在不同条件下的化学反应速率,其中表示的化学反应速率最快的是
A.v(A)= 0.50 mol·L-1·min-1 B.v(B)=0.2 mol·L-1·s-1
C.v(C)= 0.4 0 mol·L-1·min-1 D.v(D)=0.15 mol·L-1·s-1
4.反应A(g)+3B(g)=2C(g)+2D(g)在不同条件下的化学反应速率,其中反应最快的是
A.v(A)=0.4mol/(L·s) B.v(B)=0.6mol/(L·s)
C.v(C)=0.5mol/(L·s) D.v(D)=0.15mol/(L·s)
5.在容积不变的密闭容器中,A与B反应生成C,其化学反应速率分别用、、表示。已知:、,则该反应可表示为
A. B.
C. D.
6.已知反应4CO+2NO2=N2+4CO2在不同条件下的化学反应速率如下,其中表示反应速率最快的是
a.v(CO)=1.5 mol·L-1·min-1 b.v(NO2)=0.7 mol·L-1·min-1
c.v(N2)=0.4 mol·L-1·min-1 d.v(CO2)=1.1 mol·L-1·min-1
A.a>b>c>d B.b>c>d>a C.d>a>b>c D.a>b>d>c
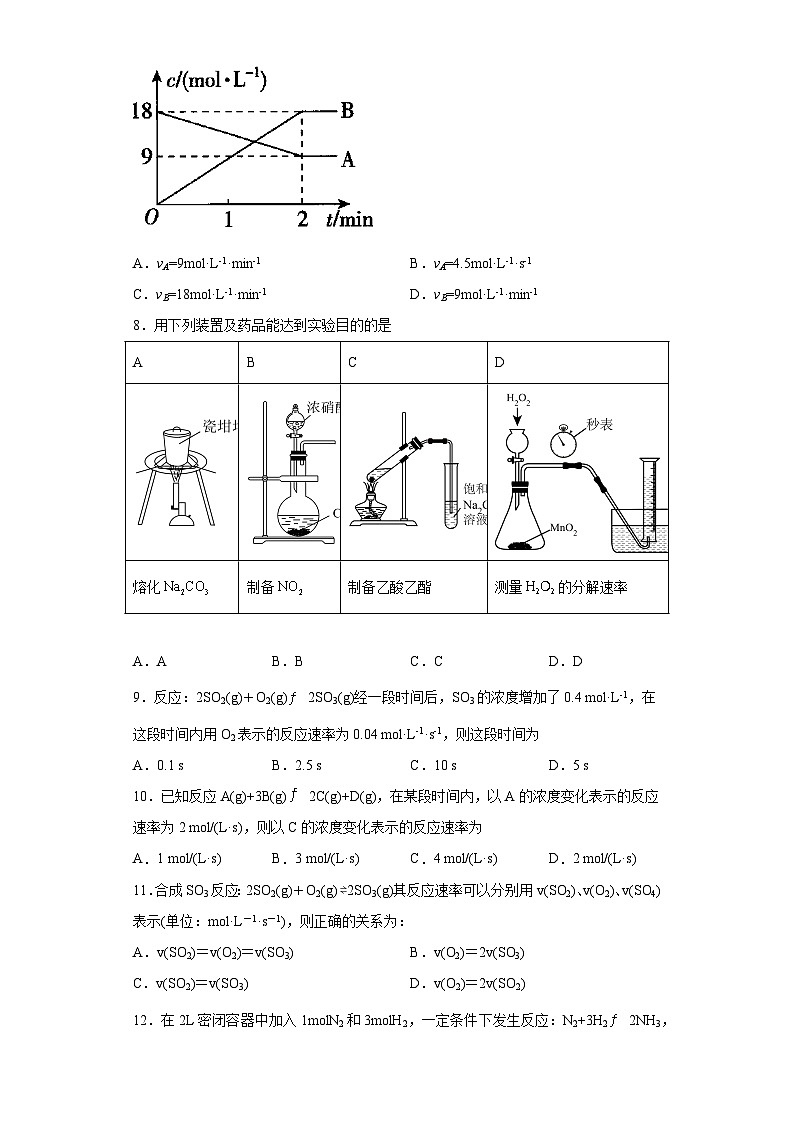
7.在反应A⇌2B中,A、B的浓度变化如图所示,则2min内的平均反应速率为
A.vA=9mol·L-1·min-1 B.vA=4.5mol·L-1·s-1
C.vB=18mol·L-1·min-1 D.vB=9mol·L-1·min-1
8.用下列装置及药品能达到实验目的的是
A | B | C | D |
熔化 | 制备 | 制备乙酸乙酯 | 测量的分解速率 |
A.A B.B C.C D.D
9.反应:2SO2(g)+O2(g)2SO3(g)经一段时间后,SO3的浓度增加了0.4 mol·L-1,在这段时间内用O2表示的反应速率为0.04 mol·L-1·s-1,则这段时间为
A.0.1 s B.2.5 s C.10 s D.5 s
10.已知反应A(g)+3B(g)2C(g)+D(g),在某段时间内,以A的浓度变化表示的反应速率为2 mol/(L·s),则以C的浓度变化表示的反应速率为
A.1 mol/(L·s) B.3 mol/(L·s) C.4 mol/(L·s) D.2 mol/(L·s)
11.合成SO3反应:2SO2(g)+O2(g) ⇌2SO3(g)其反应速率可以分别用v(SO2)、v(O2)、v(SO4)表示(单位:mol·L-1·s-1),则正确的关系为:
A.v(SO2)=v(O2)=v(SO3) B.v(O2)=2v(SO3)
C.v(SO2)=v(SO3) D.v(O2)=2v(SO2)
12.在2L密闭容器中加入1molN2和3molH2,一定条件下发生反应:N2+3H22NH3,半分钟后测得生成0.06molNH3,该时间段内平均反应速率为
A.v(NH3)=0.06mol·L-1·min-1 B.v(H2)=0.04mol·L-1·min-1
C.v(NH3)=0.12mol·L-1·min-1 D.v(N2)=0.24mol·L-1·min-1
13.一定温度下,向容积为2L的密闭容器中通入两种气体发生化学反应生成另外两种气体,反应中各物质的物质的量随时间的变化如图所示,对该反应的推断合理的是
A.该反应的化学方程式为
B.0~1s内,A的平均生成速率大于D的平均生成速率
C.反应时间足够,C的物质的量最终会减小到0
D.反应进行到6s后,反应停止
14.下列说法不正确的是
A.在减压蒸馏时需要用毛细管平衡气压及防止暴沸
B.明矾大晶体的培养一般需要先加入规则的明矾小晶体作为晶核
C.闪光光解技术的时间分辨率达到,主要可用于化学平衡问题的研究
D.无水和无水硫酸铜均可以检验某气体是否潮湿
15.工业上可用生产甲醇,反应为:。将和充入的密闭容器中,测得的物质的量随时间变化如图实线所示。图中虚线表示仅改变某一反应条件时,物质的量随时间的变化,下列说法正确的是( )
A.反应开始至a点时
B.若曲线Ⅰ对应的条件改变是升高温度,则该反应
C.曲线Ⅱ对应的条件改变是降低压强
D.保持温度不变,若将平衡后的容器体积缩小至,重新达平衡时则
二、实验题
16.纳米铁粉可用作隐形材料。一种制备纳米铁粉工艺的实验步骤如下:
①在磁力搅拌作用下,向温度约为80℃的饱和FeSO4溶液中不断加入饱和H2C2O4溶液至不再产生黄色沉淀(FeC2O4·2H2O)为止;
②过滤,用煮沸过的蒸馏水将黄色沉淀洗涤干净;
③干燥固体后,在700℃ 并隔绝空气的条件下将固体焙烧至完全变黑。
(1)步骤①中搅拌的目的是______,每生成0.1 mol FeC2O4·2H2O,生成H2SO4的物质的量为_______mol。
(2)步骤②洗涤用的蒸馏水需预先煮沸的目的是______
(3)步骤③中生成纳米铁的化学方程式为______。
(4)在两支三口烧瓶中盛有相同体积、用硫酸酸化的水样,将其中一支烧瓶中的溶液控制在无氧的条件下,然后分别向烧瓶中加入相同量(足量)的纳米铁粉,测得NO的脱除率与时间的关系如图所示:
①已知在有氧条件下,起始时水样中c(NO)=1.8 × 10-3mol·L-1,则0~4 h内,v(NO)=______mol·L-1·h-1。
②由图可知,3 h前,无氧条件下NO的脱除率明显比有氧条件下的高,其原因是______。
17.化学反应速率是描述化学反应进行快慢的物理量。某同学利用如图所示装置测定化学反应速率。(已知:+2H+=H2O+S↓+SO2↑)
(1)为保证实验的准确性、可靠性,利用该装置进行实验前应先进行的步骤是___________;除如图所示装置的实验用品、仪器外,还需要的一种实验仪器是___________。
(2)若在2min时收集到224mL(已折算成标准状况)气体,可计算出这2min内H+的反应速率,但该测定值比实际值偏小,其原因是___。
(3)试简述测定该反应的反应速率的其他方法:___________(写一种即可)。
18.KI溶液在酸性条件下能与氧气反应。
现有以下实验记录:
实验编号 | ① | ② | ③ | ④ | ⑤ |
温度/℃ | 30 | 40 | 50 | 60 | 70 |
显色时间/s | 160 | 80 | 40 | 20 | 10 |
回答下列问题:
(1)该反应的离子方程式为___。
(2)该实验的目的是__。
(3)实验试剂除了1mol/LKI溶液、0.1mol/LH2SO4溶液外,还需要的试剂是___,实验现象为___。
(4)上述实验操作中除了需要(3)的条件外,还必须控制不变的是__(填字母)。
A.温度
B.试剂的浓度
C.试剂的用量(体积)
D.试剂添加的顺序
(5)由上述实验记录可得出的结论是__。
参考答案:
1.A
【详解】速率大小比较,首先统一单位,将A化为3 mol/(L•min),B化为0.3 mol/(L•min),然后用统一单位后的选项中的速率数值直接除以各自的系数,可知A最大,A项正确。
答案选A。
【点睛】速率大小比较一定先统一单位,同时注意所选取的物质不能为固体或纯液体。
2.A
【详解】由题意知反应物B在10s内浓度变化量是2mol/L,所以其反应速率为,故选A。
3.D
【分析】同一化学反应中,同一段时间内,各物质的反应速率之比等于其计量数之比;先把不同物质的反应速率换算成同一物质的反应速率再进行比较,从而确定选项。
【详解】A.v(A)=0.50 mol·L-1·min-1;
B.v(B)=0.2 mol·L-1·s-1,v(A)= v(B)= ×0.2 mol·L-1·s-1×60s min-1=4 mol·L-1·min-1;
C.v(C)=0.40 mol·L-1·min-1,所以v(A)==0.40 mol·L-1·min-1=0.20 mol·L-1·min-1;
D.v(D)=0.15 mol·L-1·s-1,所以v(A)==0.15 mol·L-1·s-1×60s·min-1=4.5 mol·L-1·min-1;
综上分析,所以反应最快的是D;
故选D。
4.A
【详解】全部转化为A的化学反应速率,则
A.v(A)=0.4mol/(L·s);
B.v(A)=v(B)=0.2mol/(L·s);
C.v(A)=v(C)=0.25mol/(L·s);
D.v(A)=v(D)=0.075mol/(L·s);
因此反应最快的是A,答案选A。
5.C
【分析】对于同一个化学反应,不同的物质表示的反应速率是不同的,但表示的意义是相同的,且反应速率之比等于相应的化学计量数之比。
【详解】根据、可知,v(A)︰v(B)︰v(C)=2︰3︰2,故该反应的化学计量之比为2︰3︰2,方程式即为:;
故选C。
6.C
【分析】同一个化学反应,用不同的物质表示其反应速率时,速率数值可能不同,但表示的意义是相同的,所以比较反应速率快慢时,应该根据速率之比是相应的化学计量数之比先换算成用同一种物质表示,然后才能直接比较速率数值。
【详解】如果该反应都用CO表示反应速率,则:
A.v(CO)=1.5 mol·L-1·min-1;
B.v(CO)=2v(NO2)=2×0.7 mol·L-1·min-1=1.4 mol·L-1·min-1;
C.v(CO)=4v(N2)=4×0.4 mol·L-1·min-1=1.6 mol·L-1·min-1;
D.v(CO)=v(CO2)=1.1 mol·L-1·min-1;
综上所述C表示的速率最快,答案选C。
7.D
【详解】由图可知,2min内,,,则,;
故选D。
8.B
【详解】A.高温时坩埚中二氧化硅与碳酸钠反应,应选铁坩埚,故A错误;
B.Cu与浓硝酸反应生成二氧化氮,图中固液反应装置可制备二氧化氮,故B正确;
C.导管口在碳酸钠溶液的液面下,易发生倒吸,导管口应在液面上,故C错误;
D.生成的氧气易从长颈漏斗逸出,不能测定反应速率,应改为分液漏斗,故D错误;
故选B。
9.D
【详解】SO3的浓度增加了0.4mol·L-1,则根据方程式可知,氧气的浓度就减少了0.2mol/L;又因为在这段时间内用O2表示的反应速率为0.04mol·L-1·s-1,则这段时间为=5s,答案选D。
10.C
【详解】在某段时间内,以A的浓度变化表示的反应速率为2 mol/(L·s),根据反应速率之比是化学计量数之比可知以C的浓度变化表示的反应速率为2 mol/(L·s)×2=4 mol/(L·s)。
答案选C。
11.C
【详解】根据化学反应速率之比等于化学计量数之比
v(SO2):v(O2) :v(SO2)=2:1:2,A项不正确;
v(O2)=v(SO3),B项不正确;
v(SO2)=v(SO3),C项正确;
v(O2)=v(SO2),D项不正确;
故答案选C。
12.A
【详解】由N2+3H22NH3可知,半分钟后测得生成0.06molNH3,v(NH3)==0.06mol·L-1·min-1,由速率之比等于化学计量数之比可知,v(H2)=0.06mol·L-1·min-1×=0.09mol·L-1·min-1,v(N2)=0.06mol·L-1·min-1×=0.03mol·L-1·min-1,A选项符合题意;答案为A。
13.B
【详解】A.由图可知,B、C为反应物,A、D为生成物,B、C、A、D的变化量之比为(1-0.4)mol:(1-0.2)mol:1.2mol:0.4mol=3:4:6:2,该反应的化学方程式为3B(g)+4C(g)6A(g)+2D(g),故A错误;
B.0~1s内,A的物质的量变化量大于D的物质的量变化量,故A的平均生成速率大于D的平均生成速率,故B正确;
C.可逆反应不能进行到底,故C的物质的量最终不会减小到0,故C错误;
D.反应进行到6s后,反应达到平衡,但是反应不会停止,故D错误;
故选B。
14.C
【详解】A.在减压蒸馏时需要用毛细管平衡气压及防止暴沸,故A正确;
B.明矾的溶解度随温度的升高而增大,在培养规则明矾大晶体过程中,需要配制高于室温10~20℃的明矾饱和溶液,选规则明矾小晶体并悬挂在溶液中央,随着自然冷却至室温,明矾饱和溶液变为过饱和溶液,导致明矾析出,明矾晶体会附着在规则明矾小晶体上,形成规则明矾大晶体,故B正确;
C.闪光光解技术主要应用于化学动力学的研究,主要用于化学反应速率问题的研究,故C错误;
D.无水CoCl2为深蓝色,吸水后变为粉红色的水化物,无水硫酸铜为白色,吸水后变为蓝色,均可以检验某气体是否潮湿,故D正确;
故选:C。
15.D
【详解】A.反应开始至a点时,故A不选;
B.若曲线Ⅰ对应的条件改变是升高温度,氢气量增大,平衡逆向移动,即逆向是吸热反应,正反应为放热反应即反应,故B不选;
C.曲线Ⅱ达到平衡时比实线所需时间短,反应速率快,氢气量少,说明是正向移动,则对应的条件改变是加压,故C不选;
D.反应达到平衡时,则,则,生成的,保持温度不变,若将平衡后的容器体积缩小至,则,平衡正向移动,重新达平衡时,根据方程式关系用极限思维,全反应生成,最大浓度为,又由于是可逆反应,反应不完全,因此重新达到平衡,故选D。
答案选D。
16. 使反应物充分接触,加快反应速率 0.1 除去水体中溶解的氧气 FeC2O4∙2H2OFe+2CO2↑+2H2O 3.6×10-4(或0.00036) 有氧时在纳米铁粉表面生成了铁的氧化物,阻碍了 NO的还原反应的进行
【分析】(1)有固体参加的反应,搅拌可增加接触面积,根据方程式得到生成的硫酸的物质的量。
(2)加热煮沸蒸馏水,可减小气体的溶解度。
(3)FeC2O4∙2H2O在700℃并隔绝空气的条件下将固体焙烧至完全变黑,反应生成纳米铁、二氧化碳和水。
(4)①由图象可知有氧条件下,达到4h时NO的脱除率为80%;②有氧条件下,氧气可氧化铁生成铁的氧化物,阻碍与NO的反应。
【详解】(1)步骤①中搅拌的目的是有固体参加的反应,搅拌可增加接触面积,使反应物充分接触,加快反应速率,根据反应方程式FeSO4 + H2C2O4+2H2O = FeC2O4·2H2O+ H2SO4得到每生成0.1 mol FeC2O4·2H2O,生成H2SO4的物质的量为0.1mol;故答案为:使反应物充分接触,加快反应速率;0.1。
(2)步骤②洗涤用的蒸馏水需预先煮沸的目的是加热煮沸蒸馏水,可减小气体的溶解度,除去水体中溶解的氧气,防止亚铁盐被氧化;故答案为:除去水体中溶解的氧气。
(3)步骤③中FeC2O4∙2H2O在700℃ 分解生成纳米铁、CO2和H2O,因此生成纳米铁的化学方程式为FeC2O4∙2H2OFe+2CO2↑+2H2O;故答案为:FeC2O4∙2H2OFe+2CO2↑+2H2O。
(4)①已知在有氧条件下,起始时水样中c(NO)=1.8 × 10−3mol·L−1,则0~4 h内,NO的平均速率为;故答案为:3.6×10−4。
②由图可知,3h前,无氧条件下NO的脱除率明显比有氧条件下的高,其原因是有氧时在纳米铁粉表面生成了铁的氧化物,阻碍了NO的还原反应的进行;故答案为:有氧时在纳米铁粉表面生成了铁的氧化物,阻碍了NO的还原反应的进行。
【点睛】制备实验是常考题型,主要考查增加反应速率的因素、除去水中氧的目的、反应方程式书写,化学反应速率计算等。
17.(1) 检查装置的气密性 秒表
(2)部分SO2溶于水,使得体积偏小
(3)测定一定时间硫单质的质量或者是H+浓度的变化(其他合理答案均可)
【分析】(1)
该反应中需要测量生成的气体体积,所以进行实验前应先检查装置的气密性;本实验需要测定反应速率,根据速率计算公式v=可知,该实验中需要计时,所以还需要的仪器为秒表;
(2)
该速率根据收集的SO2的体积计算速率,但部分SO2溶于水,使得体积偏小,所以测定值比实际值偏小;
(3)
根据方程式可知,测定该反应的反应速率还可以测定一定时间硫单质的质量,也可以测定一定时间内H+浓度的变化。
18. 4I-+4H++O2=2I2+2H2O 探究温度对反应速率的影响 淀粉溶液 无色溶液变蓝色 BCD 每升高10℃,反应速率增大约2倍
【详解】(1)在酸性条件下KI与氧气发生反应产生水和I2,该反应的离子方程式为4H++4I-+O2==2I2+2H2O;
(2)根据表格数据可知该实验是为了探究温度对化学反应速率的影响;
(3)该反应产生I2,I2遇淀粉溶液变为蓝色,因此实验试剂除了1 mol/L KI溶液、0.1 mol/L H2SO4溶液外,还需要加入的显色试剂是淀粉溶液;实验现象为溶液由无色变为蓝色;
(4)上述实验操作中除了需要(3)的条件外,还必须控制不变的是试剂的浓度、试剂的用量(体积)、试剂添加的顺序,因此选项是BCD;
(5)由上述实验记录可得出的结论是每升高10℃,反应速率增大约2倍。
相关试卷
这是一份2024届高三化学一轮复习培优--影响化学反应速率的因素训练,共19页。试卷主要包含了单选题,实验题等内容,欢迎下载使用。
这是一份2024届高三化学一轮复习培优-糖类训练,共22页。试卷主要包含了单选题,实验题等内容,欢迎下载使用。
这是一份2024届高三化学一轮复习培优--卤代烃训练,共19页。试卷主要包含了单选题,实验题等内容,欢迎下载使用。












