





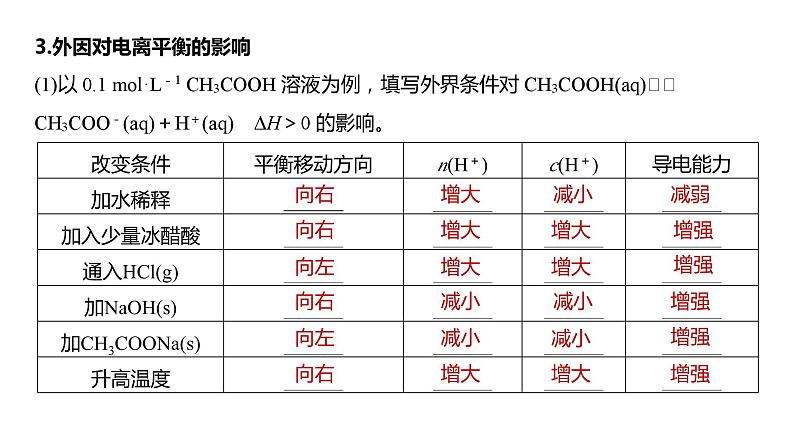
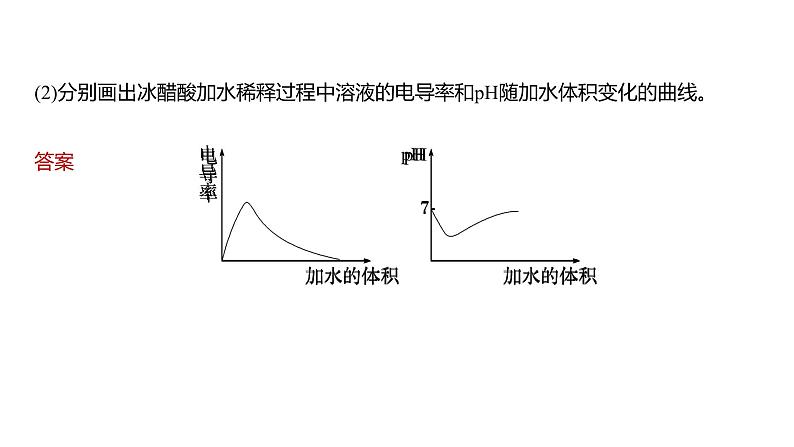








2024年高考化学一轮复习(新高考版) 第9章 第51讲 弱电解质的电离平衡
展开1.下列说法正确的有( )
①不溶于水的盐都是弱电解质 ②可溶于水的盐都是强电解质 ③0.5 mol·L-1一元酸溶液中H+浓度一定为0.5 mol·L-1 ④强酸溶液中的c(H+)不一定大于弱酸溶液中的c(H+) ⑤电解质溶液导电的原因是溶液中有自由移动的阴、阳离子 ⑥熔融的电解质都能导电
A.1个 B.2个 C.3个 D.4个
2.室温下,下列事实不能说明NH3·H2O为弱电解质的是( )
A.0.1 mol·L-1的氨水中c(OH-)<0.1 mol·L-1
B.0.1 mol·L-1的氨水中c(NH)<0.1 mol·L-1
C.相同条件下,浓度均为0.1 mol·L-1的NaOH溶液和氨水,氨水的导电能力弱
D.0.1 mol·L-1的氨水能使无色酚酞溶液变红
3.一定温度下,将一定质量的冰醋酸加水稀释过程中,溶液的导电能力变化如图所示,下列说法正确的是( )
A.a、b、c三点溶液的pH:c<a<b
B.a、b、c三点CH3COOH的电离程度:c<a<b
C.用湿润的pH试纸测量a处溶液的pH,测量结果偏小
D.a、b、c三点溶液用1 mol·L-1NaOH溶液中和,消耗NaOH溶液的体积:c<a<b
4.由于血液中存在如下平衡过程: CO2(g)CO2(aq)、CO2(aq)+H2O(l)H2CO3(aq)、H2CO3(aq)H+(aq)+HCO(aq),使血液的pH维持在7.35~7.45。如超出这个范围会造成酸中毒(pH过低)或碱中毒(pH过高),急性中毒时需静脉注射NH4Cl或NaHCO3进行治疗。下列叙述正确的是( )
A.血液中CO2浓度过高会导致酸中毒,使血液中的值增大
B.治疗碱中毒时,患者需降低呼吸频率,以增加血液中CO2浓度
C.急性酸中毒时,救治方式是静脉注射NH4Cl溶液
D.酸或碱中毒时,会导致血液中的酶发生水解
5.在相同温度下,100 mL 0.1 mol·L-1的醋酸与10 mL 1 mol·L-1的醋酸相比较,下列说法正确的是( )
A.发生中和反应时所需NaOH的量前者大于后者
B.前者的电离程度小于后者
C.所含H+的物质的量前者大于后者
D.所含CH3COOH的物质的量前者大于后者
6.(2022·湖南临澧一中模拟)20 ℃时,将10 mL pH=3的CH3COOH溶液中加水稀释,下列说法正确的是( )
A.溶液中减小
B.溶液中导电粒子数目减少
C.CH3COOH电离度增大,c(H+)也增大
D.向溶液中加入pH=11的NaOH溶液后,pH>7
7.(2022·深圳模拟)硼酸(H3BO3)的电离方程式为H3BO3+H2OB(OH)+H+。已知常温下,Ka(H3BO3)=5.4×10-10、Ka(CH3COOH)=1.75×10-5。下列说法错误的是( )
A.H3BO3为一元酸
B.0.01 mol·L-1 H3BO3溶液的pH≈6
C.常温下,等浓度溶液的pH:CH3COONa>NaB(OH)4
D.NaOH溶液溅到皮肤时,可用大量水冲洗,再涂上硼酸溶液
8.将浓度为0.1 mol·L-1 HF溶液加水稀释,下列各量增大的是( )
①c(H+) ②c(F-) ③c(OH-) ④Ka(HF) ⑤Kw ⑥ ⑦
A.①⑥ B.②④ C.③⑦ D.④⑤
9.(2023·南京模拟)常温下,次氯酸电离平衡体系中各成分的组成分数δ[δ(X)=,X为HClO或ClO-]与pH的关系如图所示。下列有关说法正确的是( )
A.次氯酸的电离方程式为HClO===H++ClO-
B.曲线a、b依次表示δ(ClO-)、δ(HClO)的变化
C.次氯酸电离常数Ka的数量级为10-7
D.向次氯酸溶液中加NaOH溶液,将减小
10.现有HX、H2Y和H2Z三种酸,各酸及其盐之间不发生氧化还原反应,它们的电离常数如表所示。
酸 | 电离常数(25 ℃) |
HX | Ka=10-9.2 |
H2Y | Ka1=10-6.4 Ka2=10-10.3 |
H2Z | Ka1=10-1.9 Ka2=10-7.2 |
下列说法正确的是( )
A.在水溶液中结合H+的能力:Y2-<Z2-
B.0.1 mol·L-1 NaX溶液中离子浓度的关系:c(Na+)<c(X-)
C.Na2Y溶液与过量HX反应的离子方程式:HX+Y2-===HY-+X-
D.25 ℃时,浓度均为0.1 mol·L-1的H2Y和H2Z溶液的pH:H2Y<H2Z
11.25 ℃时,用0.1 mol·L-1的CH3COOH溶液滴定20 mL 0.1 mol·L-1的NaOH溶液,当滴加V mL CH3COOH溶液时,混合溶液的pH=7。已知CH3COOH的电离常数为Ka,忽略混合时引起的溶液体积的变化,下列关系式正确的是( )
A.Ka= B.V=
C.Ka= D.Ka=
12.H2C2O4是一种二元弱酸,H2C2O4溶液中各粒子浓度在其总浓度中所占比值叫其分布系数,常温下某浓度的H2C2O4溶液中各粒子分布系数随pH的变化如图所示,据此分析,下列说法不正确的是( )
A.曲线a代表H2C2O4,曲线b代表C2O
B.常温下0.1 mol·L-1的NaHC2O4溶液显酸性
C.常温下,H2C2O4的电离平衡常数Ka2=10-4.30
D.pH从1.30~4.30时,先增大后减小
13.食醋(主要成分CH3COOH)、纯碱(Na2CO3)和小苏打(NaHCO3)均为家庭厨房中常用的物质。已知:
弱酸 | CH3COOH | H2CO3 | HNO2 | HCN |
电离常数 | Ka=1.8×10-5 | Ka1=4.3×10-7 Ka2=5.6×10-11 | Ka=5.0×10-4 | Ka=6.2×10-10 |
请回答下列问题:
(1)CH3COO-、HCO、CO、NO、CN-结合质子(H+)的能力由小到大的顺序为
________________________________________________________________________。
(2)CO2通入NaNO2溶液中能否生成HNO2?________(填“能”或“否”),理由是
________________________________________________________________________。
(3)少量CO2通入足量NaCN溶液中,反应的离子方程式为______________________。
(4)常温下,将20 mL 0.10 mol·L-1 CH3COOH溶液和20 mL 0.10 mol·L-1 HNO2溶液分别与
20 mL 0.10 mol·L-1 NaHCO3溶液混合(混合后溶液体积变化忽略不计)。
①反应开始时,v(CH3COOH)______v(HNO2)(填“>”“<”或“=”,下同)。
②充分反应后,两溶液中c(CH3COO-)____________________________c(NO)。
(5)25 ℃时,向CH3COOH溶液中加入一定量的NaHCO3,所得溶液的pH=6,则混合液中=__________。
(6)常温下,下列方法可以使0.1 mol·L-1CH3COOH的电离程度增大的是______(填字母)。
a.加入少量的稀盐酸 b.加热溶液
c.加水稀释 d.加入少量冰醋酸
新高考化学一轮复习精品课件 第9章 第51讲 弱电解质的电离平衡 (含解析): 这是一份新高考化学一轮复习精品课件 第9章 第51讲 弱电解质的电离平衡 (含解析),共60页。PPT课件主要包含了电离平衡常数及应用,真题演练明确考向,课时精练等内容,欢迎下载使用。
2024年高考化学一轮复习课件(鲁科版)第8章 第51讲 沉淀溶解平衡: 这是一份2024年高考化学一轮复习课件(鲁科版)第8章 第51讲 沉淀溶解平衡,文件包含第8章第51讲沉淀溶解平衡pptx、第8章第51练沉淀溶解平衡docx、第8章第51讲沉淀溶解平衡docx等3份课件配套教学资源,其中PPT共60页, 欢迎下载使用。
新高考化学一轮复习课件 第8章 第51讲 反应过程溶液粒子浓度变化的图像分析: 这是一份新高考化学一轮复习课件 第8章 第51讲 反应过程溶液粒子浓度变化的图像分析,共60页。PPT课件主要包含了高考化学一轮复习策略,分布系数曲线,真题演练明确考向,课时精练等内容,欢迎下载使用。












