
2024版新教材高考化学复习特训卷课练17化学能与热能
展开课练17 化学能与热能
练
1.为消除目前燃料燃烧时产生的环境污染,同时缓解能源危机,有关专家提出了利用太阳能制取氢能的构想,原理如图所示。下列说法不正确的是( )
A.过程Ⅰ中太阳能转化为化学能
B.过程Ⅱ中化学能转化为电能
C.2 mol H2与1 mol O2的能量之和小于2 mol H2O的能量
D.H2O的分解反应是吸热反应
2.已知:①S(g)+O2(g)===SO2(g) ΔH1;
②S(s)+O2(g)===SO2(g) ΔH2;
③2H2S(g)+O2(g)===2S(s)+2H2O(l) ΔH3
④2H2S(g)+3O2(g)===2SO2(g)+2H2O(l) ΔH4;
⑤SO2(g)+2H2S(g)===3S(s)+2H2O(l) ΔH5。
下列关于上述反应焓变的判断不正确的是( )
A.ΔH1<ΔH2
B.ΔH3<ΔH4
C.ΔH5=ΔH3-ΔH2
D.2ΔH5=3ΔH3-ΔH4
3.下列关于热化学反应的描述中正确的是( )
A.已知H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ· mol-1,则H2SO4和Ba(OH)2反应:H2SO4(aq)+Ba(OH)2(aq)===BaSO4(s)+2H2O(l)的反应热ΔH=2×(-57.3)kJ· mol-1
B.燃料电池中将甲醇蒸气转化为氢气的热化学方程式是CH3OH(g)+O2(g)===CO2(g)+2H2(g) ΔH=-192.9 kJ· mol-1,则CH3OH(g)的燃烧热为192.9 kJ· mol-1
C.H2(g)的燃烧热是285.8 kJ· mol-1,则2H2O(g)===2H2(g)+O2(g) ΔH=+571.6 kJ· mol-1
D.葡萄糖的燃烧热是2 800 kJ· mol-1,则 C6H12O6(s)+3O2(g)===3CO2(g)+3H2O(l) ΔH=-1 400 kJ· mol-1
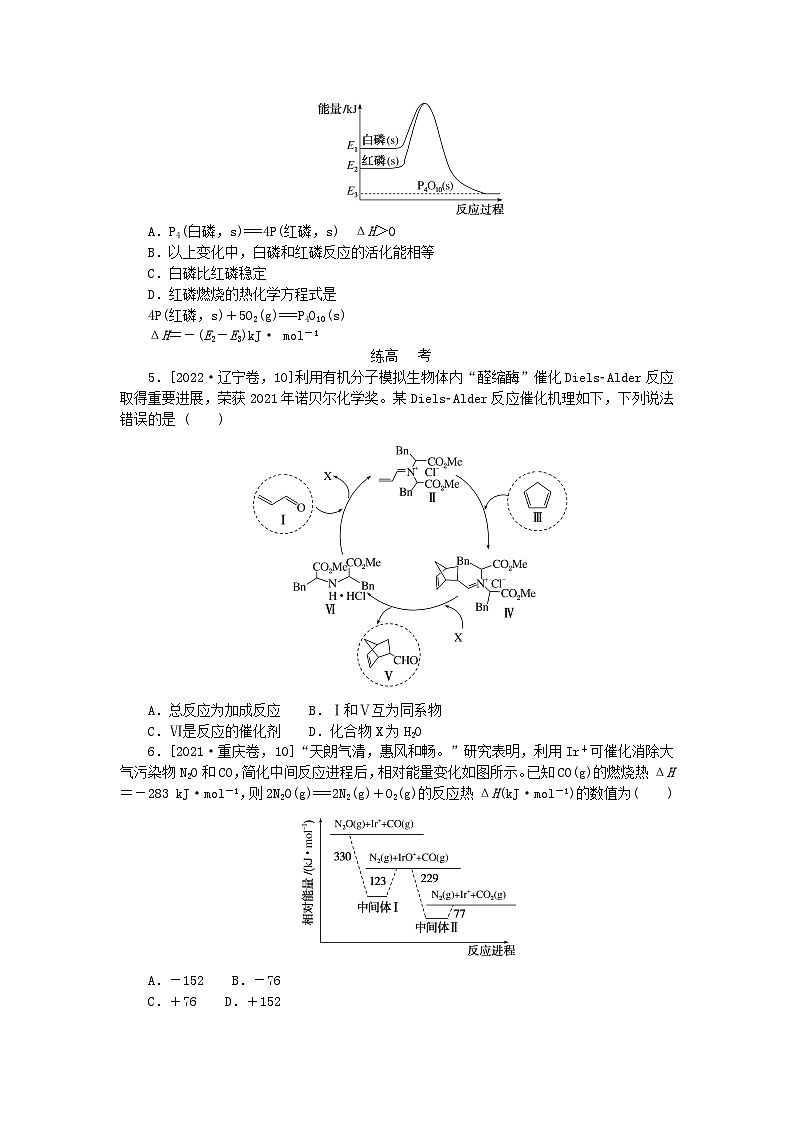
4.1 mol 白磷(P4,s)和4 mol 红磷(P,s)与氧气反应过程中的能量变化如图(E表示能量)。下列说法正确的是( )
A.P4(白磷,s)===4P(红磷,s) ΔH>0
B.以上变化中,白磷和红磷反应的活化能相等
C.白磷比红磷稳定
D.红磷燃烧的热化学方程式是
4P(红磷,s)+5O2(g)===P4O10(s)
ΔH=-(E2-E3)kJ· mol-1
练
5.[2022·辽宁卷,10]利用有机分子模拟生物体内“醛缩酶”催化DielsAlder反应取得重要进展,荣获2021年诺贝尔化学奖。某DielsAlder反应催化机理如下,下列说法错误的是 ( )
A.总反应为加成反应 B.Ⅰ和Ⅴ互为同系物
C.Ⅵ是反应的催化剂 D.化合物X为H2O
6.[2021·重庆卷,10]“天朗气清,惠风和畅。”研究表明,利用Ir+可催化消除大气污染物N2O和CO,简化中间反应进程后,相对能量变化如图所示。已知CO(g)的燃烧热ΔH=-283 kJ·mol-1,则2N2O(g)===2N2(g)+O2(g)的反应热ΔH(kJ·mol-1)的数值为( )
A.-152 B.-76
C.+76 D.+152
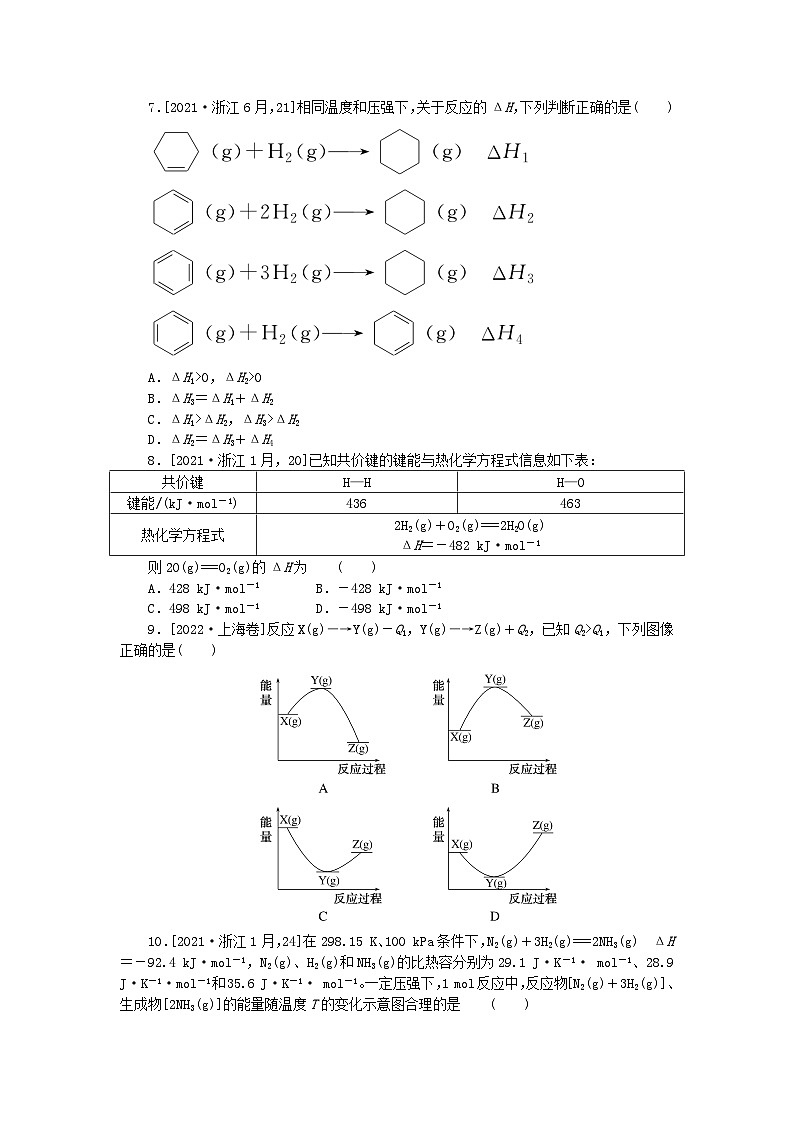
7.[2021·浙江6月,21]相同温度和压强下,关于反应的ΔH,下列判断正确的是( )
A.ΔH1>0,ΔH2>0
B.ΔH3=ΔH1+ΔH2
C.ΔH1>ΔH2,ΔH3>ΔH2
D.ΔH2=ΔH3+ΔH4
8.[2021·浙江1月,20]已知共价键的键能与热化学方程式信息如下表:
共价键
H—H
H—O
键能/(kJ·mol-1)
436
463
热化学方程式
2H2(g)+O2(g)===2H2O(g)
ΔH=-482 kJ·mol-1
则2O(g)===O2(g)的ΔH为 ( )
A.428 kJ·mol-1 B.-428 kJ·mol-1
C.498 kJ·mol-1 D.-498 kJ·mol-1
9.[2022·上海卷]反应X(g)―→Y(g)-Q1,Y(g)―→Z(g)+Q2,已知Q2>Q1,下列图像正确的是( )
10.[2021·浙江1月,24]在298.15 K、100 kPa条件下,N2(g)+3H2(g)===2NH3(g) ΔH=-92.4 kJ·mol-1,N2(g)、H2(g)和NH3(g)的比热容分别为29.1 J·K-1· mol-1、28.9 J·K-1·mol-1和35.6 J·K-1· mol-1。一定压强下,1 mol反应中,反应物[N2(g)+3H2(g)]、生成物[2NH3(g)]的能量随温度T的变化示意图合理的是 ( )
练
11.[2023·南通一轮]关于中和热,下列说法正确的是( )
A.在稀溶液中,任何酸与碱发生中和反应生成1 mol H2O(l)时放出的热量均为57.3 kJ
B.测定中和热过程中,实验前用温度计测量NaOH溶液的温度后,立刻测定盐酸的温度
C.H2SO4(aq)+Ba(OH)2(aq)===BaSO4(s)+H2O(l),该反应ΔH=-57.3 kJ· mol-1
D.中和热的测定实验中,可选择50 mL 0.5 mol·L-1稀盐酸和50 mL 0.55 mol·L-1 NaOH溶液进行实验
12.[2023·大连质检]化学工作者通过密度泛函数理论研究CF3O2(一种自由基,结构可表示为)与NO的反应机理,其三个反应路径与相对能量的关系如图所示,其中TS为过渡态物质,IM为中间体。下列说法正确的是( )
A.CF3O2中每个原子均满足8电子稳定结构
B.稳定性:NO2<NOO
C.制约反应路径③反应速率的步骤是IM3―→TS5
D.反应路径②的产物能量最低,反应最易进行
13.[2023·连云港一轮]CO和H2在一定条件下可合成甲醇,发生反应CO(g)+2H2(g)⇌CH3OH(g),两种反应过程中能量的变化曲线如图中a、b所示,下列说法正确的是( )
A.该反应的活化能为510 kJ·mol-1
B.题述反应的ΔH=-91 kJ·mol-1
C.曲线b对应的反应过程的反应速率:第Ⅱ阶段<第Ⅰ阶段
D.曲线b对应的反应过程使用催化剂后降低了反应的活化能和ΔH
14.[2023·开封质检]氨的催化氧化是工业制硝酸的基础。已知下列热化学方程式:
①N2(g)+3H2(g)⇌2NH3(g) ΔH1;
②N2(g)+O2(g)⇌2NO(g)
ΔH2=+180.5 kJ·mol-1;
③4NH3(g)+5O2(g)⇌4NO(g)+6H2O(g)
ΔH3=a kJ·mol-1。
某条件下,合成氨反应的能量变化曲线如图所示,部分化学键的键能数据如表所示。
化学键
H—H
O===O
H—O
键能/(kJ·mol-1)
436.0
497.3
462.8
下列说法正确的是( )
A.升高温度有利于提高合成氨反应的产率和反应速率
B.氢气的燃烧热为240.95 kJ·mol-1
C.a=-900.7
D.向密闭容器中充入4 mol NH3和5 mol O2,充分反应,放出的热量为|a| kJ
一、选择题:本题共10小题,每小题只有一个选项符合题意。
1.如图为通过两种途径制备硫酸的过程(反应条件略),下列说法不正确的是( )
A.途径②增大O2浓度可提高SO2转化率
B.含1 mol H2SO4的浓溶液与足量NaOH反应,放出的热量即为中和热
C.途径②中SO2和SO3均属于酸性氧化物
D.若ΔH1<ΔH2+ΔH3,则2H2O2(aq)===2H2O(l)+O2(g)为放热反应
2.合成氨原料中的H2可用甲烷在高温条件下与水蒸气反应制得。部分1 mol 物质完全燃烧生成常温下稳定氧化物的ΔH数据如下表:
物质
ΔH/(kJ· mol-1)
H2(g)
-285.8
CO(g)
-283.0
CH4(g)
-890.3
已知1 mol H2O(g)转化生成1 mol H2O(l)时放出热量44.0 kJ。下列CH4和水蒸气在高温下反应得到H2和CO的热化学方程式正确的是( )
A.CH4(g)+H2O(g)===CO(g)+3H2(g)
ΔH1=+206.1 kJ· mol-1
B.CH4(g)+H2O(g)===CO(g)+3H2(g)
ΔH2=-206.1 kJ· mol-1
C.CH4(g)+H2O(g)===CO(g)+3H2(g)
ΔH3=+365.5 kJ· mol-1
D.CH4(g)+H2O(g)===CO(g)+3H2(g)
ΔH4=-365.5 kJ· mol-1
3.通过以下反应均可获取H2。下列有关说法正确的是( )
①太阳光催化分解水制氢:2H2O(l)===
2H2(g)+O2(g) ΔH1=571.6 kJ· mol-1
②焦炭与水反应制氢:C(s)+H2O(g)===
CO(g)+H2(g) ΔH2=131.3 kJ· mol-1
③甲烷与水反应制氢:CH4(g)+H2O(g)===
CO(g)+3H2(g) ΔH3=206.1 kJ· mol-1
A.反应①中电能转化为化学能
B.反应②为放热反应
C.反应③使用催化剂,ΔH3减小
D.反应CH4(g)===C(s)+2H2(g)的ΔH=74.8 kJ· mol-1
4.化学反应放出或吸收的能量称为反应热。反应热(ΔH)又因化学反应的分类给予不同的名称。如我们学过的燃烧热(ΔHc),又如由稳定单质化合生成1 mol 纯物质的热效应称为生成热(ΔHf),断裂化学键时,所吸收的能量称为键能(ΔHb)。下面两个图中的数据分别表示水与二氧化碳各1 mol 分解时能量变化的示意图,图中的各数据均以kJ为单位,下列说法正确的是( )
A.H2O(g)的生成热:ΔHf=243 kJ· mol-1
B.CO(g)的燃烧热:ΔHc=-570 kJ· mol-1
C.O—H键的键能:ΔHb=436 kJ· mol-1
D.CO(g)+H2O(g)===CO2(g)+H2(g)
ΔH=-42 kJ· mol-1
5.335 ℃时,在恒容密闭反应器中1.00 mol C10H18(l)催化脱氢的反应过程如下:
反应1:C10H18(l)⇌C10H12(l)+3H2(g) ΔH1
反应2:C10H12(l)⇌C10H8(l)+2H2(g) ΔH2
测得C10H12和C10H8的产率x1和x2(以物质的量分数计)随时间的变化关系及反应过程中能量的变化如图所示。下列说法错误的是( )
A.使用催化剂能改变反应历程
B.更换催化剂后ΔH1、ΔH2也会随之改变
C.8 h时,反应1、2都未处于平衡状态
D.x1显著低于x2,是由于反应2的活化能比反应1的小,反应1生成的C10H12很快转变成C10H8
6.以TiO2为催化剂的光热化学循环分解CO2反应为温室气体减排提供了一个新途径,该反应的机理及各分子化学键完全断裂时的能量变化如下图所示:
下列说法正确的是( )
A.过程①中钛氧键断裂会释放能量
B.该反应中,光能和热能转化为化学能
C.使用TiO2作催化剂可以降低反应的焓变,从而提高化学反应速率
D.CO2分解反应的热化学方程式为
2CO2(g)===2CO(g)+O2(g) ΔH=+30 kJ· mol-1
7.工业制氢气的一个重要反应是:CO(g)+H2O(g)===CO2(g)+H2(g)。已知在25 ℃时:
①C(s)+O2(g)===CO(g) ΔH1=-111 kJ· mol-1
②H2(g)+O2(g)===H2O(g)
ΔH2=-242 kJ· mol-1
③C(s)+O2(g)===CO2(g) ΔH3=-394 kJ· mol-1
下列说法不正确的是( )
A.25 ℃时,CO(g)+H2O(g)===CO2(g)+H2(g) ΔH=-41 kJ· mol-1
B.增大压强,反应①的平衡向逆反应方向移动,平衡常数K减小
C.反应①达到平衡时,每生成1 mol CO的同时生成0.5 mol O2
D.反应②断开2 mol H2和1 mol O2中的化学键所吸收的能量比形成4 mol O—H键所放出的能量少484 kJ
8.挥发性有机物(VOCs)对环境易造成污染,VOCs催化燃烧处理技术具有净化率高、燃烧温度低、无明火、不会有NOx等二次污染物产生等优点。图甲是VOCs处理过程中固体催化剂的催化原理,图乙是反应过程中的能量变化图。下列叙述不正确的是( )
A.图甲中固体催化剂表面既有化学键断裂,也有化学键形成
B.图甲中固体催化剂不能提高VOCs的平衡转化率
C.图乙中曲线Ⅱ使用了固体催化剂,反应活化能降低
D.VOCs催化氧化过程中所有反应均为放热反应
9.氮及其化合物的转化过程如图1所示,其中图2为反应①过程中能量变化的曲线图。下列分析合理的是( )
A.N2和H2被吸附在催化剂a表面发生反应
B.反应①的热化学方程式为N2(g)+3H2(g)===2NH3(g) ΔH=+92 kJ· mol-1
C.反应②中,转移1.25 mol 电子时消耗NH3的体积为5.6 L
D.催化剂a、b能提高反应速率和平衡转化率
10.已知:1 mol C(s)燃烧生成CO(g)放出110.4 kJ 热量,Cu2O与O2反应的能量变化如图所示。下列叙述正确的是( )
A.C(s)的燃烧热为110.4 kJ· mol-1
B.1 mol CuO分解生成Cu2O放出73 kJ热量
C.反应2Cu2O(s)+O2(g)===4CuO(s)的活化能为640 kJ· mol-1
D.足量炭粉与CuO反应生成Cu2O的热化学方程式为C(s)+2CuO(s)===Cu2O(s)+CO(g) ΔH=+35.6 kJ· mol-1
二、非选择题:本题共3小题。
11.氯及其化合物在生产、生活中应用广泛。
(1)已知:①Cl2(g)+2NaOH(aq)===NaCl(aq)+NaClO(aq)+H2O(l) ΔH1=-101.1 kJ· mol-1
②3NaClO(aq)===NaClO3(aq)+2NaCl(aq)
ΔH2=-112.2 kJ· mol-1
则反应3Cl2(g)+6NaOH(aq)===
5NaCl(aq)+NaClO3(aq)+3H2O(l)的ΔH=________kJ· mol-1。
(2)几种含氯离子的相对能量如表所示:
离子
Cl-
(aq)
ClO-
(aq)
ClO
(aq)
ClO
(aq)
ClO
(aq)
相对能量/
(kJ·mol-1)
0
60
101
63
38
①在上述五种离子中,最稳定的离子是________(填离子符号,下同),最不稳定的离子是________。
②写出ClO反应生成ClO和Cl-的热化学方程式:________________________________________________________________________
________________________________________________________________________。
(3)以HCl为原料,用O2氧化制取Cl2,可提高效益,减少污染。反应如下:
4HCl(g)+O2(g)2Cl2(g)+2H2O(g) ΔH=-115.4 kJ· mol-1
上述反应在同一反应器中,通过控制合适条件,分两步循环进行,可使HCl转化率接近100%。其基本原理如图所示:
已知过程Ⅰ的反应为2HCl(g)+CuO(s)CuCl2(s)+H2O(g)
ΔH1=-120.4 kJ· mol-1
①过程Ⅱ反应的热化学方程式为________________________________________________________________________
________________________________________________________________________。
②过程Ⅰ流出的气体通过稀NaOH溶液(含少量酚酞)进行检测,氯化初期主要为不含HCl的气体,判断氯化结束时溶液的现象为________________________________________________________________________
________________________________________________________________________。
12.(1)以CO2和NH3为原料合成尿素是利用CO2的成功范例。在尿素合成塔中的主要反应可表示如下:
反应Ⅰ:2NH3(g)+CO2(g)⇌
NH2COONH4(s) ΔH1
反应 Ⅱ:NH2COONH4(s)⇌CO(NH2)2(s)+H2O(g) ΔH2=+72.49 kJ· mol-1
总反应:2NH3(g)+CO2(g)⇌CO(NH2)2(s)+H2O(g) ΔH3=-86.98 kJ· mol-1
则反应Ⅰ的ΔH1=________kJ· mol-1。
(2)氢气可将CO2还原为甲烷,反应为
CO2(g)+4H2(g)⇌CH4(g)+2H2O(g)。ShyamKattel等结合实验与计算机模拟结果,研究了在Pt/SiO2催化剂表面上CO2与H2的反应历程,前三步历程如图所示,其中吸附在Pt/SiO2催化剂表面用“·”标注,Ts表示过渡态。物质吸附在催化剂表面,形成过渡态的过程会________(填“放出热量”或“吸收热量”);反应历程中最小能垒(活化能)步骤的化学方程式为__________________________。
(3)已知CO(g)、CH4(g)、CH3CHO(l)的燃烧热分别为283.0 kJ· mol-1、890.31 kJ· mol-1、1 167.9 kJ· mol-1,则乙醛的分解反应CH3CHO(l)⇌CH4(g)+CO(g)的ΔH=________。
13.
实验室用50 mL 0.50 mol·L-1盐酸、50 mL 0.55 mol·L-1 NaOH溶液和如图所示装置进行中和反应反应热的测定实验,得到如表所示数据:
实验次数
起始温度t1/℃
终止温度t2/℃
盐酸
氢氧化钠溶液
1
20.2
20.3
23.7
2
20.3
20.5
23.8
3
21.5
21.6
24.9
(1)实验时还需要使用的仪器是__________。
(2)在操作正确的前提下,提高中和热测定准确性的关键是______________________。
(3)根据表中所测数据进行计算,则该实验测得的中和热ΔH=________[盐酸和NaOH溶液的密度按1 g·cm-3计算,反应后混合溶液的比热容(c)按4.18 J·g-1·℃-1计算,结果保留1位小数]。
(4)如用0.5 mol·L-1的盐酸与NaOH固体进行实验,则实验中测得的“中和热”数值将________(填“偏大”“偏小”或“不变”)。如改用60 mL 0.5 mol·L-1的盐酸与50 mL 0.55 mol·L-1的NaOH溶液进行反应,与上述实验相比,所放出的热量________(填“相等”或“不相等”),所求中和热________(填“相等”或“不相等”)。
(5)上述实验结果与57.3 kJ·mol-1相比有偏差,产生偏差的原因可能是________(填序号)。
A.测量盐酸的温度后,温度计没有用水冲洗干净
B.把量筒中的氢氧化钠溶液倒入小烧杯时动作迟缓
C.进行本实验的当天室温较高
D.大烧杯的盖板中间小孔太大
课练17 化学能与热能
狂刷小题 夯基础
[练基础]
1.C 过程Ⅰ在太阳能的作用下水分解为氢气和氧气,太阳能转化为化学能,A项不符合题意;过程Ⅱ为氢氧燃料电池放电过程,化学能转化为电能,B项不符合题意;2H2+O2===2H2O为放热反应,因此2 mol H2与1 mol O2的能量之和大于2 mol H2O的能量,C项符合题意;2H2+O2===2H2O为放热反应,故H2O的分解反应为吸热反应,D项不符合题意。
2.B 等量的S具有的能量:S(g)>S(s),则等量的S(g)完全燃烧生成SO2(g)放出的热量多,故有ΔH1<ΔH2,A正确。等量H2S(g)完全燃烧生成SO2(g)放出的热量比不完全燃烧生成S(s)放出的热量多,则有ΔH3>ΔH4,B错误。根据盖斯定律,由③-②可得⑤,则有ΔH5=ΔH3-ΔH2,C正确。根据盖斯定律,由③×3-⑤×2可得④,则有2ΔH5=3ΔH3-ΔH4,D正确。
3.D 反应过程中除了H+和OH-反应放热,BaSO4沉淀的生成也伴随有反应热的变化,即H2SO4和Ba(OH)2反应的反应热ΔH≠2×(-57.3)kJ· mol-1,故A错误;CH3OH(g)的燃烧热为1 mol 甲醇蒸气燃烧转化为二氧化碳和液态水放出的热量,不能生成氢气,故B错误;H2(g)的燃烧热是285.8 kJ· mol-1,则2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ·mol-1,2H2O(l)===2H2(g)+O2(g) ΔH=+571.6 kJ· mol-1,故C错误;由葡萄糖的燃烧热是2 800 kJ· mol-1可知,0.5 mol 葡萄糖完全燃烧生成稳定的氧化物放出的热量为1 400 kJ,即C6H12O6(s)+3O2(g)===3CO2(g)+3H2O(l) ΔH=-1 400 kJ· mol-1,故D正确。
4.D 等质量的红磷能量比白磷低,A中变化应为放热反应,ΔH<0。B中,由图可知,红磷和白磷转变成的活化分子的能量相等,则红磷的活化能更高。C中红磷应比白磷稳定。
[练高考]
5.B 由图可知,总反应为+,该反应为加成反应,A项正确;结构相似、分子组成上相差若干个CH2原子团的有机物互为同系物,和结构不相似、分子组成上也不是相差若干个CH2原子团,两者不互为同系物,B项错误;由图可知,反应先消耗Ⅵ,最后又生成了Ⅵ,所以Ⅵ是反应的催化剂,C项正确;Ⅰ+Ⅵ―→X+Ⅱ,由Ⅰ、Ⅵ、Ⅱ的结构简式可知,X为H2O,D项正确。
6.A 根据题目信息可知,①CO(g)+O2(g)===CO2(g) ΔH=-283 kJ·mol-1,根据图像可知,②N2O(g)+CO(g)===N2(g)+CO2(g) ΔH=-(330-123+229-77)kJ·mol-1=-359 kJ·mol-1,根据盖斯定律,由(②-①)×2可得2N2O(g)===2N2(g)+O2(g) ΔH=-152 kJ·mol-1,A项正确。
8.D 2O(g)===O2(g)的过程形成O===O共价键,是放热过程,其ΔH等于负的O===O共价键的键能,A、C错误;对于热化学方程式2H2(g)+O2(g)===2H2O(g) ΔH=-482 kJ·mol-1,根据键能与焓变的关系ΔH=2E(H—H)+E(O===O)-4E(O—H),可计算得E(O===O)=-482 kJ·mol-1+4×463 kJ·mol-1-2×436 kJ·mol-1=498 kJ·mol-1,B错误,D正确。
9.A 由题目信息可知,X→Y为吸热反应,Y→Z为放热反应,结合Q2>Q1可知,A正确。
10.B 根据热化学方程式可知,该反应为放热反应,反应物的总能量大于生成物的总能量,C、D错误;升高温度,N2(g)、H2(g)和NH3(g)的能量都升高,升高的能量可以根据比热容计算,反应物[N2(g)+3H2(g)]能量升高值为(29.1+3×28.9)×ΔT、生成物[2NH3(g)]的能量升高值为(2×35.6)×ΔT,则升高温度后,反应物的总能量与生成物的总能量的差值(焓变的绝对值)更大了,A错误,B正确。
[练模拟]
11.D 在稀溶液中,强酸与强碱发生中和反应生成可溶性盐及1 mol H2O(l)时放出的热量均为57.3 kJ,A错误;测定中和热过程中,实验前用温度计测量NaOH溶液的温度后,水洗后擦干,再测定盐酸的温度,B错误;强酸与强碱发生中和反应生成可溶性盐及1 mol H2O(l)时放出的热量为57.3 kJ,而生成硫酸钡沉淀也要放出热量,故0.5 mol H2SO4(aq) 和0.5 mol Ba(OH)2(aq)反应放出的热量大于57.3 kJ,C错误;为了保证盐酸完全被中和,氢氧化钠溶液浓度可略大于盐酸,故中和热的测定实验中,可选择50 mL 0.5 mol·L-1稀盐酸和50 mL 0.55 mol·L-1 NaOH溶液进行实验,D正确。
12.C CF3O2是一种自由基,则其中1个氧原子含单电子,则该氧原子周围为7个电子,且不稳定,A项错误。对比反应路径①和③可知,两个路径均生成CF3O,且路径①的产物CF3O+NO2比路径③的产物CF3O+NOO的能量低,故NO2的能量比NOO的低,则稳定性:NO2>NOO,B项错误。反应路径③中IM3生成TS5的活化能最大,而活化能越大,反应速率越小,反应速率小的反应步骤制约总反应过程的反应速率,C项正确。对比题图中的3个反应路径,反应路径①的活化能最低,则反应最容易进行,反应进行的难易程度与产物的能量没有关系,D项错误。
13.B A项,反应物分子与活化分子的能量差即为该反应的活化能,为419 kJ·mol-1,其逆反应的活化能为510 kJ·mol-1,错误。B项,不了解焓变与活化能的关系而错解。焓变=正反应的活化能-逆反应的活化能,即ΔH=419 kJ·mol-1-510 kJ·mol-1=-91 kJ·mol-1,正确。C项,混淆活化能和反应速率之间的关系而出错。活化能越小反应速率越快,由题图知第Ⅱ阶段的活化能小于第Ⅰ阶段,所以反应速率:第Ⅱ阶段>第Ⅰ阶段,错误。D项,催化剂只能降低反应的活化能,不能改变反应的ΔH,错误。
14.C 根据题图可知,ΔH1=正反应的活化能-逆反应的活化能=508 kJ·mol-1-600 kJ·mol-1=-92 kJ·mol-1,故合成氨反应为放热反应,升高温度,平衡逆向移动,产率下降,但升高温度能够提高反应速率,A错误。根据题表中的键能数据可得④2H2(g)+O2(g)===2H2O(g) ΔH4,ΔH4=反应物的总键能-生成物的总键能=2×436.0 kJ·mol-1+497.3 kJ·mol-1-2×2×462.8 kJ·mol-1=-481.9 kJ·mol-1,氢气的燃烧热是1 mol氢气完全燃烧生成液态水所释放的热量,气态水变为液态水会释放热量,故氢气的燃烧热应大于240.95 kJ·mol-1,B错误。结合盖斯定律可知3×④-2×①+2×②=③,故ΔH3=3ΔH4-2ΔH1+2ΔH2=3×(-481.9 kJ·mol-1)-2×(-92 kJ·mol-1)+2×180.5 kJ·mol-1=-900.7 kJ·mol-1,则a=-900.7,C正确。向密闭容器中充入4 mol NH3和5 mol O2,充分反应,因该反应为可逆反应,反应不能完全进行,故放出的热量应小于|a| kJ,D错误。
综合测评 提能力
1.B 增大一种反应物的浓度可以增大另外一种反应物的转化率,故途径②增大O2浓度可提高SO2转化率,A正确;中和热是指稀溶液中强酸与强碱反应生成1 mol水放出的热量,而含1 mol H2SO4的浓溶液与足量NaOH反应生成2 mol水,且浓溶液稀释时放热,B错误;二氧化硫与三氧化硫均属于酸性氧化物,C正确;根据图示可得①SO2(g)+H2O2(aq)===H2SO4(aq) ΔH1,②SO2(g)+O2(g)===SO3(g) ΔH2,③SO3(g)+H2O(l)===H2SO4(aq) ΔH3,根据盖斯定律,由2×①-2×②-2×③可得热化学方程式2H2O2(aq)===2H2O(l)+O2(g)的ΔH=2ΔH1-2ΔH2-2ΔH3,若ΔH1<ΔH2+ΔH3,则ΔH<0,为放热反应,D正确。
2.A 根据已知信息可以写出下列热化学方程式:
①H2(g)+O2(g)===H2O(l) ΔH1=-285.8 kJ· mol-1
②CO(g)+O2(g)===CO2(g) ΔH2=-283.0 kJ· mol-1
③CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH3=-890.3 kJ· mol-1
④H2O(g)===H2O(l) ΔH4=-44.0 kJ· mol-1
根据盖斯定律,由③+④-②-①×3可得CH4(g)+H2O(g)===CO(g)+3H2(g) ΔH=ΔH3+ΔH4-ΔH2-ΔH1×3=-890.3 kJ· mol-1-44.0 kJ· mol-1+283.0 kJ· mol-1+285.8 kJ· mol-1×3=+206.1 kJ· mol-1。
3.D 反应①中是光能转化为化学能,A错误;反应②中ΔH>0,为吸热反应,B错误;催化剂只降低反应的活化能,不影响反应的焓变,C错误;根据盖斯定律,目标反应可由反应③-②获得,ΔH=206.1 kJ· mol-1-131.3 kJ· mol-1=74.8 kJ· mol-1,D正确。
4.D 表示H2O(g)的生成热的热化学方程式为H2(g)+O2(g)===H2O(g) ΔHf=-243 kJ· mol-1,A错误。表示CO(g)的燃烧热的热化学方程式为CO(g)+O2(g)===CO2(g) ΔHc=-285 kJ· mol-1,B错误。由图1知O—H键的键能ΔHb=×(243+436+247)kJ· mol-1=463 kJ· mol-1,C错误。由图1得H2(g)+O2(g)===H2O(g) ΔH=-243 kJ· mol-1 ①,由图2得CO(g)+O2(g)===CO2(g) ΔH=-285 kJ· mol-1 ②,根据盖斯定律,②-①得CO(g)+H2O(g)===CO2(g)+H2(g) ΔH=-42 kJ· mol-1,D正确。
5.B 使用催化剂,降低了反应的活化能,改变了反应历程,A项正确;使用催化剂,不能改变反应物和生成物的总能量,即不能改变反应的焓变(ΔH),B项错误;8 h之后,C10H8的产率还在增加,说明反应2未达平衡,而C10H8是由C10H12转化而来的,且C10H12的产率几乎保持不变,说明反应1也未达平衡,C项正确;由图像可以看出反应2的活化能低于反应1的活化能,故反应1生成的C10H12快速转化为C10H8,从而使x1显著低于x2,D项正确。
6.B 化学键断裂需要吸收能量,过程①中钛氧键断裂会吸收能量,A错误;根据图示,该反应中,光能和热能转化为化学能,B正确;催化剂通过降低反应的活化能提高化学反应速率,催化剂不能降低反应的焓变,C错误;反应物总键能-生成物总键能=焓变,CO2分解反应的热化学方程式为2CO2(g)===2CO(g)+O2(g) ΔH=1 598×2-1 072×2-496=+556 (kJ· mol-1),D错误。
7.B 根据盖斯定律由③-②-①得CO(g)+H2O(g)===CO2(g)+H2(g) ΔH=-41 kJ· mol-1,故A正确;平衡常数只与温度有关,增大压强K不变,故B错误;反应①每生成1 mol CO的同时生成0.5 mol O2,说明正逆反应速率相等,达到平衡状态,故C正确;焓变=反应物的键能之和-生成物的键能之和,因此反应②断开2 mol H2和1 mol O2中的化学键所吸收的能量比形成4 mol O—H键所放出的能量少484 kJ,故D正确。
8.D 催化剂表面发生化学反应,反应过程中,既有化学键的断裂,也有化学键的形成,A项正确;催化剂只能改变化学反应速率,不影响化学平衡,故催化剂不能提高反应物的平衡转化率,B项正确;图乙中曲线Ⅰ的活化能比曲线Ⅱ的活化能高,故曲线Ⅱ为使用催化剂的能量变化曲线,C项正确;由图乙可知,使用催化剂后的反应过程中有中间产物生成,其中反应物转化为中间产物的反应中,反应物的总能量比中间产物的总能量低,故该反应为吸热反应,D项错误。
9.A 由图1可知,N2和H2都被吸附在催化剂a的表面上发生反应,A正确;由图2知反应①的热化学方程式中,ΔH=(508-600)kJ· mol-1=-92 kJ· mol-1,B错误;由图1知,反应②是NH3被O2氧化为NO的过程,发生反应4NH3+5O24NO+6H2O,计算知,转移1.25 mol 电子时,消耗标准状况下NH3的体积为5.6 L,C错误;催化剂只能改变化学反应速率,不能提高反应的平衡转化率,D错误。
10.D C(s)的燃烧热是指1 mol C(s)完全燃烧生成稳定氧化物CO2(g)放出的热量,故C(s)的燃烧热不是110.4 kJ· mol-1,A错误。2 mol Cu2O(s)和1 mol O2(g)反应生成4 mol CuO(s)放出的热量为(640-348)kJ=292 kJ,则1 mol CuO分解生成Cu2O吸收73 kJ热量,B错误。由图可知,反应2Cu2O(s)+O2(g)===4CuO(s)的活化能为348 kJ· mol-1,C错误。1 mol C(s)燃烧生成CO(g)放出110.4 kJ热量,则有①C(s)+O2(g)===CO(g) ΔH=-110.4 kJ· mol-1;由图可得②Cu2O(s)+O2(g)===2CuO(s) ΔH=-146 kJ· mol-1;根据盖斯定律,由①-②可得:C(s)+2CuO(s)===Cu2O(s)+CO(g),则有ΔH=(-110.4 kJ· mol-1)-(-146 kJ· mol-1)=+35.6 kJ· mol-1,D正确。
11.答案:(1)-415.5 (2)①Cl- ClO ②4ClO(aq)===3ClO(aq)+Cl-(aq) ΔH=-138 kJ· mol-1 (3)①2CuCl2(s)+O2(g)===2CuO(s)+2Cl2(g) ΔH2=+125.4 kJ· mol-1 ②溶液由红色变为无色(或溶液红色变浅)
解析:(1)分析题给热化学方程式,根据盖斯定律,由①×3+②可得3Cl2(g)+6NaOH(aq)===5NaCl(aq)+NaClO3(aq)+3H2O(l),则有ΔH=3ΔH1+ΔH2=(-101.1 kJ· mol-1)×3+(-112.2 kJ· mol-1)=-415.5 kJ· mol-1。(2)①物质具有的能量越高,其稳定性越弱,故最稳定的离子是Cl-,最不稳定的离子是ClO。②由ClO生成ClO和Cl-的反应为4ClO(aq)===3ClO(aq)+Cl-(aq),该反应的ΔH=3×38 kJ· mol-1-4×63 kJ· mol-1=-138 kJ· mol-1。(3)①由图可知,过程Ⅱ(氧化)发生的反应为2CuCl2(s)+O2(g)===2CuO(s)+2Cl2(g)。将题给O2氧化HCl的热化学方程式编号为ⅰ,将过程Ⅰ反应的热化学方程式编号为ⅱ,其ΔH记为ΔH2,根据盖斯定律,由ⅰ-ⅱ×2可得2CuCl2(s)+O2(g)===2CuO(s)+2Cl2(g),则有ΔH2=(-115.4 kJ· mol-1)-(-120.4 kJ· mol-1)×2=+125.4 kJ· mol-1。②氯化初期主要为不含HCl的气体,则初期溶液呈红色,氯化结束时,HCl与NaOH溶液发生中和反应,溶液褪色。
12.答案:(1)-159.47 (2)吸收热量 ·OH+·H===H2O(g) (3)+5.41 kJ· mol-1
解析:(1)根据盖斯定律,Ⅰ+Ⅱ得总反应:2NH3(g)+CO2(g)⇌CO(NH2)2(s)+H2O(g) ΔH3=-86.98 kJ· mol-1,所以ΔH1=-86.98 kJ· mol-1-72.49 kJ· mol-1=-159.47 kJ· mol-1。(2)根据图像可知,吸附态的能量小于过渡态,所以物质吸附在催化剂表面,形成过渡态的过程会吸收热量;活化能最小的过程是·CO+·OH+·H+3H2(g)生成·CO+3H2(g)+H2O(g),反应方程式是·OH+·H===H2O(g)。(3)已知CO(g)、CH4(g)、CH3CHO(l)的燃烧热分别为283.0 kJ· mol-1、890.31 kJ· mol-1、1 167.9 kJ· mol-1,分别写出燃烧热的热化学方程式,再用第3个的热化学方程式减去第1个和第2个的热化学方程式,则乙醛的分解反应CH3CHO(l)⇌CH4(g)+CO(g)的ΔH=-1 167.9 kJ· mol-1-(-283.0 kJ· mol-1)-(-890.31 kJ· mol-1)=+5.41 kJ· mol-1。
13.答案:(1)环形玻璃搅拌棒 (2)提高装置的保温效果
(3) -56.8 kJ·mol-1 (4)偏大 不相等 相等 (5)ABD
解析:(1)测定中和热的实验中还需要使用的仪器是环形玻璃搅拌棒。(3)根据表中所测数据,三次实验中的温度变化量分别为
℃=3.45 ℃、
℃=3.4 ℃、
℃=3.35 ℃,三次实验温度变化量的平均值为3.4 ℃,则实验中放出的热量Q=cm ΔT=4.18 J·g-1·℃-1×(50 cm3+50 cm3)×1 g· cm-3×3.4 ℃=1 421.2 J=1.421 2 kJ,反应生成的n(H2O)=n(HCl)=0.5 mol·L-1×50×10-3 L =0.025 mol,中和热表示在稀溶液中,酸与碱发生中和反应生成1 mol H2O时所释放的热量,则ΔH=-=-≈-56.8 kJ·mol-1。(4)NaOH固体溶于水会放出热量,如用0.5 mol·L-1的盐酸与NaOH固体进行实验,会导致测得的“中和热”数值偏大;如改用60 mL 0.5 mol·L-1的盐酸与50 mL 0.55 mol·L-1的NaOH溶液进行反应,发生反应的酸、碱的用量更多,放出的热量更多,但中和热表示的是生成1 mol水时放出的热量,因此所求的中和热相等。(5)由(3)中分析可知,测量的中和热数值小于57.3 kJ·mol-1,测量盐酸的温度后,温度计没有用水冲洗干净,会导致酸碱提前反应,所测的温度差变小,A项符合题意;把量筒中的氢氧化钠溶液倒入小烧杯时动作迟缓,会散失热量,B项符合题意;本实验要测定的是反应前后的温度差,环境温度对测定温度差没有影响,C项不符合题意;大烧杯的盖板中间小孔太大,会导致一部分热量散失,所测温度差偏小,D项符合题意。
2024届人教版高考化学一轮复习课练17化学能与热能作业含答案: 这是一份2024届人教版高考化学一轮复习课练17化学能与热能作业含答案,共22页。试卷主要包含了已知等内容,欢迎下载使用。
2024版新教材高考化学复习特训卷课练25盐类的水解及应用: 这是一份2024版新教材高考化学复习特训卷课练25盐类的水解及应用,共18页。试卷主要包含了下列实验现象与盐类水解无关的是等内容,欢迎下载使用。
2024版新教材高考化学复习特训卷课练18原电池化学电源: 这是一份2024版新教材高考化学复习特训卷课练18原电池化学电源,共16页。试卷主要包含了某原电池装置如图所示,一种新型的电池,总反应式为等内容,欢迎下载使用。












