






2024年高考化学一轮总复习 第1单元 第1讲 物质的分类及转化 课件
展开第1讲 物质的分类及转化
复习目标1.了解分类法在化学科学研究和化学学习中的重要作用,能根据物质的组成和性质对物质进行分类。2.了解分子、原子、离子、原子团等概念的含义。3.理解物理变化与化学变化的区别与联系。4.理解混合物和纯净物、单质和化合物、金属和非金属的概念。5.理解酸、碱、盐、氧化物的概念及其相互联系。6.了解胶体是一种常见的分散系,了解溶液和胶体的区别。
考点一 物质的组成与分类
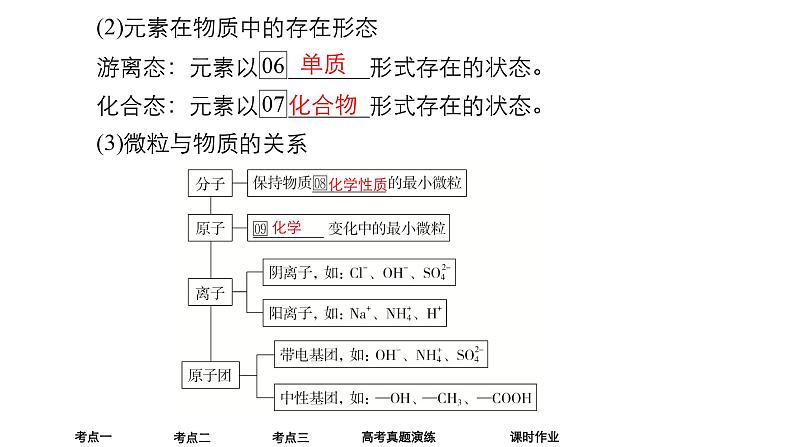
2.元素、物质及微粒间的关系
二、物质的分类1.树状分类法按不同层次对物质进行逐级分类,各层之间属于包含关系,如:
2.交叉分类法从不同角度对物质进行分类,示例如下:
请指出下列各说法的错因(1)由一种元素的阳离子与另一种元素的阴离子组成的物质一定为纯净物。错因:___________________________(2)含有金属元素的离子一定是阳离子。错因: ___________________________(3)冰水混合物属于混合物。错因: ___________________________
例如FeCl2与FeCl3混合。
冰水混合物属于纯净物。
(4)与水反应生成酸的氧化物一定是酸性氧化物,与水反应生成碱的氧化物一定是碱性氧化物。错因:__________________________(5)已知NaH2PO2属于正盐,其水溶液呈碱性,则H3PO2属于三元弱酸。错因:___________________________
不一定,比如NO2、Na2O2。
H3PO2属于一元弱酸。
1.纯净物和混合物判断中的特殊情况(1)只含一种元素的物质不一定是纯净物,也可能是混合物,如O2和O3,金刚石和石墨,红磷和白磷。(2)结晶水合物属于纯净物,如CuSO4·5H2O、KAl(SO4)2·12H2O等物质。(3)由同位素的不同原子形成的单质或化合物是纯净物,如H2与D2、H2O和D2O。(4)分子式为C5H10的物质可能是纯净物,也可能是混合物。(5)有机高分子属于混合物,如聚乙烯、淀粉等。
2.氧化物的类型(1)酸性氧化物:与碱反应生成相应的盐和水的氧化物,如SO2、CO2、SO3、N2O5、P2O5等。(2)碱性氧化物:与酸反应生成相应的盐和水的氧化物,如Na2O、CaO、CuO、Fe2O3、FeO等。(3)两性氧化物:既能与酸反应生成盐和水,又能与碱反应生成盐和水的氧化物,如Al2O3。(4)不成盐氧化物:如CO、NO等。(5)特殊氧化物:如Na2O2等。
角度一 物质的组成1.下列物质中一定属于纯净物的一组是( )①冰水混合物 ②爆鸣气 ③铝热剂 ④普通玻璃 ⑤水玻璃 ⑥漂白粉 ⑦二甲苯 ⑧TNT ⑨溴苯 ⑩C5H10 ⑪含氧40%的氧化镁 ⑫花生油 ⑬福尔马林 ⑭密封保存的NO2气体 ⑮王水A.①⑧⑨⑪B.②③④⑥C.⑦⑩⑫⑬⑭ D.①④⑧⑨⑪⑫
2.有下列物质:①氧气 ②二氧化碳 ③臭氧(O3)④盐酸 ⑤铁 ⑥碳酸钠 ⑦空气 ⑧氢氧化钠 ⑨冰水混合物 ⑩乙醇 ⑪甲醚(1)其中由分子直接构成的纯净物有_______________。(2)由原子直接构成的纯净物有________。(3)由离子直接构成的纯净物有________。(4)互为同素异形体的是________。(5)属于单质的有________。(6)属于化合物的有________________。(7)属于混合物的有________。(8)互为同分异构体的是________。
常见的混合物(1)气体混合物:空气、水煤气(CO和H2)、爆鸣气(H2和O2)、天然气(主要成分是CH4)、焦炉气(主要成分是H2和CH4)、裂解气。(2)液体混合物:氨水、氯水、王水、硬水、福尔马林、水玻璃(Na2SiO3的水溶液)、盐酸、石油、石油的各种馏分、植物油、液溶胶。(3)固体混合物:碱石灰、漂白粉、煤、玻璃、水泥、合金、铝热剂。
角度二 物质的分类3.分类法是一种行之有效、简单易行的科学方法,某同学用如表所示的形式对所学知识进行分类,其中甲与乙、丙、丁、戊是包含关系。正确的组合是( )A.①②B.④⑤⑥C.②④⑥D.①⑤⑥
4.下列物质的分类正确的是( )
有关氧化物中的“一定”和“不一定”(1)酸性氧化物、碱性氧化物不一定都能与水反应生成相应的酸或碱,如SiO2、Fe2O3。(2)能与碱反应生成盐和水的氧化物不一定是酸性氧化物,如NO2。(3)碱性氧化物都是金属氧化物,但金属氧化物不一定是碱性氧化物,如Mn2O7为酸性氧化物,Al2O3为两性氧化物,Na2O2为过氧化物。(4)酸性氧化物不一定是非金属氧化物,如Mn2O7;非金属氧化物不一定是酸性氧化物,如CO、NO。
考点二 物质的性质与转换
4.单质、氧化物、酸(或碱)和盐的转化关系应用实例
Fe+2HCl===FeCl2+H2↑
Fe2O3+6HCl===2FeCl3+3H2O
CaCO3+2HCl===CaCl2+CO2↑+H2O
NaOH+HCl===NaCl+H2O
请指出下列各说法的错因(1)发生了颜色变化的一定是化学变化。错因:_____________________________(2)232Th转化成233U是化学变化。错因:_________________________________(3)两种盐反应一定生成两种新盐。错因:__________________________________________________
如焰色试验属于物理变化。
原子核内部的变化属于核变化。
如NaHCO3和NaHSO4反应只生成Na2SO4一种新盐。
(4)C、S在O2中燃烧均生成最高价氧化物。错因:_____________________________________________(5)向蛋白质溶液中滴加Na2SO4溶液产生沉淀属于化学变化。错因:____________________________
C在O2不足时燃烧生成CO,S在O2中燃烧生成SO2。
蛋白质的盐析属于物理变化。
角度一 物质变化类型的判断1.中华民族有着光辉灿烂的发明史,下列发明创造不涉及化学反应的是( )A.用胆矾炼铜B.用铁矿石炼铁C.烧结黏土制陶瓷D.打磨磁石制指南针
2.下列变化中,前者是物理变化,后者是化学变化,且都有明显颜色变化的是( )A.打开盛装NO的集气瓶;冷却NO2气体B.用冰水混合物冷却SO3气体;加热氯化铵晶体C.木炭吸附NO2气体;将氯气通入品红溶液中D.向酚酞溶液中加入Na2O2;向FeCl3溶液中滴加KSCN溶液
角度二 物质的转化关系3.已知X和Y能发生如下反应:X+Y===H2O+盐,下列有关物质X和Y所属种类的判断中一定不正确的是( )A.X为酸、Y为碱B.X为碱性氧化物、Y为酸C.X为盐、Y为碱D.X为碱性氧化物、Y为酸性氧化物
4.下表各物质中,A、B、C、D、E均含有同一种短周期元素,其中A是单质,B常温下是气态氢化物,C、D是氧化物,E是D与水反应的产物,则各物质间通过一步反应就能实现转化的是( )A.②③B.②④C.①③④D.①②③④
物质间转化的几个常见误区(1)S燃烧不能直接生成SO3而是生成SO2。(2)Al2O3、SiO2、Fe2O3与水不反应,不能直接转化为Al(OH)3、H2SiO3、Fe(OH)3。(3)NH3催化氧化不能直接生成NO2而是生成NO。(4)Fe分别与Cl2、Br2反应生成FeCl3、FeBr3,Fe分别与S、I2反应生成FeS、FeI2,Cu与S反应生成Cu2S。(5)Fe与H+、Cu2+反应不能生成Fe3+。
考点三 分散系 胶体
请指出下列各说法的错因(1)直径为20 nm的纳米碳酸钙属于胶体。错因:___________________________________________________(2)溶液和胶体都可以通过滤纸和半透膜。错因:________________________________(3)向饱和FeCl3溶液中滴加过量氨水,可制取Fe(OH)3胶体。错因:________________________________
将纳米碳酸钙分散到某种分散剂中所形成的混合物属于胶体。
生成的是Fe(OH)3沉淀。
(4)沸水中滴加适量饱和FeCl3溶液,形成带电的胶体,导电能力增强。错因:___________________________(5)依据丁达尔现象可将分散系分为溶液、胶体与浊液。错因: __________________________________________________(6)胶体都呈液态,胶体的丁达尔效应属于物理变化。错因: ____________________________________
胶体不带电,胶粒带电。
溶液、胶体与浊液的本质区别为分散质粒子直径的大小。
胶体不一定是液态,如气溶胶、固溶胶。
2.胶体的性质及应用(1)聚沉胶体粒子聚集成较大颗粒,从而形成沉淀从分散剂里析出的过程叫做聚沉。使胶体聚沉的方法有:①加入电解质溶液;②加入与胶粒带相反电荷的胶体;③加热。应用:三角洲的形成;明矾、铁盐溶液净水;盐卤制豆腐。
(2)电泳在电场作用下,胶体粒子在分散剂中做定向移动的现象。如带正电荷的Fe(OH)3胶体粒子向阴极移动。应用:工厂静电除尘。(3)渗析胶体粒子不能透过半透膜,溶液中的粒子可以透过半透膜。应用:提纯胶体;血液透析。
3.对胶体性质的理解(1)胶体粒子可以是多个微粒形成的聚集体[如Fe(OH)3胶体粒子]或大分子(如蛋白质胶体粒子、淀粉胶体粒子)。(2)胶体属于分散系,是混合物,而很多纳米级物质的微粒直径也是在1~100 nm之间,但不属于胶体,属于纯净物,如纳米铜等。(3)丁达尔效应是胶体粒子对光线的散射作用,属于物理变化。
(4)胶体不带电,胶体中的胶粒能够吸附体系中的带电粒子而使胶粒带电荷,但整个分散系仍呈电中性。(5)胶体聚沉属于物理变化,如蛋白质的盐析就属于胶体聚沉现象。但蛋白质的变性不属于胶体的聚沉,此过程属于化学变化。(6)不是所有胶体都有电泳现象,如淀粉溶液,因其胶体粒子不带电荷而无电泳现象。有电泳现象的胶体是因为胶粒吸附带电的粒子而带电。
角度一 胶体的性质与制备1.下列关于溶液和胶体的说法正确的是( )A.蔗糖溶液、淀粉溶液属于溶液,烟、雾属于胶体B.溶液和胶体的本质区别是后者具有丁达尔效应,而前者无此现象C.制备Fe(OH)3胶体的方法是将饱和FeCl3溶液滴加到沸水中煮沸至溶液呈红褐色D.利用过滤的方法能将Fe(OH)3胶体从FeCl3溶液中分离出来
2.500 mL 2 ml·L-1 FeCl3溶液和500 mL 2 ml·L-1明矾溶液分别滴入沸水中,加热制成甲、乙两种分散系,经测定,甲分散系中分散质的粒子直径大小在1~100 nm,乙分散系中分散质的粒子直径大小在10-9~10-7 m。下列关于甲、乙分散系的判断合理的是( )A.在暗室里用一束明亮的强光照射甲、乙,发现甲有丁达尔效应,乙没有丁达尔效应B.向甲、乙中分别滴加过量的氢氧化钠溶液,现象都是“先沉淀,后溶解”C.向甲、乙中分别滴加过量的氢碘酸,最终现象分别是深褐色溶液、无色溶液D.蒸干、灼烧FeCl3溶液和明矾溶液会得到对应的固体盐
角度二 胶体的性质与应用3.下列事实与胶体性质无关的是( )A.水泥厂和冶金厂常用高压直流电除去排放气体中的大量烟尘,减少对空气的污染B.将植物油倒入水中用力搅拌形成油水混合物C.一束光通过长时间保存的Na2SiO3溶液时出现光亮的“通路”D.FeCl3溶液能使血液聚沉
4.关于胶体的性质与应用,相关说法错误的是( )A.静电除尘器除去空气或工厂废气中的飘尘是利用胶体粒子的带电性而加以除去B.明矾净水是利用胶体的吸附性C.从颜色上无法区别FeCl3溶液和Fe(OH)3胶体D.由于胶粒之间的排斥作用,胶粒不易聚集成大的颗粒,所以胶体的性质相对比较稳定
常见净水剂及作用原理(1)常见的净水剂:KAl(SO4)2·12H2O、FeCl3·6H2O等。其净水原理是Al3+、Fe3+水解生成Al(OH)3胶体、Fe(OH)3胶体而起到净化水的目的。(2)明矾不能用作水的消毒剂,因为对水消毒,一定发生氧化还原反应;也不能使海水淡化。
1.(2022·浙江6月选考)下列消毒剂的有效成分属于盐的是( )A.高锰酸钾溶液B.过氧乙酸溶液C.双氧水D.医用酒精
2.(2022·湖北高考)化学与生活密切相关,下列不涉及化学变化的是( )A.加入明矾后泥水变澄清B.北京冬奥会用水快速制冰C.炖排骨汤时加点醋味道更鲜D.切开的茄子放置后切面变色
3.(2022·湖南高考)化学促进了科技进步和社会发展。下列叙述中没有涉及化学变化的是( )A.《神农本草经》中记载的“石胆能化铁为铜”B.利用“侯氏联合制碱法”制备纯碱C.科学家成功将CO2转化为淀粉或葡萄糖D.北京冬奥会场馆使用CO2跨临界直冷制冰
4.(2021·湖南高考)下列说法正确的是( )A.糖类、蛋白质均属于天然有机高分子B.FeO粉末在空气中受热,迅速被氧化成Fe3O4C.SO2可漂白纸浆,不可用于杀菌、消毒D.镀锌铁皮的镀层破损后,铁皮会加速腐蚀
5.(2021·广东高考)劳动成就梦想。下列劳动项目与所述的化学知识没有关联的是( )
6.(2021·浙江高考)下列物质的化学成分不正确的是( )A.生石灰:Ca(OH)2B.重晶石:BaSO4C.尿素:CO(NH2)2D.草酸:HOOC—COOH
课时作业建议用时:40分钟
一、选择题(每小题只有1个选项符合题意)1.清华大学的科学家将古老的养蚕技术与时兴的碳纳米管和石墨烯结合,发现通过给蚕宝宝喂食含有碳纳米管和石墨烯的桑叶,可以获得更加牢固的蚕丝纤维。下列说法正确的是( )A.蚕丝纤维的主要成分是纤维素B.石墨烯像烯烃一样,是一种有机化合物C.碳纳米管和石墨烯互为同素异形体D.碳纳米管具有丁达尔效应
2.下列物质分类的正确组合是( )
3.下列有关胶体和溶液的叙述中正确的是( )A.溶液中溶质粒子的运动有规律,胶体粒子的运动无规律B.溶液呈电中性而胶体带正电荷或负电荷C.CuSO4溶液中通过一束光没有特殊现象,蛋白质溶液中通过一束光出现一条光亮的“通路”D.向Fe(OH)3胶体中滴入足量稀硫酸,胶体聚沉产生红褐色沉淀
4.(2022·皖南八校高三摸底联考)下列有关物质的性质与用途具有对应关系的是( )A.NH4HCO3受热易分解,可用作化肥B.稀硫酸具有酸性,可用于除去铁锈C.SO2具有氧化性,可用于纸浆漂白D.铁能与冷的浓硝酸反应,可用于制备氢气
6.已知氢氧化铁胶体和碘化银胶体混合后,出现了氢氧化铁沉淀和碘化银沉淀,则下列说法中不正确的是( )①碘化银胶体中的胶粒与氢氧化铁胶体中的胶粒所带电荷相反 ②该实验说明了这两种胶体是带电的 ③在这两种胶体中分别加入蔗糖也可以生成沉淀 ④生成的沉淀不能透过滤纸A.①和② B.②和③C.③和④ D.①和④
7.近年来高铁酸钾(K2FeO4)已经被广泛应用在水处理方面,高铁酸钾的氧化性超过高锰酸钾,是一种集氧化、吸附、凝聚、杀菌于一体的新型高效多功能水处理剂。高铁酸钾受热易分解,但干燥的高铁酸钾在198 ℃以下是稳定的。高铁酸钾在水处理过程中涉及的变化过程有( )①蛋白质的变性 ②蛋白质的盐析 ③胶体聚沉④盐类水解 ⑤焰色试验 ⑥氧化还原反应A.①②③④ B.①③④⑥C.②③④⑤ D.②③⑤⑥
解析高铁酸钾具有强氧化性,能使蛋白质变性而起到杀菌的作用,①⑥正确;高铁酸根离子被还原得到的Fe3+能水解,产生Fe(OH)3胶体,胶体具有吸附性,能够吸附水中的悬浮颗粒发生聚沉形成沉淀,③④正确。
8.分类思想是研究化学的常用方法。下列物质的分类正确的是( )A.纯净物:水玻璃、干冰、液氯B.电解质:BaSO4、NaCl、NH3·H2O、盐酸C.胶体:烟、淀粉溶液、果冻D.酸性氧化物:NO2、SO3、SiO2
9.下列生活中的做法没有利用物质化学性质的是( )A.葡萄酒中添加二氧化硫B.长途运输鱼苗时,人们常在水中加入少量过氧化钙固体C.用过氧化氢溶液漂洗衣服上的污渍D.夏天超市用干冰给物质降温
10.(2022·黑龙江省八校高三期末联考)如图的每一方格中表示有关的一种反应物或生成物,其中A、C、D、E为无色气体,F为红棕色气体。下列说法不正确的是( )A.F与水的反应中氧化剂与还原剂的物质的量之比为2∶1B.用蘸有浓盐酸的玻璃棒靠近瓶口可以检验C气体是否收集满C.M可能是纯净物或混合物D.D在一定条件下可以与C发生置换反应
解析 F为二氧化氮,与水反应3NO2+H2O===2HNO3+NO,氧化剂与还原剂的物质的量之比为1∶2,A错误。
11.图中“—”表示相连的物质间在一定条件下可以反应,“→”表示丁在一定条件下可以转化为乙。下面四组选项中,符合图示要求的是( )
二、非选择题12.(2022·郑州市高三第一次质量检测)某常见元素及其化合物的转化关系如图所示。已知A为金属单质。完成下列问题:(1)若C为淡黄色固体,D为厨房常见的调味品,则C的电子式为_______________________________,工业上由D制备A的化学方程式为__________________________________。(2)若A为紫红色固体,C为黑色固体,则B的化学式为_________________,写出由D转化为A的化学方程式为__________________________________。
Cu2(OH)2CO3
CuCl2+Fe===Cu+FeCl2(合理即可)
如图转化关系中,①B、E、F、Y通常条件下均是气体;②E、F相遇会产生白烟;③A、B、G、Y都是常见的主族元素组成的单质,其余均是化合物;④A、C、H的焰色均呈黄色。
请按要求回答下列问题:(1)化合物C的电子式是____________________。(2)以上反应属于氧化还原反应的有________(填反应编号)。(3)E与F反应的化学方程式为______________________。在加热条件下C溶液与D溶液反应的离子方程式为__________________________。(4)G与C的溶液发生反应的离子方程式为_____________________________________。
HCl+NH3===NH4Cl
新教材适用2024版高考化学一轮总复习第1章物质及其变化第1讲物质的分类及转化课件: 这是一份新教材适用2024版高考化学一轮总复习第1章物质及其变化第1讲物质的分类及转化课件,共60页。PPT课件主要包含了考点一,考点二,考点三,必备知识·梳理夯实,化合物,4同素异形体,同种物质,两种或两种以上的物质,③氧化物的分类,①②③⑨⑩⑪等内容,欢迎下载使用。
2024年高考化学一轮总复习 第8单元 第1讲 原电池 化学电源 课件: 这是一份2024年高考化学一轮总复习 第8单元 第1讲 原电池 化学电源 课件,共60页。PPT课件主要包含了化学能,氧化还原,活泼性,直接或间接接触,Cl-,电极材料,考点二化学电源,Ag2O,PbO2,高考真题演练等内容,欢迎下载使用。
2024年高考化学一轮总复习 第7单元 第1讲 电离平衡 课件: 这是一份2024年高考化学一轮总复习 第7单元 第1讲 电离平衡 课件,共60页。PPT课件主要包含了第1讲电离平衡,离子结合成分子,电离平衡的特征,弱电解质本身的性质,电离方向,生成弱电解质分子,考点二电离平衡常数,电离常数,本身的性质,第一步电离等内容,欢迎下载使用。












