


- 专题06 化学反应速率与平衡思想——2022-2023学年高一化学下学期期末专项突破学案(人教版2019必修第二册) 学案 6 次下载
- 专题07 几组有机化学概念的判断——2022-2023学年高一化学下学期期末专项突破学案(人教版2019必修第二册) 学案 5 次下载
- 专题08 官能团的性质与有机物的转化——2022-2023学年高一化学下学期期末专项突破学案(人教版2019必修第二册) 学案 4 次下载
- 专题09 金属与海水资源的开发利用——2022-2023学年高一化学下学期期末专项突破学案(人教版2019必修第二册) 学案 3 次下载
- 专题10 物质的分离、提纯及相关工艺流程题——2022-2023学年高一化学下学期期末专项突破学案(人教版2019必修第二册) 学案 7 次下载
期末模拟测试卷——2022-2023学年高一化学下学期期末模拟测试卷(人教版2019必修第二册)
展开期末总测试
(考试时间:90分钟 试卷满分:100分)
可能用到的相对原子质量:H 1 C 12 N 14 O 16 S 32
一、选择题:本题共20个小题,每小题2分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1.化学与生活息息相关,下列有关说法正确的是
A.聚氯乙烯塑料制品可用于食品包装
B.糖尿病人应宜多吃馒头等无糖食品
C.大豆富含蛋白质,适宜用来酿酒
D.流感疫苗应冷藏存放,以免蛋白质变性
【答案】D
【解析】A项,聚乙烯塑料制品可用于食品包装,聚氯乙烯塑料制品不能用于食品包装,错误;B项,淀粉属于糖类,糖尿病人应少吃馒头,错误;C项,含淀粉多的粮食适合酿酒,大豆富含蛋白质、脂肪,大豆适宜用来榨油,错误;D项,高温条件下,蛋白质变性,流感疫苗应冷藏存放,以免蛋白质变性,正确。
2.下列物质的用途不正确的是
A.液氨可用作制冷剂 B.SO2可用作纸浆的漂白
C.浓硝酸可用作干燥剂 D.单质硅可作半导体材料
【答案】C
【解析】A项,氨气易液化,液氨可用作制冷剂,不符合题意;B项,SO2具有漂白性,SO2可用作纸浆的漂白,不符合题意;C项,浓硝酸不能吸水,浓硝酸不能作干燥剂,符合题意;D项,单质硅的导电性介于导体和绝缘体之间,单质硅可作半导体材料,符合题意。
3.下列有关金属的冶炼描述错误的是
A.电解熔融的NaCl制取Na B.金属冶炼过程中,被冶炼的金属被还原
C.CO还原Fe2O3制取Fe D.从自然界中获得金属单质均需要通过化学方法
【答案】D
【解析】A项,金属钠的还原性强,工业上常用电解熔融氯化钠的方法制取钠,正确;B项,金属冶炼过程中,被冶炼的金属元素的化合价降低被还原,正确;C项,铁具有较强的还原性,工业上常用一氧化碳在高温下还原氧化铁制取铁,正确;D项,自然界中含有游离态的金,所以从自然界中获得金单质不需要通过化学方法,错误。
4.下列说法正确的是
A.石油的分馏、裂化、裂解均属于化学变化
B.煤的干馏、气化、液化均属于物理变化
C.汽油、煤油、柴油、聚乙烯均是纯净物
D.天然气、沼气的主要成分均是甲烷
【答案】D
【解析】A项,裂化、裂解均属于化学变化,石油的分馏是利用石油中各组分的沸点的不同,用加热冷凝的方法将各组分分离的过程,没有新物质生成,属于物理变化,错误;B项,煤的干馏、气化、液化均有新物质生成,属于化学变化,错误;C项,石油分馏后所得的汽油、煤油和柴油仍属于混合物,聚乙烯是高分子化合物,聚合度不确定,也是混合物,错误;D项,天然气、沼气的主要成分均是甲烷,正确。
5.下列反应中前者属于取代反应,后者属于加成反应的是
A.丙烯和氢气反应生成丙烷;甲醇和甲酸反应生成甲酸甲酯
B.光照条件下甲烷与氯气的反应;乙烯使溴的四氯化碳溶液褪色
C.乙醇和氧气反应生成乙醛;乙烯与水蒸气在一定条件下反应生成乙醇
D.乙烯使酸性高锰酸钾溶液褪色;乙烯在催化剂作用下生成聚乙烯
【答案】B
【解析】A项,丙烯和氢气反应生成丙烷属于加成反应,甲醇和甲酸反应生成甲酸甲酯的反应属于酯化反应(取代反应),错误;B项,甲烷和氯气在光照条件下发生了取代反应,乙烯使溴的四氯化碳溶液褪色属于加成反应,正确;C项,乙醇和氧气反应生成乙醛是氧化反应,乙烯与水蒸气在一定条件下生成乙醇属于加成反应,错误;D项,乙烯使酸性高锰酸钾溶液褪色发生的反应是氧化反应,乙烯在催化剂作用下生成聚乙烯属于加聚反应,错误。
6.在“绿色化学工艺”中,理想状态是反应物中的原子全部转化为期望产物,即原子利用率为100%。下列反应类型能体现“原子经济”原则的是
①置换反应 ②化合反应 ③分解反应 ④取代反应 ⑤加成反应 ⑥加聚反应 ⑦乙烯在Ag作催化剂条件下被氧气氧化制环氧乙烷
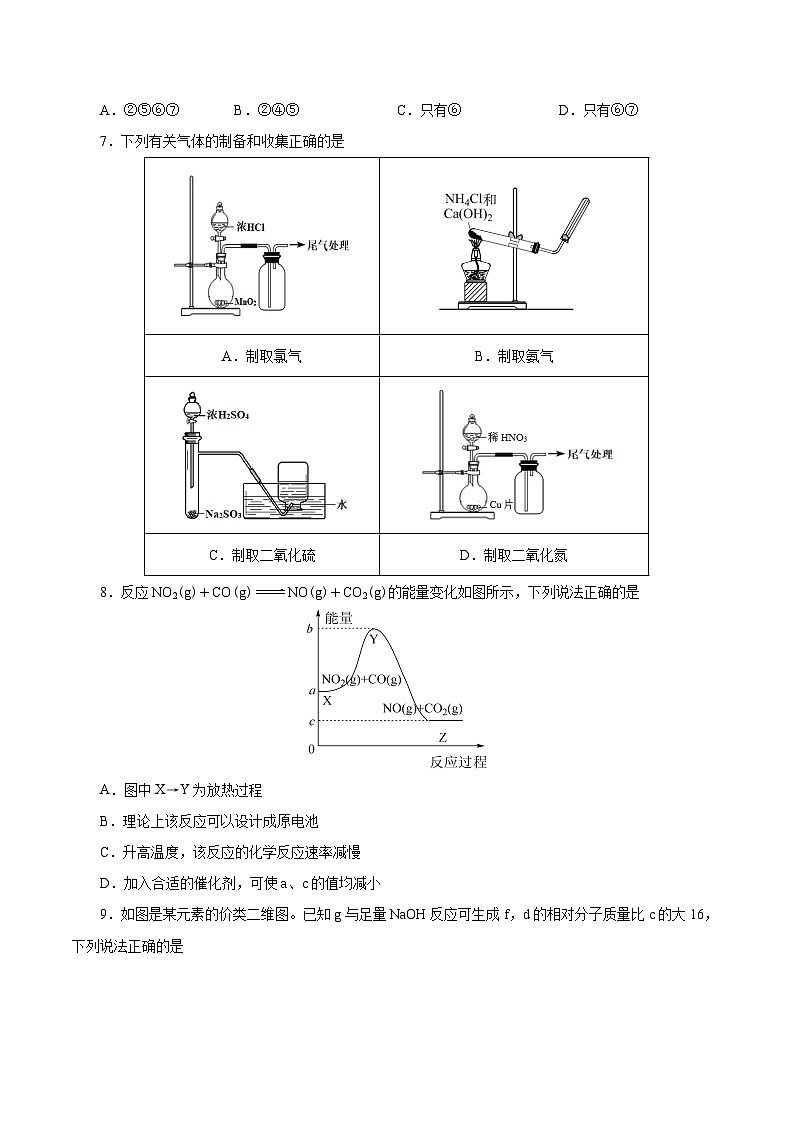
A.②⑤⑥⑦ B.②④⑤ C.只有⑥ D.只有⑥⑦
【答案】A
【解析】产物为唯一的反应原子利用率为100%,能体现“原子经济”原则。
①置换反应产物不唯一,不符合;②化合反应产物唯一,符合;③分解反应产物不唯一,不符合;④取代反应产物不唯一,不符合;⑤加成反应产物唯一,符合;⑥加聚反应产物唯一,符合;⑦乙烯在Ag作催化剂条件下被氧气氧化制环氧乙烷,产物唯一,符合;则②⑤⑥⑦符合,答案选A项。
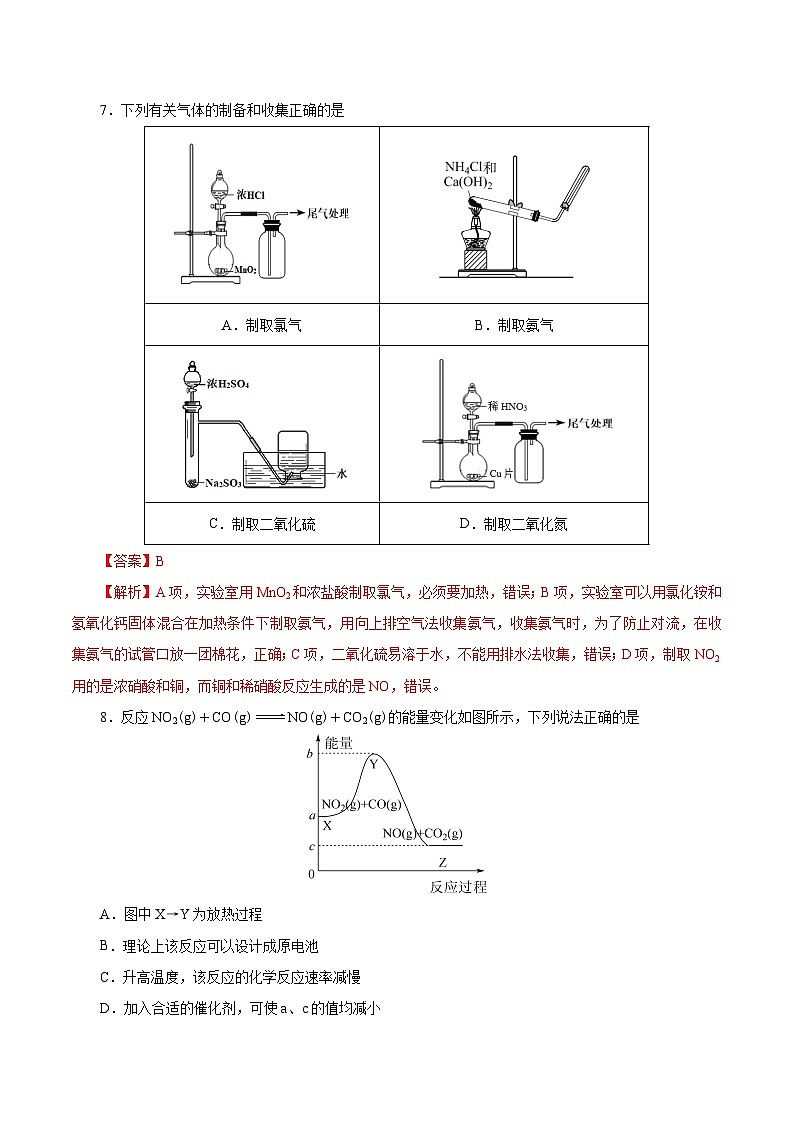
7.下列有关气体的制备和收集正确的是
A.制取氯气
B.制取氨气
C.制取二氧化硫
D.制取二氧化氮
【答案】B
【解析】A项,实验室用MnO2和浓盐酸制取氯气,必须要加热,错误;B项,实验室可以用氯化铵和氢氧化钙固体混合在加热条件下制取氨气,用向上排空气法收集氨气,收集氨气时,为了防止对流,在收集氨气的试管口放一团棉花,正确;C项,二氧化硫易溶于水,不能用排水法收集,错误;D项,制取NO2用的是浓硝酸和铜,而铜和稀硝酸反应生成的是NO,错误。
8.反应NO2(g)+CO(g)NO(g)+CO2(g)的能量变化如图所示,下列说法正确的是
A.图中X→Y为放热过程
B.理论上该反应可以设计成原电池
C.升高温度,该反应的化学反应速率减慢
D.加入合适的催化剂,可使a、c的值均减小
【答案】B
【解析】A项,由图可知,X→Y为化学键断裂的吸热过程,错误;B项,由方程式和热效应可知,该反应为放热反应,为自发进行的氧化还原反应,理论上该反应可以设计成原电池,正确;C项,升高温度,反应的化学反应速率加快,错误;D项,加入合适的催化剂,能加快反应速率,但反应物的总能量a的值和生成物总能量c的值不变,错误。
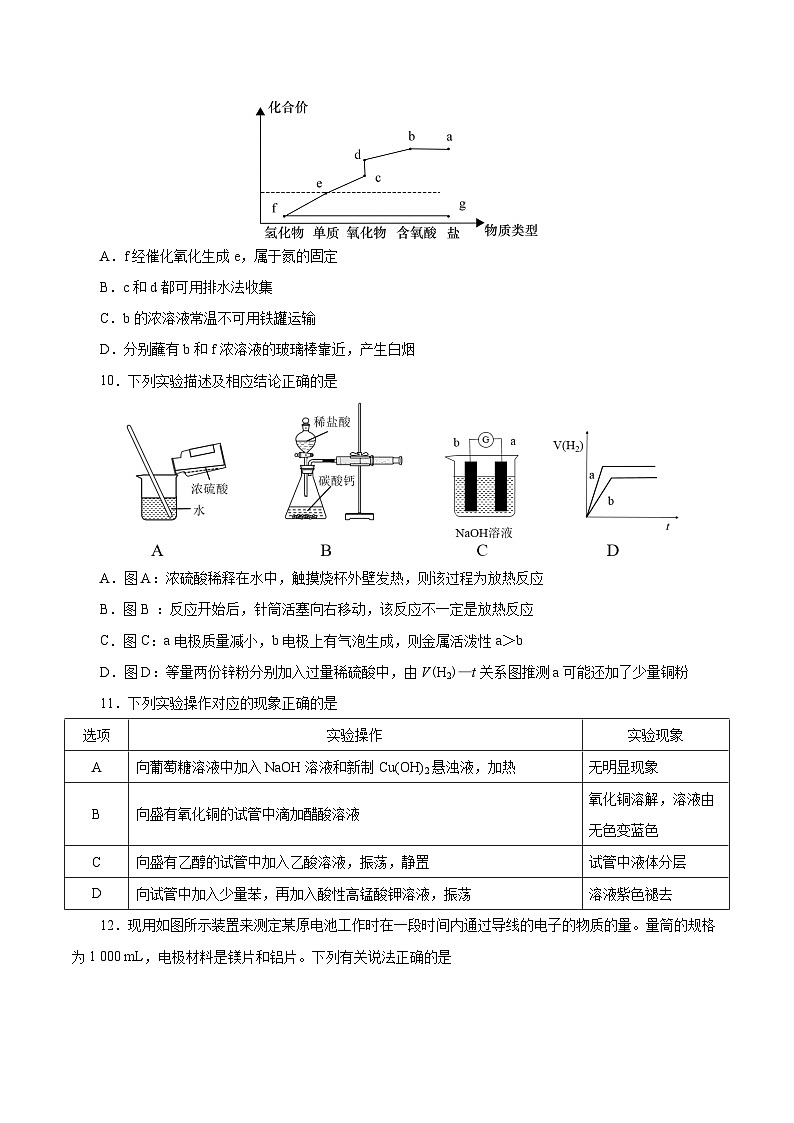
9.如图是某元素的价类二维图。已知g与足量NaOH反应可生成f,d的相对分子质量比c的大16,下列说法正确的是
A.f经催化氧化生成e,属于氮的固定
B.c和d都可用排水法收集
C.b的浓溶液常温不可用铁罐运输
D.分别蘸有b和f浓溶液的玻璃棒靠近,产生白烟
【答案】D
【解析】由g与足量氢氧化钠反应可生成f,d的相对分子质量比c的大16,可知题给图示是氮元素的价类二维图,a为硝酸盐、b为硝酸、c为一氧化氮、d为二氧化氮、e为氮气、f为氨气、g为铵盐。
A项,氨气氧化生成氮气的反应不是游离态的氮转化为化合态氮的过程,不属于氮的固定,错误;B项,二氧化氮能与水反应生成硝酸和一氧化氮,不能用排水法收集,错误;C项,常温下,铁在浓硝酸中发生钝化,可用铁罐运输,错误;D项,浓氨水和浓硝酸都具有挥发性,分别蘸有浓氨水和浓硝酸的玻璃棒靠近时,挥发出的氨气和硝酸蒸气反应生成硝酸铵,会有大量白烟产生,正确。
10.下列实验描述及相应结论正确的是
A.图A:浓硫酸稀释在水中,触摸烧杯外壁发热,则该过程为放热反应
B.图B :反应开始后,针筒活塞向右移动,该反应不一定是放热反应
C.图C:a电极质量减小,b电极上有气泡生成,则金属活泼性a>b
D.图D:等量两份锌粉分别加入过量稀硫酸中,由V(H2)—t关系图推测a可能还加了少量铜粉
【答案】B
【解析】A项,浓硫酸的稀释过程不是化学反应,属于放热过程,不属于放热反应,错误;B项,碳酸钙和稀盐酸反应生成氯化钙、二氧化碳和水,生成的二氧化碳气体能使针筒活塞向右移动,则针筒活塞向右移动不一定是反应放出热量导致,正确;C项,若a为金属铝,b为金属镁,铝、镁在氢氧化钠溶液中构成原电池,能与氢氧化钠溶液反应的铝做原电池的负极,镁做正极,正极上有气泡生成,但金属活泼性铝小于镁,错误;D项,由于稀硫酸过量,两份锌等量,若a中加了少量铜粉,锌铜在稀硫酸中构成原电池,会加快反应速率,但生成氢气的量不变,错误。
11.下列实验操作对应的现象正确的是
选项
实验操作
实验现象
A
向葡萄糖溶液中加入NaOH溶液和新制Cu(OH)2悬浊液,加热
无明显现象
B
向盛有氧化铜的试管中滴加醋酸溶液
氧化铜溶解,溶液由无色变蓝色
C
向盛有乙醇的试管中加入乙酸溶液,振荡,静置
试管中液体分层
D
向试管中加入少量苯,再加入酸性高锰酸钾溶液,振荡
溶液紫色褪去
【答案】B
【解析】A项,葡萄糖具有还原性,向葡萄糖溶液中加入NaOH溶液和新制Cu(OH)2悬浊液,加热会生成红色沉淀,错误;B项,醋酸具有酸性会和金属氧化物反应,向盛有氧化铜的试管中滴加醋酸溶液,氧化铜溶解生成铜离子溶液,溶液由无色变蓝色,正确;C项,乙醇和乙酸会相互溶解,不会分层,错误;D项,苯和高锰酸钾不反应,溶液颜色不会褪去,错误。
12.现用如图所示装置来测定某原电池工作时在一段时间内通过导线的电子的物质的量。量筒的规格为1 000 mL,电极材料是镁片和铝片。下列有关说法正确的是
A.b电极材料是镁片
B.电流经a流向b
C.若用NaOH溶液代替稀硫酸,溶液中的OH-移向铝片一极
D.当量筒中收集到672 mL气体时,通过导线的电子的物质的量为0.06 mol
【答案】C
【解析】根据原电池的工作原理,由装置图知,电极b产生气体,则b为正极,电极b为铝片,电极反应式为:2H++2e-=H2↑;电极a为镁片,作负极,电极反应式为:Mg-2e-=Mg2+,电流经正极流向负极,阳离子移向正极,阴离子移向负极。
A项,由分析知,b电极材料为铝片,错误;B项,由分析知,电极a为负极,电极b为正极,电流由正极流向负极,即电流经b流向a,错误;C项,用NaOH溶液代替稀硫酸,则铝作负极,阴离子移向负极,则溶液中的OH-移向铝片一极,正确;D项,未说明标况,无法计算量筒中收集气体的物质的量,无法计算通过导线的电子的物质的量,错误。
13.以丙酸为原料,经过下列反应可制取一种补铁剂(已知:C2H5Br+NaOHC2H5OH+NaBr):
下列说法正确的是
A.过程Ⅰ中生成1 mol CH3CHClCOOH需要0.5 mol Cl2
B.1 mol乳酸最多可与2 mol NaOH反应
C.试剂a可以是FeCO3
D.乳酸分子满足通式Cn(H2O)m,乳酸属于糖类
【答案】C
【解析】丙酸和氯气发生取代反应生成CH3CHClCOOH,CH3CHClCOOH在NaOH溶液中发生卤代烃的水解和中和反应生成CH3CHOHCOONa,CH3CHOHCOONa酸化后得到CH3CHOHCOOH(即乳酸),乳酸和试剂a反应得到乳酸亚铁。
A项,过程Ⅰ发生的是取代反应,丙酸中的一个H被Cl取代,除了生成CH3CHClCOOH外,还生成HCl,所以生成1 mol CH3CHClCOOH需要1 mol Cl2,错误;B项,乳酸分子中的羧基可以和NaOH反应,羟基不能和NaOH反应,所以1 mol乳酸最多可与1 mol NaOH反应,错误;C项,乳酸和试剂a反应得到乳酸亚铁,则试剂a可以是FeCO3,正确;D项,乳酸分子虽然满足通式Cn(H2O)m,但满足此通式的不一定是糖类,如乙酸也满足此通式,但乙酸属于羧酸类,乳酸属于羟基酸,错误。
14.汽车尾气中含有NO。利用固体表面催化工艺进行NO分解的反应过程可用下图表示:
下列说法不正确的是
A.NO和O2都属于共价化合物
B.N2含有非极性共价键
C.过程②吸收能量,过程③释放能量
D.上述过程的总化学方程式为2NON2+O2
【答案】A
【解析】A项,O2为非金属单质,不属于共价化合物,错误;B项,N2含有N≡N非极性共价键,正确;C项,过程②是破坏化学键的过程,吸收能量;过程③是形成化学键的过程,释放能量,正确;D项,上述过程的反应物是NO,生成物是氮气和氧气,总化学方程式为2NON2+O2,正确。
15.以乙烯为原料生产环氧乙烷,过去主要使用氯代乙醇法,其合成方法为CH2=CH2+Cl2+H2O―→ClCH2CH2OH+HCl、2ClCH2CH2OH+Ca(OH)2→2+CaCl2+2H2O,现代石油化工采用银做催化剂,可以实现一步完成,其合成方法为2CH2=CH2+O22,与氯代乙醇法相比,不属于现代合成路线的优点的是
A.缩短了反应历程
B.原料没有易燃物质
C.对设备腐蚀性小
D.没有副产物,原子利用率为100%
【答案】B
【解析】A项,现代合成路线只有一步反应,缩短了反应历程,正确;B项,乙烯属于烃类,易燃烧,错误;C项,现代合成路线不使用Cl2,没有HCl生成,对设备腐蚀性小,正确;D项,现代合成路线原子全部转化为环氧乙烷,原子利用率为100%,正确。
16.海洋中部分化学资源的利用,如图所示:
下列说法不正确的是
A.步骤①、②利用了Cl2的氧化性,热空气吹出利用了溴的挥发性
B.物质X常选用SO2,Y常选用生石灰
C.工业上常用热还原法冶炼金属镁
D.“氯化”过程生成的可燃气体为CO
【答案】C
【解析】A项,步骤①、②都是Cl2把Br-氧化为Br2,利用了Cl2的氧化性,热空气吹出利用了溴的挥发性,正确;B项,用SO2吸收溴蒸气生成硫酸和氢溴酸;生石灰和水反应生成氢氧化钙,氢氧化钙和氯化镁反应生成氢氧化镁沉淀,正确;C项,镁的活泼性强,工业上常用电解熔融氯化镁的方法冶炼金属镁,错误;D项,“氯化”过程MgO、C、Cl2反应生成MgCl2和可燃气体CO,正确。
17.大气污染物SO2易溶于水,通常表现出较强的还原性,对人体的呼吸系统和中枢神经系统等均有毒性作用。认识和利用SO2的性质可有效防治SO2对环境的污染,并实现SO2的综合利用。某研究团队提出的SO2烟气脱硫工艺流程如下,该流程中脱硫剂反复循环,可实现对烟气中SO2的持续脱除。已知:脱疏塔中发生的主要反应为2CaS+3SO2=2CaSO3+3S、2CaSO3+O2=2CaSO4。
下列有关说法正确的是
A.脱硫塔中反应生成的S为还原产物
B.经冷凝器得到的几种单质S2、S4、S6和S8互为同位素
C.将CaSO4和煤粉碎混合,再投入再生塔,有利于反应充分进行
D.再生塔中得到的X主要成分为CaSO3
【答案】C
【解析】A项,脱硫塔发生反应2CaS+3SO2=2CaSO3+3S,根据价态规律,CaS→S和SO2→S,则S为氧化产物和还原产物,错误;B项,S2、S4、S6和S8都为S的不同单质,互为同素异形体,错误;C项,将CaSO4和煤粉碎混合,增大反应物接触面积,有利于反应充分进行,正确;D项,“再生塔”中C与CaSO4反应生成CO2和X:CaSO4+C―→CO2+X,根据原子守恒有:CaSO4+2C―→2CO2+X,再根据电子守恒碳元素共升高8价,则S元素应由+6价降为-2价,故有:CaSO4+2C―→2CO2+CaS,X为CaS,错误。
18.在一个容积不变的2 L密闭容器中加入2 mol SO2、1 mol O2和合适的催化剂,发生反应2SO2(g)+
O2(g)2SO2(g)(放热反应)。同时研究温度对SO2的平衡转化率和该催化剂催化效率的影响如图所示。
已知:SO2的平衡转化率=×100%。下列说法正确的是
A.450℃时,若3 min达到平衡,则v(SO2)=0.3 mol·L-1·min-1
B.升温,该反应的正反应速率增大,逆反应速率减小
C.合成SO3的最佳条件是不加催化剂,温度为250℃
D.可以通过延长反应时间,增大SO2的平衡转化率
【答案】A
【解析】A项,450℃时,SO2的平衡转化率为90%,此时参加反应的SO2为2 mol×90%=1.8 mol,若3 min达到平衡,则v(SO2)==0.3 mol·L-1·min-1,正确;B项,升温,反应物有效碰撞的次数增多,该反应的正反应速率增大,逆反应速率也增大,不正确;C项,加入催化剂可加快反应速率,缩短反应到达平衡的时间,所以合成SO3的最佳条件是加入催化剂,温度为450℃,不正确;D项,对于可逆反应,一旦达到平衡,再延长反应时间,反应物的转化率就不会发生改变,所以通过延长反应时间,不能增大SO2的平衡转化率,不正确。
19.山梨酸是常用的食品防腐剂,其结构简式如图所示,下列有关山梨酸的叙述不正确的是
A.分子中所有碳原子可能在同一平面上
B.既能发生取代反应,又能发生加成反应
C.与互为同分异构体
D.1 mol该物质与足量Na反应生成1.5 mol H2
【答案】A
【解析】A项,分子中标有*号的碳原子与3个碳原子通过单键连接,根据甲烷结构可知,分子中不可能所有碳原子在同一平面上,错误;B项,山梨酸分子中含有碳碳双键,能发生加成反应;含有羧基、羟基能发生取代反应,正确;C项,与分子式相同、结构不同,互为同分异构体,正确;D项,羟基、羧基都能与钠反应,1 mol 与足量Na反应生成1.5 mol H2,正确。
20.向1 000 mL某稀硝酸中加入一定质量的铁粉,铁粉完全溶解后,放出11.2 L(标准状况下)NO气体,同时溶液质量增加18.6 g。下列判断正确的是
A.反应后的溶液中还可溶解19.2 g Fe
B.原稀硝酸的物质的量浓度为2.0 mol·L-1
C.原溶液中投入铁粉的物质的量是0.5 mol
D.反应后的溶液中c(Fe2+)∶c(Fe3+)=1∶2
【答案】B
【解析】由题意可知n(NO)===0.5 mol,则m(NO)=0.5 mol×30 g·mol-1=15 g,转移电子的物质的量为0.5 mol×3=1.5 mol,溶液质量增加18.6 g,加入铁粉的质量为18.6 g+15 g=33.6 g,所以原溶液中投入铁粉的物质的量是n(Fe)==0.6 mol,设所得溶液中亚铁离子和铁离子的物质的量分别为x、y,则x+y=0.6 mol,再由电子守恒得2x+3y=1.5 mol,两式联立解得x=y=0.3 mol。
A项,反应后的溶液中再加入铁粉,发生如下反应:
2Fe3+ + Fe=3Fe2+
2 1
0.3 mol 0.15 mol
还可溶解0.15 mol Fe,即8.4 g Fe,错误;B项,由N元素守恒得,n(HNO3)=2n(Fe2+)+3n(Fe3+)+n(NO)=2×0.3 mol+3×0.3 mol+0.5 mol=2.0 mol,原稀硝酸的物质的量浓度为c(HNO3)==2.0 mol·L-1,正确;C项,由分析可知原溶液中投入铁粉的物质的量是0.6 mol,错误;D项,由分析可知反应后的溶液中c(Fe2+)∶c(Fe3+)=0.3 mol∶0.3 mol=1∶1,错误。
二、非选择题:包括第21题~第25题5个大题,共60分。
21.(13分)某学习小组在实验室研究SO2与Ba(NO3)2溶液的反应。
I.[制备二氧化硫]
(1)实验室常用亚硫酸钠固体与浓硫酸反应制取二氧化硫。
①写出该反应的化学方程式_________________________________________。
②欲制取并收集干燥的二氧化硫,选择下图中的装置,其最佳连接顺序为_____________________。(按气流方向,用小写字母表示,部分装置可重复使用)。
③装置D的作用是_____________________________________。
II.[实验探究]
(2)向盛有2 mL 0.1 mol·L-1 Ba(NO3)2溶液的试管中,缓慢通入SO2气体,试管内有白色沉淀产生。
④预测白色沉淀可能是_______________。
⑤配制0.1 mol·L-1 Ba(NO3)2溶液时所用蒸馏水必须加热煮沸,目的是________________________。
(3)将SO2分别通入无氧、有氧且浓度均为0.1 mol·L-1的BaCl2溶液和Ba(NO3)2溶液中,探究NO3-和O2哪种微粒起到了主要氧化作用,实验记录如下:
项目
实验记录
pH
变化
是否产生沉淀
BaCl2溶液(无氧)中无白色沉淀、BaCl2溶液(有氧)中有白色沉淀、Ba(NO3)2溶液(无氧)中有白色沉淀、Ba(NO3)2溶液(有氧)中有白色沉淀。
⑥曲线a所示溶液pH降低的原因________________________________________(用化学方程式表示)。
⑦曲线c所示溶液中发生反应的离子方程式为_____________________________________。
⑧曲线d_______(填“能”或“不能”)说明NO3-是氧化SO2的主要微粒,理由是_____________________
__________________________________________________________________________。
【答案】(1)①Na2SO3+H2SO4(浓)Na2SO4+SO2↑+H2O(2分) ②bcdefcdg(2分) ③除去多余的二氧化硫,避免污染环境(1分) (2)④BaSO4(1分) ⑤除去水中的溶解氧(1分) (3)⑥H2O+SO2=H2SO3(1分) ⑦2Ba2++O2+2SO2+2H2O=2BaSO4↓+4H+(2分) ⑧不能(1分) b和d两曲线在有氧和无氧条件下pH相差较大(或:c和d两曲线在有无NO3-条件下pH相差不大)(2分)
【解析】实验室常用亚硫酸钠固体与浓硫酸反应制取二氧化硫,用向上排空气法收集二氧化硫,用浓硫酸干燥二氧化硫,用NaOH溶液吸收多余的二氧化硫。但吸收尾气时,烧杯内的水也会沿导管进行集气瓶内,所以在集气瓶和尾气处理装置之间也应放置干燥装置。
(1)①亚硫酸钠固体与浓硫酸反应,生成硫酸钠、二氧化硫和水,反应的化学方程式为:Na2SO3+H2SO4(浓)Na2SO4+SO2↑+H2O;②欲制取并收集干燥的二氧化硫,选择图中的装置为A、B、C、B、D,其最佳连接顺序为bcdefcdg;③因为SO2会污染环境,应进行尾气处理,所以装置D的作用是除去多余的二氧化硫,避免污染环境;(2)④Ba(NO3)2溶液中通入SO2后,溶液显酸性,NO3-在H+存在下能将SO2氧化为SO42-,Ba2+与SO42-生成BaSO4,故白色沉淀是BaSO4;⑤为了防止所配溶液中溶解氧气,干扰实验结果,配制0.1 mol·L-1 Ba(NO3)2溶液时所用蒸馏水必须加热煮沸,目的是:除去水中的溶解氧。答案为:BaSO4;除去水中的溶解氧;(3)⑥BaCl2与二氧化硫水溶液不能发生反应,所以曲线a所示溶液pH降低的原因:H2O+SO2=H2SO3;⑦曲线c所示溶液中,SO2溶于水后先被溶解的O2氧化为硫酸,再与Ba2+反应生成BaSO4,发生反应的离子方程式为:2Ba2++O2+2SO2+2H2O=2BaSO4↓+4H+;⑧比较b、d两条曲线,O2的存在,使溶液的pH减小很多,或比较c、d两条曲线,有氧参与,pH受酸根离子的影响很小,从而得出曲线d不能说明NO3-是氧化SO2的主要微粒,理由是:b和d两曲线在有氧和无氧条件下pH相差较大(或:c和d两曲线在有无NO3-条件下pH相差不大)。答案为:H2O+SO2=H2SO3;2Ba2++O2+2SO2+2H2O=2BaSO4↓+4H+;不能;b和d两曲线在有氧和无氧条件下pH相差较大(或:c和d两曲线在有无NO3-条件下pH相差不大)。
22.(11分)I.回答下列问题:
(1)硅酸盐具有特殊的性质与应用,回答下列问题:硅酸盐材料是传统无机非金属材料,下列产品属于硅酸盐的是__________(填序号)。
①玻璃 ②陶瓷 ③水晶 ④硅芯片 ⑤光导纤维 ⑥水泥 ⑦砖瓦
(2)SiO2是一种酸性氧化物。
①用化学方程式表示盛装NaOH溶液的试剂瓶不能用玻璃塞的原因:___________________________。
②熔化烧碱应选用的坩埚为________(填字母)。
A.铁坩埚 B.玻璃坩埚 C.石英坩埚 D.瓷坩埚
II.某化学小组模拟工业生产制取HNO3,设计如图所示装置,其中a为一个可持续鼓入空气的橡皮球。
(3)装置E中主要反应的化学方程式为_____________________________________。
(4)F装置用浓NaOH溶液吸收NO2,生成物之一是NaNO2,请写出该反应的离子方程式________________________________________。
(5)装置C中浓硫酸的主要作用是_______________________________________。
(6)干燥管中的碱石灰用于干燥NH3,某同学思考是否可用无水氯化钙代替碱石灰,并设计如图所示装置(仪器固定装置省略未画)进行验证,实验步骤如图:
①用烧瓶收集满干燥的氨气,立即塞如图所示的橡胶塞。
②正立烧瓶,使无水氯化钙固体滑入烧瓶底部,摇动,可以观察到的现象是_______________________,由此,该同学得出结论:不能用CaCl2代替碱石灰。
【答案】(1)①②⑥⑦(2分) (2)①SiO2+2NaOH=Na2SiO3+H2O(2分) ②A(1分)
(3)4NO2+O2+2H2O=4HNO3(2分) (4)2NO2+2OH-=NO3-+NO2-+H2O(2分) (5)干燥气体,吸收多余的NH3(1分) (6)气球膨胀(1分)
【解析】(1)①玻璃是非晶无机非金属材料,一般是用多种无机矿物(如石英砂、硼砂、硼酸、重晶石、碳酸钡、石灰石、长石、纯碱等)为主要原料而制成,属于硅酸盐材料,①正确;②陶瓷是陶器与瓷器的统称,陶是以粘性较高、可塑性较强的粘土为主要原料制成的,不透明、有细微气孔和微弱的吸水性,击之声浊。瓷是以粘土、长石和石英制成,半透明,不吸水、抗腐蚀,胎质坚硬紧密,叩之声脆,均属于硅酸盐材料,②正确;③水晶的主要成分为二氧化硅,不属于硅酸盐材料,③错误;④硅芯片为硅单质,不属于硅酸盐材料,④错误;⑤光导纤维的主要成分为二氧化硅,不属于硅酸盐材料,⑤错误;⑥水泥的主要化学成分为:氧化钙CaO,二氧化硅SiO2,三氧化二铁Fe2O3,三氧化二铝Al2O3,属于硅酸盐材料,⑥正确;⑦砖瓦的主要成分为黏土等,属于硅酸盐材料,⑦正确;综上所述①②⑥⑦符合题意,故答案为:①②⑥⑦;(2)①SiO2是一种酸性氧化物,能与氢氧化钠溶液反应生成粘性强的硅酸钠和水,用化学方程式表示为SiO2+2NaOH=Na2SiO3+H2O,所以盛装NaOH溶液的试剂瓶不能用玻璃塞,应用橡胶塞;②玻璃坩埚、石英坩埚、瓷坩埚的主要成分均含硅酸盐,都能与烧碱反应生成可溶性的硅酸钠,所以不能用于熔化烧碱;铁坩埚不与烧碱反应,所以可用于熔化烧碱,A项符合题意;故答案为:不能;SiO2+2NaOH=Na2SiO3+H2O;A;(3)装置E中利用水吸收NO2和O2的混合气体,生成HNO3,其反应的化学方程式为4NO2+O2+2H2O=4HNO3,故答案为:4NO2+O2+2H2O=4HNO3;(4)由题意有NO2+OH-―→NO2-,NO2中N元素由+4价降为中NO2-的+3价,根据氧化还原反应规律,NO2中N元素由+4价升为中+5价,即生成NO3-,则有NO2+OH-―→NO2-+NO3-,由电荷守恒有NO2+2OH-―→NO2-+NO3-,再据质量守恒得2NO2+2OH-=NO3-+NO2-+H2O,故答案为:2NO2+2OH-=NO3-+NO2-+H2O;(5)浓硫酸可干燥NO、O2,氨气和浓硫酸反应生成硫酸铵,装置C中浓硫酸还可吸收多余的NH3,故答案为:干燥气体,吸收多余的NH3;(6)无水氯化钙与氨气反应,气体减少,压强减小,导致烧瓶内压强小于外界大气压,故可以观察到的现象为:气球膨胀,故答案为:气球膨胀。
23.(13分)NO2(红棕色)和N2O4(无色)之间发生反应:N2O4(g)2NO2(g)。将一定量N2O4气体充入体积为2 L的恒容密闭容器中,控制反应温度为T。
(1)该反应为吸热反应,则反应物的化学键断裂要吸收的能量________(填“大于”、“小于”或“等于”)生成物的化学键形成要放出的能量。
(2)下列可以说明该反应达到平衡的是______。
A.c(N2O4)∶c(NO2)=1∶2 B.v正(N2O4)=2v逆(NO2)
C.容器内气体的颜色不再变化 D.混合气体的压强不再变化
(3)在温度为T的条件下,向该恒容密闭容器中充入0.04 mol·L-1N2O4,c(NO2)随时间的变化曲线如图所示。
①在图中画出0~16 min时间段内,c(N2O4)随时间的变化曲线。
②1~4四个点中,v正=v逆的点有_______。
③反应进行到16 min时,N2O4的转化率是________。
④下列措施能使该反应速率加快的是__________。
A.增大NO2的浓度 B.增大容器体积
C.加入合适的催化剂 D.恒容条件下充入He
(4)NO2、O2和熔融KNO3可制作燃料电池,其原理如图所示。该电池在放电过程中石墨I电极上生成氧化物Y,Y可循环使用,则正极反应式为_________________________。
【答案】(1)大于(1分) (2)CD(2分) (3)①(2分)
②1、2(2分) ③75%(2分) ④AC(2分) (4)O2+2N2O5+4e-=4NO3-(2分)
【解析】(1)断键吸热、成键放热,该反应为吸热反应,说明反应物的化学键断裂要吸收的能量大于生成物的化学键形成要放出的能量;(2)A项,c(N2O4)∶c(NO2)=1∶2,不能判断浓度是否再发生变化,反应不一定平衡,不符合题意;B项,反应达到平衡,正逆反应速率比等于计量数之比即=,v正(N2O4)=2v逆(NO2)反应不平衡,不符合题意;C项,容器内气体的颜色不再变化,说明NO2浓度不变,反应一定达到平衡状态,符合题意;D项,反应前后气体计量数之和不同,压强是变量,混合气体的压强不再变化,反应一定达到平衡状态,符合题意;选CD;(3)①根据图示,0 min时,c(N2O4)=0.04 mol·L-1、4 min时,c(NO2)=0.04 mol·L-1则c(N2O4)=0.04 mol·L-1-0.02 mol·L-1=0.04 mol·L-1,12 min时,c(NO2)=0.06 mol·L-1则c(N2O4)=0.04 mol·L-1-0.03 mol·L-1=0.01 mol·L-1,16 min时,c(NO2)=0.06 mol·L-1则c(N2O4)=0.04 mol·L-1-0.03 mol·L-1=0.01 mol·L-1,c(N2O4)随时间的变化曲线为;②反应达到平衡,正逆反应速率相等,v正=v逆的点有1、2;③反应进行到16 min时,c(NO2)=0.06 mol·L-1,则c(N2O4)减小0.03 mol·L-1,N2O4的转化率是×100%=75%;④A项,反应物浓度增大,反应速率加快,增大NO2的浓度,反应速率加快;B项,增大容器体积,反应物浓度减小,反应速率减慢,;C项,催化剂加快反应速率,加入合适的催化剂,反应速率加快;D项,恒容条件下充入He,反应物浓度不变,反应速率不变;选AC;(4)该电池在放电过程中石墨I电极上NO2发生氧化反应生成氧化物Y,N元素化合价升高,所以Y是N2O5,石墨I电极是负极,则石墨Ⅱ电极是正极,正极氧气得电子与N2O5结合生成硝酸根离子,则正极反应式为O2+2N2O5+4e-=4NO3-。
24.(12分)聚甲基丙烯酸甲酯(PMMA)通常称作有机玻璃,具有高透明度,低价格,易于机械加工等优点。乙烯法是目前唯一实现其工业化的方法。该生产工艺流程如下图。
请回答下列问题:
(1)PMMA属于_______。
A.硅酸盐材料 B.塑料
C.合成橡胶 D.合成纤维
(2)有机物A的官能团名称是___________________,①反应类型为_________________。
(3)甲醛和丙醛互为_______。
A.同位素 B.同分异构体 C.同素异形体 D.同系物
(4)过程④的化学方程式为_______________________________________。
(5)由MMA转化为PMMA的化学方程式为______________________________________,反应类型为_____________。
【答案】(1)B(1分) (2)碳碳双键、羧基(2分) 氧化反应(2分) (3)D(1分)
(4)+CH3OH+H2O(2分)
(5)n(2分) 加聚反应(2分)
【解析】甲醇催化氧化得到甲醛,乙烯与CO和H2反应得到丙醛,甲醛与丙醛发生反应得到,进一步氧化得到A,从MMA的结构简式逆推,结合酯化反应原理可知A的结构简式为,A与甲醇发生酯化反应得到MMA,MMA在催化剂作用下发生加聚反应得到PMMA。
(1)PMMA是甲基丙烯酸甲酯的聚合物,属于塑料,故选B项;(2)据分析,有机物A是,官能团是碳碳双键、羧基;①是甲醇催化氧化生成甲醛过程,反应类型为氧化反应;(3)甲醛和丙醛具有相似的结构,组成上相差2个“CH2”基团,互为同系物,选D项;(4)过程④是A与甲醇发生酯化反应,化学方程式为:+CH3OH+H2O;(5)由MMA转化为PMMA,即甲基丙烯酸甲酯发生了加聚,化学方程式为:n,该反应是加聚反应。
25.(12分)工业废水中的氨氮(以NH3、NH形式存在),可通过微生物法或氧化法处理,使水中氨氮达到国家规定的排放标准。
(1)微生物法:酸性废水中的部分NH在硝化细菌的作用下被氧气氧化为NO3-,NO3-再与NH作用生成N2。
①NH转化为NO3-的离子方程式为___________________________________。
②NO3-与NH在转化为N2的反应中消耗NO3-与NH的物质的量之比为__________。
(2)次氯酸钠氧化法:向氨氮废水中加入NaClO,氨氮转化为N2而除去。
①NaClO氧化NH3的离子方程式为___________________________________。
②一定pH下,NaClO的投加量对污水中氨氮去除率的影响如图所示。当m(NaClO)∶m(NH3)>7.7时,总氮的去除率随m(NaClO)∶m(NH3)的增大不升反降的原因是_____________________________。
(3)活性炭-臭氧氧化法:活性炭-臭氧氧化氨氮的机理如图所示。*表示吸附在活性炭表面的物种,·OH为羟基自由基,其氧化性比O3更强。
①活性炭-臭氧氧化氨氮的机理可描述为_____________________________________________。
②其它条件不变调节废水的pH,废水中氨氮去除率随pH的变化如图所示。随pH增大氨氮去除率先明显增大,后变化较小,可能的原因是_____________________________________________。
【答案】(1)①NH+2O2NO3-+H2O+2H+(2分) ②3∶5(2分)
(2)①3ClO-+2NH3=3Cl-+N2+3H2O(2分) ②NaClO将部分氨氮氧化为NO2-、NO3-留在废水中(2分)
(3)①O3与活性炭表面吸附的HO-作用生成·OH,·OH将活性炭表面吸附的NH转化为N2(2分)
②随pH增大,活性炭上吸附的OH-增多,生成·OH增多;pH继续增大时,OH-将NH转化为NH3,不利于活性炭对氨氮的吸附(2分)
【解析】(1)①NH转化为NO3-,N元素化合价从-3升高到+5价,氧元素从0价降低到-2价,则按得失电子数守恒、电荷守恒、元素质量守恒得离子方程式为NH+2O2NO3-+H2O+2H+;②NO3-与NH在转化为N2的反应中,NO3-N2、NHN2,n(NO3-)×5=n(NH)×3,n(NO3-)∶n(NH)=3∶5,消耗NO3-与NH的物质的量之比为3∶5;(2)①ClO-氧化氨气为氮气,反应中,氮元素从-3价升高到0价、氯元素从+1价降低到-1价,则按得失电子数守恒、元素质量守恒、电荷守恒得离子反应方程式为:3ClO-+2NH3=3Cl-+N2+3H2O;②根据一定pH下,NaClO的投加量对污水中氨氮去除率的影响图。当m(NaClO)∶m(NH3)>7.7时,总氮的去除率随m(NaClO)∶m(NH3)的增大不升反降、意味着溶液中生成了其它含氮的微粒,应该是氨气被氧化的产物,则原因是:NaClO将部分氨氮氧化为NO2-、NO3-留在废水中;(3)①由图可知:活性炭-臭氧氧化氨氮的机理可描述为:O3与活性炭表面吸附的HO-作用生成·OH,·OH将活性炭表面吸附的NH转化为N2;②结合信息可知:生成·OH增多时反应速率增大。则随pH增大氨氮去除率先明显增大后变化较小的可能原因是:随pH增大,活性炭上吸附的OH-增多,生成·OH增多;pH继续增大时,OH-将NH转化为NH3,不利于活性炭对氨氮的吸附。
期末测试卷B-【期末冲刺】2022-2023学年高一化学期末复习测试卷(人教版2019必修第二册): 这是一份期末测试卷B-【期末冲刺】2022-2023学年高一化学期末复习测试卷(人教版2019必修第二册),共15页。试卷主要包含了单选题,填空题,实验题,计算题,推断题等内容,欢迎下载使用。
期末测试卷A-【期末冲刺】2022-2023学年高一化学期末复习测试卷(人教版2019必修第二册): 这是一份期末测试卷A-【期末冲刺】2022-2023学年高一化学期末复习测试卷(人教版2019必修第二册),共14页。试卷主要包含了单选题,填空题,实验题,计算题等内容,欢迎下载使用。
期末测试卷C-【期末冲刺】2022-2023学年高一化学期末复习测试卷(人教版2019必修第二册): 这是一份期末测试卷C-【期末冲刺】2022-2023学年高一化学期末复习测试卷(人教版2019必修第二册),共14页。试卷主要包含了单选题,填空题,实验题,推断题,计算题等内容,欢迎下载使用。












