06 常考题空6 有关晶胞参数的计算 (附答案解析)-备战高考化学大题逐空突破系列(全国通用)
展开常考题空6 有关晶胞参数的计算
【高考必备知识】
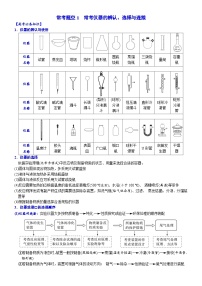
1.晶胞参数(边长)与半径的关系
晶体
晶体结构
图示关系
晶胞参数与边长关系
简单立方晶胞
晶胞参数(边长)为a,原子球半径为r,则有a=2r
体心立方晶胞
晶胞参数(边长)为a,原子球半径为r,体对角线长为c,则有c=a=4r
面心立方晶胞
晶胞参数(边长)为a,原子球半径为r,则有4r=a
六方最密堆积晶胞
晶胞中原子球半径为r,六棱柱边长为a,高为h,则有a=2r,h=2倍四面体高
金刚石晶胞
金刚石晶胞
G点是空的,没有球,是正立方体的体心,A球心到E球心,是2个半径,即一个直径;同样,E球心到G,是2个半径,即一个直径,所以AG是两个直径,体对角线是AG的两倍,所以体对角线是4个直径,即8r,则有8r=a
晶胞参数(边长)为a,原子球半径为r,则有8r=a。(体对角线上五球相切,其中有两个假想球)
2.晶体密度及微粒间距离的计算
晶体密度的计算公式推导过程
若1个晶胞中含有x个微粒,则晶胞的物质的量为:n==mol
晶胞的质量为:m=n·M=g,则密度为:ρ=
右图为CsCl晶体的晶胞
假设相邻的两个Cs+的核间距为a cm,NA为阿伏加德罗常数,CsCl的摩尔质量用M g·mol-1表示,则CsCl晶体的密度为ρ=g·cm-3
3.金属晶体空间利用率的计算方法
(1)空间利用率的定义及计算步骤
①空间利用率(η):指构成晶体的原子、离子或分子总体积在整个晶体空间中所占有的体积百分比
②
(2)金属晶体空间利用率分类简析
类型
晶体结构示意图
图示关系
简单立方堆积
原子的半径为r,立方体的棱长为2r,则V球=πr3,V晶胞=(2r)3=8r3,空间利用率=×100%=×100%=≈52%
体心立方晶胞
原子的半径为r,体对角线c为4r,面对角线b为a,由(4r)2=a2+b2得a=r。1个晶胞中有2个原子,故空间利用率=×100%=×100%=×100%=≈68%
面心立方最密堆积
原子的半径为r,面对角线为4r,a=2r,V晶胞=a3=(2r)3=16r3,1个晶胞中有4个原子,则空间利用率=×100%=×100%=≈74%
六方最密堆积
原子的半径为r,底面为菱形(棱长为2r,其中一个角为60°),则底面面积S=2r×r=2r2,h=r,V晶胞=S×2h=2r2×2×r=8r3,1个晶胞中有2个原子,则空间利用率=×100%=×100%=≈74%
金刚石型堆积
金刚石晶胞
设原子半径为R,由于原子在晶胞体对角线方向上相切(相邻两个碳原子之间的距离为晶胞体对角线的四分之一),可以计算出晶胞参数:a=b=c=R,α=β=γ=90°。每个晶胞中包含八个原子。
η=×100%=×100%≈34.01%
【常见计算类型】
题型一、晶体密度的计算
1.砷化硼的晶胞结构如图所示。与砷原子紧邻的硼原子有________个,与每个硼原子紧邻的硼原子有________个,若其晶胞参数为b pm,则该晶体的密度为________g·cm-3(列出表达式,设NA为阿伏加德罗常数的值)
2.金属钛有两种同素异形体,常温下是六方堆积,高温下是体心立方堆积。如图所示是钛晶体的一种晶胞,晶胞参数a=0.295 nm,c=0.469 nm,则该钛晶体的密度为____________g·cm-3(用NA表示阿伏加德罗常数的值,列出计算式即可)。
3.锑酸亚铁晶胞如图所示,其晶胞参数分别为a nm、b nm、c nm,α=β=γ=90°,则:
(1)锑酸亚铁的化学式为___________
(2)晶体的密度为________g·cm-3(设NA为阿伏加德罗常数的值)
题型二、晶体中微粒半径或距离的计算
4.Ti的某氧化物和CaO相互作用能形成钛酸盐的晶胞结构如图所示(Ti4+位于立方体的顶点,Ca2+处于立方体的中心)。该晶体中,Ti4+和周围________个O2-紧相邻;若该晶胞的密度为d g·cm-3,则钛氧键的键长为______pm(用含NA的代数式表示)
5.Zn与S形成的某种化合物的晶胞结构如图所示:
(1)S2-填入由Zn2+围成的________空隙中
(2)若晶胞参数为540 pm,Zn2+和S2-间的最短距离为________pm
6.“嫦娥五号”某核心部件主要成分为纳米钛铝合金,其结构单元如图所示(Al、Ti原子各有一个原子在结构单元内部),则该合金的化学式为___________,已知该合金的密度为ρ g·cm-3,该结构单元底面(正六边形)边长为a nm,则结构单元的高h为___________nm(列出计算式,设NA为阿伏加德罗常数的值)
题型三、晶体中空间利用率的计算
7.金刚石晶胞结构如图丙所示,则金刚石晶体含有______个碳原子。若碳原子半径为r,金刚石晶胞的边长为a,根据硬球接触模型,则r=______a,列式表示碳原子在晶胞中的空间占有率:________________(不要求计算结果)。
8.CdSe的一种晶体为闪锌矿型结构,晶胞结构如图所示。该晶胞中Cd—Se键的键长为__________,已知Cd和Se的原子半径分别为rCd nm和rSe nm,则该晶胞中原子的空间利用率为________________
9.铜银合金是优质的金属材料,其晶胞与铜晶胞类似,其中Ag位于顶角,Cu位于面心,如图1所示。
(1)该铜银合金的化学式是_________
(2)已知该铜银晶胞的参数为a cm、晶体密度为ρ g·cm-3,则阿伏加德罗常数(NA)为________mol-1(用代数式表示,下同)
(3)若Ag、Cu的原子半径分别为b cm、c cm,则该晶胞中原子空间利用率φ=________
【真题演练】
1.(2022·全国甲卷)萤石(CaF2)是自然界中常见的含氟矿物,其晶胞结构如图所示,X代表的离子是_______;若该立方晶胞参数为a pm,正负离子的核间距最小为_______pm
2.(2022·全国乙卷)α-AgI晶体中I-离子作体心立方堆积(如图所示),Ag+主要分布在由I-构成的四面体、八面体等空隙中。在电场作用下,Ag+不需要克服太大的阻力即可发生迁移。因此,α-AgI晶体在电池中可作为_______,已知阿伏加德罗常数为NA,则α-AgI晶体的摩尔体积Vm=_______m3·mol-1(列出算式)
3.(2022·湖南卷)钾、铁、硒可以形成一种超导材料,其晶胞在xz、yz和xy平面投影分别如图所示:
(1)该超导材料的最简化学式为_______
(2)Fe原子的配位数为_______
(3)该晶胞参数a=b=0.4 nm、c=1.4 nm。阿伏加德罗常数的值为NA,则该晶体的密度为______ g·cm-3 (列出计算式)
4.(2022·广东卷)我国科学家发展了一种理论计算方法,可利用材料的晶体结构数据预测其热电性能,该方法有助于加速新型热电材料的研发进程。化合物X是通过该方法筛选出的潜在热电材料之一,其晶胞结构如图1,沿x、y、z轴方向的投影均为图2
(1)X的化学式为_______
(2)设X的最简式的式量为Mr,晶体密度为ρ g·cm-3,则X中相邻K之间的最短距离为_______(列出计算式,NA为阿伏加德罗常数的值)
5.(2022·北京卷)FeS2晶胞为立方体,边长为a nm,如图所示。
(1)与Fe2+紧邻的阴离子个数为___________
(2)晶胞的密度为ρ=___________ g·cm-3 (1 nm=10-9m)
6.(2021·全国甲卷)我国科学家发明了高选择性的二氧化碳加氢合成甲醇的催化剂,其组成为ZnO/ZrO2固溶体。四方ZrO2晶胞如右图所示。Zr4+离子在晶胞中的配位数是________,晶胞参数为a pm、a pm、c pm,该晶体密度为__________________g·cm-3(写出表达式)。在ZrO2中掺杂少量ZnO后形成的催化剂,化学式可表示为ZnxZr1-xOy,则y=________(用x表达)
7.(2021·全国乙卷)在金属材料中添加AlCr2颗粒,可以增强材料的耐腐蚀性、硬度和机械性能。AlCr2具有体心四方结构,如图所示。处于顶角位置的是________原子。设Cr和Al原子半径分别为rCr和rAl,则金属原子空间占有率为________%(列出计算表达式)
8.(2021·湖南卷)下图是Mg、Ge、O三种元素形成的某化合物的晶胞示意图。
(1)已知化合物中Ge和O的原子个数比为1∶4,图中Z表示________原子(填元素符号),该化合物的化学式为____________
(2)已知该晶胞的晶胞参数分别为a nm、b nm、c nm,α=β=γ=90°,则该晶体的密度ρ=________g·cm-3(设阿伏加德罗常数的值为NA,用含a、b、c、NA的代数式表示)
9.(2021·河北卷)分别用°、•表示H2PO和K+,KH2PO4晶体的四方晶胞如图(a)所示,图(b)、图(c)分别显示的是H2PO、K+在晶胞xz面、yz面上的位置,若晶胞底边的边长均为a pm、高为c pm,阿伏加德罗常数的值为NA,晶体的密度为________g·cm-3(写出表达式)。
10.(2021·广东卷)理论计算预测,由汞(Hg)、锗(Ge)、锑(Sb)形成的一种新物质X为潜在的拓扑绝缘体材料。X的晶体可视为Ge晶体(晶胞如图a所示)中部分Ge原子被Hg和Sb取代后形成
(1)图b为Ge晶胞中部分Ge原子被Hg和Sb取代后形成的一种单元结构,它不是晶胞单元,理由是______________
(2)图c为X的晶胞,X的晶体中与Hg距离最近的Sb的数目为________;该晶胞中粒子个数比Hg∶Ge∶Sb=________
(3)设X的最简式的式量为Mr,则X晶体的密度为________________g·cm-3(列出算式)
【题组训练】
1.CuBr是化学常用的催化剂,其晶胞结构如下图所示,晶胞参数为a pm。CuBr的密度为d g·cm-3,请用a和d表示阿伏加德罗常数的值__________
2.(1)钙钛矿是重要的含钛矿物之一。其主要成分Z的晶胞如图所示。推测Z的化学式为________,Ca填充在O围成的________空隙中
(2)若晶胞参数a=384.1 pm,Z晶体的密度为________(计算结果保留两位有效数字,已知3.8413≈56.67,阿伏加德罗常数的值为6.02×1023)
3.XeF2晶体属四方晶系,晶胞参数如图所示,晶胞棱边夹角均为90°,该晶胞中有________个XeF2分子。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称为原子的分数坐标,如A点原子的分数坐标为。已知Xe—F键长为r pm,则B点原子的分数坐标为_______;晶胞中A、B间距离d=_______pm
4.从石墨晶体结构示意图中截取石墨的晶胞如图所示,设阿伏加德罗常数的值为NA,已知sin 60°=,石墨晶体的密度ρ为___________g·cm-3(列出计算式)
5.某种钛酸钴(CoTiO3)晶胞沿x、y或z轴任意一个方向的投影如图1所示。晶胞中Co处于各顶角位置,则O处于________位置,与Co紧邻的O的个数为________。若晶胞中Co与O之间的最短距离为a nm,阿伏加德罗常数的值为NA,该晶体的密度为________ g·cm-3(列出计算式即可)
6.汞钡铜氧晶体的晶胞如图A所示,通过掺杂Ca2+获得的具有更高临界温度的超导材料如图B所示。汞钡铜氧晶体的密度为________g·cm-3(设NA为阿伏加德罗常数的值)。掺杂Ca2+所得超导材料的化学式为__________
7.Li2O具有反萤石结构,晶胞如图所示。已知晶胞参数为0.466 5 nm,阿伏加德罗常数的值为NA,则Li2O的密度为________g·cm-3(列出计算式)
8.(1)YxNiyBzCw在临界温度15.6 K时可实现超导,其晶胞结构如图1所示,则其化学式为_____________
(2)①铁有δ、γ、α三种同素异形体(如图2),若Fe原子半径为r pm,NA表示阿伏加德罗常数的值,则γFe单质的密度为________________g·cm-3(列出计算式即可)
②在立方晶胞中与晶胞体对角线垂直的面在晶体学中称为(1,1,1)晶面,如图3,则αFe晶胞体中(1,1,1)晶面共有________个
9.用晶体的X-射线衍射法对Cu的测定得到以下结果:Cu的晶胞为面心立方最密堆积(如下图),已知该晶体的密度为9.00 g·cm-3,晶胞中该原子的配位数为________;Cu的原子半径为_______cm。(阿伏加德罗常数为NA,要求列式计算)
10.NiAs的晶胞结构如图所示,镍离子的配位数为_____,若阿伏加德罗常数的值为 NA,晶体密度为ρ g·cm-3,则该晶胞中最近的砷离子之间的距离为________pm。
11.金属锰有多种晶型,其中δMn的结构为体心立方堆积,晶胞参数为a pm。δMn中锰的原子半径为________pm。已知阿伏加德罗常数的值为NA,δMn的理论密度ρ=__________g·cm-3(列出计算式)
12.已知TiN晶体的晶胞结构如图1所示,若该晶胞的密度为ρ g·cm-3,阿伏加德罗常数的值为NA,则晶胞中Ti原子与N原子的最近距离为________ pm。(用含ρ、NA的代数式表示)
13.立方氮化硼硬度仅次于金刚石,但热稳定性远高于金刚石,其晶胞结构如图所示。立方氮化硼属于________晶体,其中硼原子的配位数为__________。已知:立方氮化硼密度为d g·cm-3,B原子半径为x pm,N原子半径为y pm,阿伏加德罗常数的值为NA,则该晶胞中原子的空间利用率为_____________(列出化简后的计算式)
14.Cu与F形成的化合物的晶胞结构如图所示,若晶体密度为a g·cm-3,则Cu与F最近距离为________pm(用NA表示阿伏加德罗常数的值,列出计算表达式,不用化简)
15.稀土资源是重要的战略资源,如图为某稀土元素A的氧化物晶体的立方晶胞结构示意图,其中氧离子占据顶点、面心、棱心、体心的位置,A离子占据半数的立方体空隙。写出A氧化物的化学式________,A离子的配位数为_____,已知晶胞参数为a pm,则A—A间距为_________pm,设A的摩尔质量为MA g·mol-1,晶体的密度为______________g·cm-3
16.(1)FeTiO3的结构如图1所示,其中由O围成的____________(填“四面体空隙”或“八面体空隙”)被Fe占据。在图2中画出FeTiO3结构的另一种表示(要求:Fe处于晶胞的顶点),Ti的配位数为________
(2)已知该晶胞的密度为ρ g·cm-3,NA表示阿伏加德罗常数的值。计算晶胞参数a=________pm(列出计算表达式)
17.MgH2晶体属四方晶系,其晶胞结构如图2所示,晶胞参数a=b=450 pm,c=301 pm,原子坐标为
A(0,0,0)、B(0.305,0.305,0)、C(1,1,0.67)、D(0.195,0.805,0.5)
(1)Mg2+的半径为72 pm,则H-的半径为________pm(列出计算式即可)
(2)用NA表示阿伏加德罗常数的值,MgH2晶体中H-的密度是标准状况下氢气密度的________倍(列出计算式即可,标准状况下氢气的密度为0.089 g·L-1)
18.研究发现,氨硼烷在低温高压条件下为正交晶系结构,晶胞参数分别为a pm、b pm、c pm,α=β=γ=90°。氨硼烷的2×2×2超晶胞结构如图所示,氨硼烷晶体的密度ρ=________g·cm-3(列出计算式,设NA为阿伏加德罗常数的值)
19.NaH具有NaCl型晶体结构,已知NaH晶体的晶胞参数a=488 pm,Na+半径为102 pm,H-的半径为________,NaH的理论密度是________ g·cm-3(保留两位小数)
20.CoO的面心立方晶胞如图1所示。设阿伏加德罗常数的值为NA,则CoO晶体的密度为________g·cm-3;三种元素二价氧化物的晶胞类型相同,其熔点由高到低的顺序为_________
21.图(a)是MgCu2的拉维斯结构,Mg以金刚石方式堆积,八面体空隙和半数的四面体空隙中,填入以四面体方式排列的Cu。图(b)是沿立方格子对角面取得的截图。可见,Cu原子之间最短距离x= pm,Mg原子之间最短距离y= pm。设阿伏加德罗常数的值为NA,则MgCu2的密度是 g·cm−3(列出计算表达式)
22.一种四方结构的超导化合物的晶胞如图1所示。晶胞中Sm和As原子的投影位置如图2所示。图中F-和O2-共同占据晶胞的上下底面位置,若两者的比例依次用x和1-x代表,则该化合物的化学式表示为__________________;通过测定密度ρ和晶胞参数,可以计算该物质的x值,完成它们关系表达式:ρ=________ g·cm-3。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,例如图1中原子1的坐标为,则原子2和3的坐标分别为________、________。
23.MgO具有NaCl型结构(如图),其中阴离子采用面心立方最密堆积方式,X射线衍射实验测得MgO的晶胞参数为a=0.420 nm,则r(O2-)为_____nm。MnO也属于NaCl型结构,晶胞参数为a′=0.448 nm,则r(Mn2+)为________nm
24.两种含硅化合物的晶胞结构如图所示
(1)这两种含硅化合物的化学式分别为__________和__________
(2)Ⅰ的晶胞参数为a pm,则Ⅰ的密度为________g·cm-3
(3)Ⅱ的晶胞参数为b pm,Si和P的原子半径分别为r1 pm和r2 pm,则Ⅱ的空间占有率为____________
【常考题空6 有关晶胞参数的计算】
【常见计算类型】
1.4 12
解析:由均摊法计算该晶胞中砷原子个数为4,硼原子个数为8×+6×=4,所以晶胞质量为 g,晶胞体积为(b×10-10)3cm3,根据密度=质量÷体积,所以晶体密度为 g·cm-3。
2.
解析:每个晶胞含Ti原子数为12×+3+2×=6,晶胞的质量是 g,晶胞的体积是×(2.95×10-8)2×4.69×10-8cm3,根据ρ== g·cm-3。
3.(1)Fe(SbO3)2
(2)
解析:(1)据图可知一个晶胞中含有Sb原子的个数为8×+2=4,O原子的个数为4×+10=12个,Fe2+的个数为8×+1=2,所以锑酸亚铁的化学式为Fe(SbO3)2。(2)晶胞的质量为 g= g,晶体的体积为abc nm3=abc×10-21 cm3,所以晶体的密度为= g·cm-3。
4.12 ××1010
解析:由晶胞结构图可知,体心为Ca2+,面心为O2-,该晶体中每个顶点Ti4+与面心的O2-相邻,每个顶点为8个晶胞共用,每个面为2个晶胞共用,晶体中Ti4+周围紧相邻的O2-数目为3×8×=12;如图晶胞中Ti4+个数为8×=1,Ca2+个数为1,O2-个数为6×=3,令晶胞边长为x pm,ρ=,则d=,x=×1010,则钛氧键的键长为 ××1010pm。
5.(1)正四面体
(2)135
解析:(1)分析晶胞结构图知S2-填入Zn2+围成的正四面体空隙中。(2)Zn2+和S2-间的最短距离为晶胞体对角线长的,故最短距离为540 pm×=135 pm。
6.Ti11Al5 ×1021
解析:分析晶胞结构可知,Al位于体内和顶点,Ti分别位于晶胞的顶点、面心、体内和棱上,Ti原子个数=8×+2×+1×+1=,Al原子个数=4×+1=,所以该合金的化学式为Ti11Al5,晶胞质量m= g= g,晶胞的体积为V=Sh=a2h nm3,依据密度公式联立体积公式可知h=×1021 nm。
7.8 ×100%
解析:由金刚石的晶胞结构可知,晶胞中C原子数目为4+6×+8×=8;若C原子半径为r,金刚石晶胞的边长为a,根据硬球接触模型可知,正方体体对角线长度的就是C—C键长,即a=2r,所以r=a,碳原子在晶胞中的空间占有率为×100%。
8.a ×100%
解析:Cd—Se键的键长为晶胞体对角线长的,故键长为a,晶胞中原子占的总体积为×4,晶胞体积为a3,故晶胞中原子的空间利用率=×100%。
9.(1)AgCu3(或Cu3Ag)
(2)
(3)×100%
【真题演练】
1.Ca2+ a pm
解析:根据萤石晶胞结构,浅色X离子分布在晶胞的顶点和面心上,则1个晶胞中浅色X离子共有8×+6×=4个,深色Y离子分布在晶胞内部,则1个晶胞中共有8个深色Y离子,因此该晶胞的化学式应为XY2,结合萤石的化学式可知,X为Ca2+;根据晶胞,将晶胞分成8个相等的小正方体,仔细观察CaF2的晶胞结构不难发现F-位于晶胞中8个小立方体中互不相邻的4个小立方体的体心,小立方体边长为,体对角线为,Ca2+与F-之间距离就是小晶胞体对角线的一半,因此晶体中正负的核间距的最小的距离为a pm,故答案为:Ca2+、a pm。
2.电解质
解析:由题意可知,在电场作用下,Ag+不需要克服太大阻力即可发生迁移,因此α-AgI晶体是优良的离子导体,在电池中可作为电解质;每个晶胞中含碘离子的个数为8+1=2个,依据化学式AgI可知,银离子个数也为2个,晶胞的物质的量n=mol=mol,晶胞体积V=a3pm3=(50410-12)3m3,则α-AgI晶体的摩尔体积Vm===m3/mol。
3.(1)KFe2Se2
(2)4
(3)
解析:(1)由平面投影图可知,晶胞中位于顶点和体心的钾原子个数为8×+1=2,铁原子位于面心,原子个数为8×=4,位于棱上和体心的硒原子的个数为8×+2=4,则超导材料最简化学式为KFe2Se2,故答案为:KFe2Se2;
(2)由平面投影图可知,位于棱上的铁原子与位于面上的硒原子的距离最近,所以铁原子的配位数为4,故答案为:4;(3)设晶体的密度为dg/cm3,由晶胞的质量公式可得:=abc×10—21×d,解得d=,故答案为:。
4.(1)K2SeBr6
(2)
解析:(1)根据晶胞结构得到K有8个,有,则X的化学式为K2SeBr6;故答案为:K2SeBr6。(2)设X的最简式的式量为,晶体密度为,设晶胞参数为anm,得到,解得,X中相邻K之间的最短距离为晶胞参数的一半即;故答案为:。
5.(1)6
(2)×1021
解析:(1)由晶胞结构可知,晶胞中位于顶点的亚铁离子与位于棱上的阴离子S离子间的距离最近,则亚铁离子紧邻的阴离子个数为6,故答案为:6;
(2)由晶胞结构可知,晶胞中位于顶点和面心的亚铁离子个数为8×+6×=4,位于棱上和体心的S离子个数为12×+1=4,设晶体的密度为dg/cm3,由晶胞的质量公式可得:==10—21a3d,解得d=×1021,故答案为:×1021;
6.8 2-x
解析:以ZrO2晶胞结构的上面面心的Zr4+为研究对象,将晶体结构向上由1个晶胞延长为2个晶胞,可观察到与该Zr4+距离最近的O有8个,则Zr4+的配位数为8。该晶胞中含8个O,Zr4+个数为8×+6×=4(个),则1个晶胞的质量为 g,1个晶胞的体积为a2c×10-30 cm3,则该晶体的密度为 g·cm-3。该晶体中,Zr为+4价,Zn为+2价,O为-2价,由化合物中各元素化合价代数和为0可得,2x+4×(1-x)-2y=0,解得y=2-x。
7.铝 ×100
解析:由题图可知,1个晶胞中所含黑球的个数为8×+1=2(个),白球的个数为8×+2=4(个),已知该物质的化学式为AlCr2,故黑球代表铝原子,位于顶角和体心,白球代表铬原子,位于棱上和晶胞内。由题给晶胞图可知,该晶胞的体积为a2c,则金属原子空间占有率=×100%,即×100%。
8.(1)O Mg2GeO4
(2)
解析:(1)由晶胞结构图可知,1个晶胞中,对于X原子,8个位于顶点、4个位于棱上、6个位于面上、3个位于晶胞内,故1个晶胞中含有X的数目为8×+4×+6×+3=8(个);对于Y原子,4个Y原子均位于晶胞内;对于Z原子,16个Z原子均位于晶胞内。其中Ge和O的原子个数比为1∶4,则X为Mg,Y为Ge,Z为O。由上述分析可知,该化合物的化学式为Mg2GeO4。(2)1个晶胞的质量= g= g,1个晶胞的体积=abc×10-21 cm3,则晶体的密度ρ== g·cm-3。
9.
解析:由题给KH2PO4晶体的四方晶胞图可知,每个晶胞中,K+个数为6×+4×=4(个),H2PO个数为8×+4×+1=4(个),则1个KH2PO4晶体的四方晶胞中有4个KH2PO4,晶体密度等于晶胞质量除以晶胞体积,其中晶胞体积为a2c×10-30 cm3,晶胞的质量为 g,所以晶体的密度为 g·cm-3。
10.(1)图b中上、下两个面的面心原子在上、下平移过程中不能重合
(2)4 1∶1∶2
(3)
解析:(1)题图b中上、下两个面的面心原子分别为Hg和Ge,晶胞结构不对称,不符合晶胞平移后重合的特性,因此不是晶胞单元。(2)由题图c可知,X的晶体中与Hg距离最近的Sb的数目为4;该晶胞中Hg原子数=4×+6×=4(个),Ge原子数=8×+4×+1=4(个),Sb原子数为8,故Hg、Ge、Sb粒子个数比为4∶4∶8=1∶1∶2。(3)该晶胞的组成为Hg4Ge4Sb8,由于最简式的式量为Mr,则晶胞的质量为 g,晶胞的体积为x2y×10-21 cm3,则晶体的密度为 g·cm-3= g·cm-3。
【题组训练】
1.
解析:该晶胞中Cu个数=6×+8×=4、Br个数=4,则该晶胞体积=(a×10-10 cm)3,CuBr的密度===d g·cm-3,阿伏加德罗常数的值=。
2.(1)CaTiO3 正八面体
(2)4.0 g·cm-3
解析:(1)根据晶胞结构,顶角粒子占,面心粒子占,内部粒子为整个晶胞所有,所以一个晶胞中的Ti为8×=1个,Ca为1个,O为6×=3个,所以Z的化学式为CaTiO3。根据晶胞结构示意图可知,Ca填充在O围成的正八面体空隙中。
(2)设有1 mol Z晶体的晶胞,即有NA个Z晶体的晶胞。1个晶胞的体积V=384.13 pm3=384.13×10-30 cm3,1 mol晶胞的质量m=1 mol×136 g·mol-1=136 g,所以Z晶体密度为ρ== g·cm-3≈4.0 g·cm-3。
3.2
解析:图中大球的个数为8×+1=2,小球的个数为8×+2=4,根据XeF2的原子个数比知大球是Xe原子,小球是F原子,该晶胞中有2个XeF2分子;由A点坐标知该原子位于晶胞的中心,且每个坐标系的单位长度都记为1,B点在棱的处,其坐标为;图中y是底面对角线的一半,
y=a,x=-r,
所以d== pm。
4.
解析:设晶胞的底边长为a cm,高为h cm,由图可知,晶胞中含4个C原子,石墨晶体的密度为ρ= g·cm-3=g·cm-3。
5.面心 12
解析:CoTiO3晶胞中Co处于各顶角位置,则Co的数目为1,由晶体的化学式CoTiO3可知晶胞中O的数目为3,Ti的数目为1,结合题图1可知O处于面心位置,Ti处于体心位置。由题图1可知与Co紧邻的O的个数为12。若晶胞中Co与O之间的最短距离(面对角线长度的一半)为a nm,则晶胞参数为a×10-7 cm,该晶体的密度ρ=== g·cm-3= g·cm-3。
6. HgBa2CaCu2O6
解析:(2)根据汞钡铜氧晶体的结构可知,晶胞中Hg有8×=1个、Ba有2个、Cu有4×=1个、O有8×+4×=4个,其密度为ρ== g·cm-3,根据掺杂Ca2+所得超导材料的结构可知,晶胞中含有1个Ca、1个Hg、2个Ba、2个Cu、6个O,化学式为HgBa2CaCu2O6。
7.
解析:(3)由题给图示可知,Li位于晶胞内部,O位于顶点和面心,因此一个晶胞有8个Li,O原子个数=6×+8×=4。因此一个Li2O晶胞的质量= g,一个晶胞的体积为(0.466 5×10-7)3cm3,即该晶体密度= g·cm-3。
8.(1)YNi2B2C
(2)① ②8
解析:(1)由图1可知Y原子数为8×+1=2,Ni原子位于晶胞面上,则原子数为8×=4,B原子位于棱上和体心,则原子数为8×+2=4,C原子位于棱上和面上,则原子数为4×+2×=2,所以四种原子数之比为1∶2∶2∶1,化学式为YNi2B2C。(2)①铁有δ、γ、α三种同素异形体(如图2),若Fe原子半径为r pm,NA表示阿伏加德罗常数的值,γFe中一个晶胞中含有Fe的个数为8×+6×=4,晶胞质量m=56×4 g,晶胞边长a与Fe的半径的关系为a=4r,所以a=2r,晶胞体积V=a3 pm3=(2r×10-10)3cm3,晶体密度ρ=;
②在立方晶胞中与晶胞体对角线垂直的面在晶体学中称为(1,1,1)晶面,该立方晶胞体中(1,1,1)晶面共有8个,如图所示①与3、6体对角线垂直的晶面是1、5、7和2、4、8,②与4、5体对角线垂直的晶面是2、6、8和1、3、7,③与1、8体对角线垂直的晶面是3、5、7和2、4、6,④与2、7体对角线垂直的晶面是4、6、8和1、3、5。
9.12 × cm≈1.28×10-8
解析:设晶胞的边长为a cm,则a3·ρ·NA=4×64,a=,面对角线为a,面对角线的为Cu原子半径,
r=× cm≈1.28×10-8cm。
10.4 ×1010
解析:该晶胞中含有的Ni3+数目为×8+×6=4,含有的As3-数目为4,由图可知砷离子的配位数为4,则镍离子的配位数也为4;设其棱长为a cm,其质量为 g,所以a= ,而As3-位于其晶胞的体心,两个As3-间的距离相当于面对角线的一半,即为 ×1010pm。
11.a
解析:δMn的结构为体心立方堆积,设锰原子的半径为r,则体对角线为4r,则有a=4r,r=a;一个晶胞中含有锰原子的数目=8×+1=2,根据ρ===。
12. ×1010
解析:白色球个数=8×+6×=4、黑色球个数=12×+1=4,晶胞棱长= ,晶胞中Ti原子与N原子的最近距离为棱长的一半=× =× cm=×1010 pm。
13.原子(共价) 4 ×100%
解析:立方氮化硼硬度仅次于金刚石,晶体类型类似于金刚石,是原子(共价)晶体,晶体中每个N原子连接4个B原子,晶胞中N原子数为4,B原子数=8×+6×=4,氮化硼化学式为BN,所以晶胞中每个B原子连接4个N原子,即硼的配位数为4,晶胞质量m= g= g,V== cm3= cm3。N、B原子总体积V1=4×=·(x3+y3)·10-30 cm3。晶胞中原子的空间利用率×100%=
×100%=×100%
14.××1010
15.AO2 8 a
解析:根据图中信息得到氧离子个数为8×+12×+6×+1=8,A个数为4,因此A氧化物的化学式AO2,A离子周围紧邻的氧离子有8个,因此A离子的配位数为8。已知晶胞参数为a pm,则A—A间距为面对角线的一半,因此A—A间距为a pm,A的摩尔质量为MA g·mol-1,晶体的密度为ρ== g·cm-3= g·cm-3。
16.(1)八面体空隙 12
(2) ×1010
解析:(1)由图1晶体结构可知,由O原子围成的八面体空隙被Fe原子占据,钛原子处于晶胞顶点时,铁原子位于体心,氧原子位于面心,当铁原子处于晶胞的顶点时,钛原子位于体心,氧原子位于棱上,晶胞结构示意图为,与钛原子距离最近的氧原子有12个,则钛原子的配位数为12。(2)由晶胞的质量公式可得:ρ=,则晶胞参数a=×1010 pm。
17.(1)(0.305×450-72)
(2)
解析:(1)由题图2可知A与B之间的距离=0.305×450 pm=r(Mg2+)+r(H-),则r(H-)=(0.305×450-72)pm。(2)由题图2可知晶胞中H-的个数为4×+2=4,则晶胞中H-的密度 ρ== g·cm-3,故MgH2晶体中H-的密度÷标准状况下氢气的密度==。
18.
解析:氨硼烷的2×2×2超晶胞结构的晶胞参数分别为2apm=2a×10-10cm、2b pm=2b×10-10cm、2c pm=2c×10-10cm、α=β=γ=90°,则晶胞的体积V(晶胞)=8abc×10-30cm3。由晶胞结构可知,每个晶胞含有16个NH3BH3分子,则每个晶胞的质量m(晶胞)=g,氨硼烷晶体的密度ρ=== g·cm-3。
19.142 pm 1.37
解析:由NaCl晶胞可知,NaH晶胞中Na+位于棱上和体心,H-位于顶角和面心,故NaH晶胞的边长相当于H-的直径和Na+的直径之和,故H-的半径为=142 pm。NaH晶胞中含有4个Na+和4个H-,则该晶体的密度为≈1.37 g·cm-3。
20. NiO>CoO>FeO
21.a a
解析:观察图(a)和图(b)知,4个铜原子相切并与面对角线平行,有(4x)2=2a2,x=a。镁原子堆积方式类似金刚石,有y=a。已知1 cm=1010 pm,晶胞体积为(a×10-10)3 cm3,代入密度公式计算即可。
22.SmFeAsO1-xFx
解析:由晶胞结构中各原子所在位置可知,该晶胞中Sm个数为4×=2,Fe个数为1+4×=2,As个数为4×=2,O或F个数为8×+2×=2,即该晶胞中O和F的个数之和为2,F-的比例为x,O2-的比例为1-x,故该化合物的化学式为SmFeAsO1-xFx。1个晶胞的质量为 g
= g,1个晶胞的体积为a2c pm3=a2c×10-30 cm3,故密度ρ= g·cm-3。原子2位于底面面心,其坐标为;原子3位于棱上,其坐标为。
23.(1)0.148 0.076
解析:因为O2-是面心立方最密堆积方式,面对角线是O2-半径的4倍,即4r=a,解得r=×0.420 nm=0.148 nm;MnO也属于NaCl型结构,根据晶胞的结构,晶胞棱长是2r(O2-)+2r(Mn2+)=a′=0.448 nm,解得r(Mn2+)=0.076 nm。
24.(1)SiB6 SiP
(2)×1030
(3)×100%
解析:(1)由图可知,Ⅰ的一个晶胞中有6个B原子,Si原子个数为8×=1,则Ⅰ的化学式为SiB6,Ⅱ的一个晶胞中有4个P原子,Si原子个数为8×+6×=4,则Ⅱ的化学式为SiP。(2)Ⅰ的一个晶胞中有6个B原子,1个Si原子,则一个晶胞的质量为 g= g,则Ⅰ的密度为 g·cm-3=×1030 g·cm-3。(3)Ⅱ的一个晶胞中有4个P原子,4个Si原子,则Ⅱ的空间占有率为×100%=×100%。
08 常考题空8 溶度积( Ksp)的相关计算 (附答案解析)-备战高考化学大题逐空突破系列(全国通用): 这是一份08 常考题空8 溶度积( Ksp)的相关计算 (附答案解析)-备战高考化学大题逐空突破系列(全国通用),共9页。
07 常考题空7 电解质溶液中有关电离(水解)平衡常数的计算 (附答案解析)-备战高考化学大题逐空突破系列(全国通用): 这是一份07 常考题空7 电解质溶液中有关电离(水解)平衡常数的计算 (附答案解析)-备战高考化学大题逐空突破系列(全国通用),共9页。
03 常考题空3 分压平衡常数(Kp)计算 (附答案解析)-备战高考化学大题逐空突破系列(全国通用): 这是一份03 常考题空3 分压平衡常数(Kp)计算 (附答案解析)-备战高考化学大题逐空突破系列(全国通用),共19页。