江苏省盐城市2021届-2023届高考化学三年模拟(二模)按题型分类汇编-非选择题
展开江苏省盐城市2021届-2023届高考化学三年模拟(二模)按题型分类汇编-非选择题
一、工业流程题
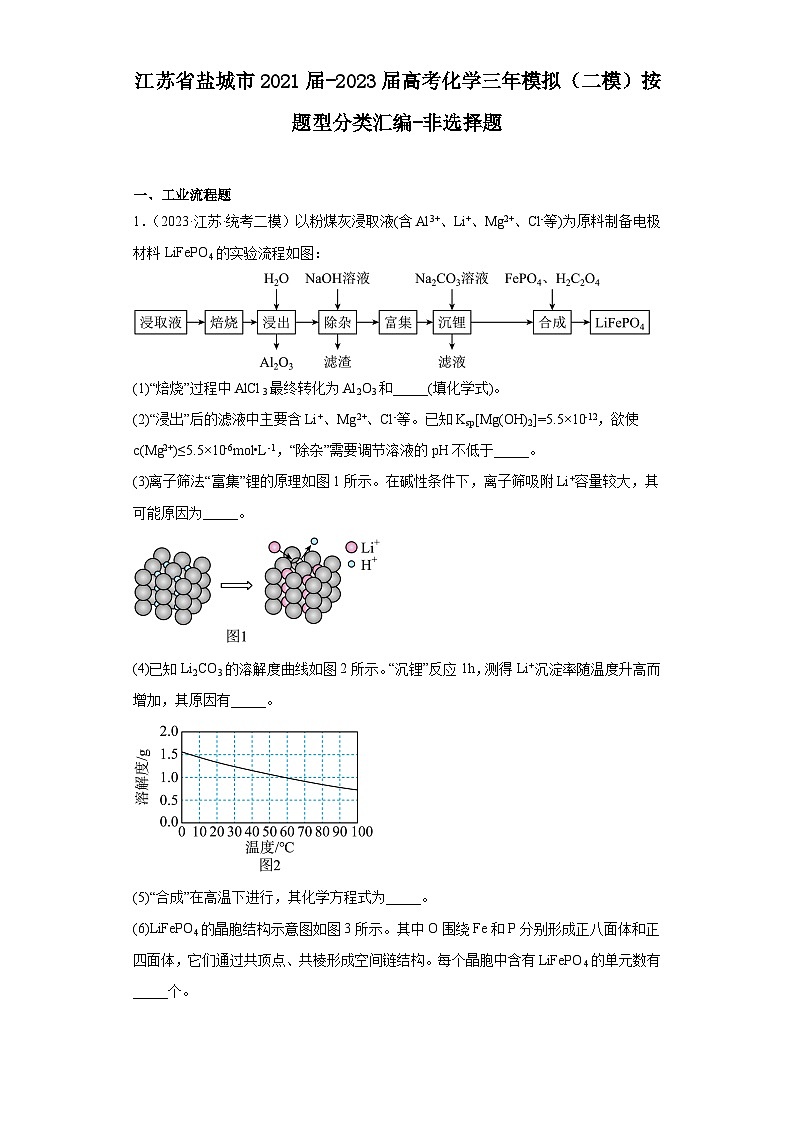
1.(2023·江苏·统考二模)以粉煤灰浸取液(含Al3+、Li+、Mg2+、Cl-等)为原料制备电极材料LiFePO4的实验流程如图:
(1)“焙烧”过程中AlCl3最终转化为Al2O3和_____(填化学式)。
(2)“浸出”后的滤液中主要含Li+、Mg2+、Cl-等。已知Ksp[Mg(OH)2]=5.5×10-12,欲使c(Mg2+)≤5.5×10-6mol•L-1,“除杂”需要调节溶液的pH不低于_____。
(3)离子筛法“富集”锂的原理如图1所示。在碱性条件下,离子筛吸附Li+容量较大,其可能原因为_____。
(4)已知Li2CO3的溶解度曲线如图2所示。“沉锂”反应1h,测得Li+沉淀率随温度升高而增加,其原因有_____。
(5)“合成”在高温下进行,其化学方程式为_____。
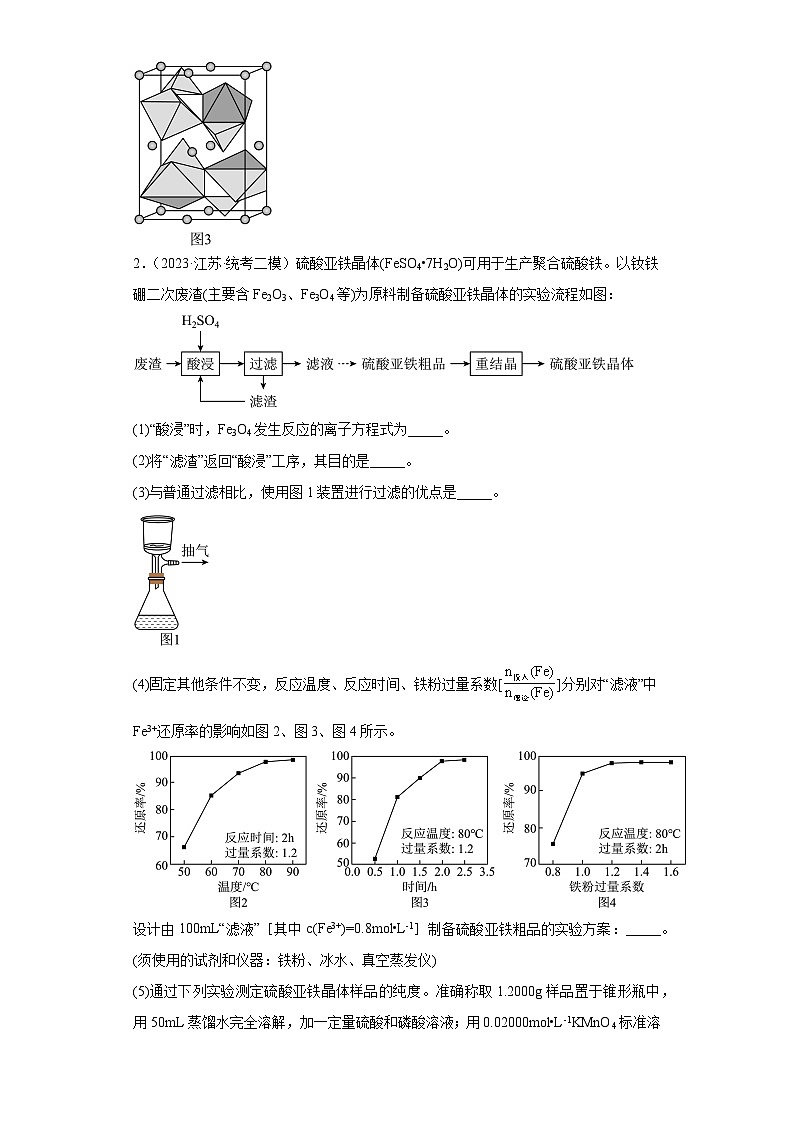
(6)LiFePO4的晶胞结构示意图如图3所示。其中O围绕Fe和P分别形成正八面体和正四面体,它们通过共顶点、共棱形成空间链结构。每个晶胞中含有LiFePO4的单元数有_____个。
2.(2023·江苏·统考二模)硫酸亚铁晶体(FeSO4•7H2O)可用于生产聚合硫酸铁。以钕铁硼二次废渣(主要含Fe2O3、Fe3O4等)为原料制备硫酸亚铁晶体的实验流程如图:
(1)“酸浸”时,Fe3O4发生反应的离子方程式为_____。
(2)将“滤渣”返回“酸浸”工序,其目的是_____。
(3)与普通过滤相比,使用图1装置进行过滤的优点是_____。
(4)固定其他条件不变,反应温度、反应时间、铁粉过量系数[]分别对“滤液”中Fe3+还原率的影响如图2、图3、图4所示。
设计由100mL“滤液”[其中c(Fe3+)=0.8mol•L-1]制备硫酸亚铁粗品的实验方案:_____。(须使用的试剂和仪器:铁粉、冰水、真空蒸发仪)
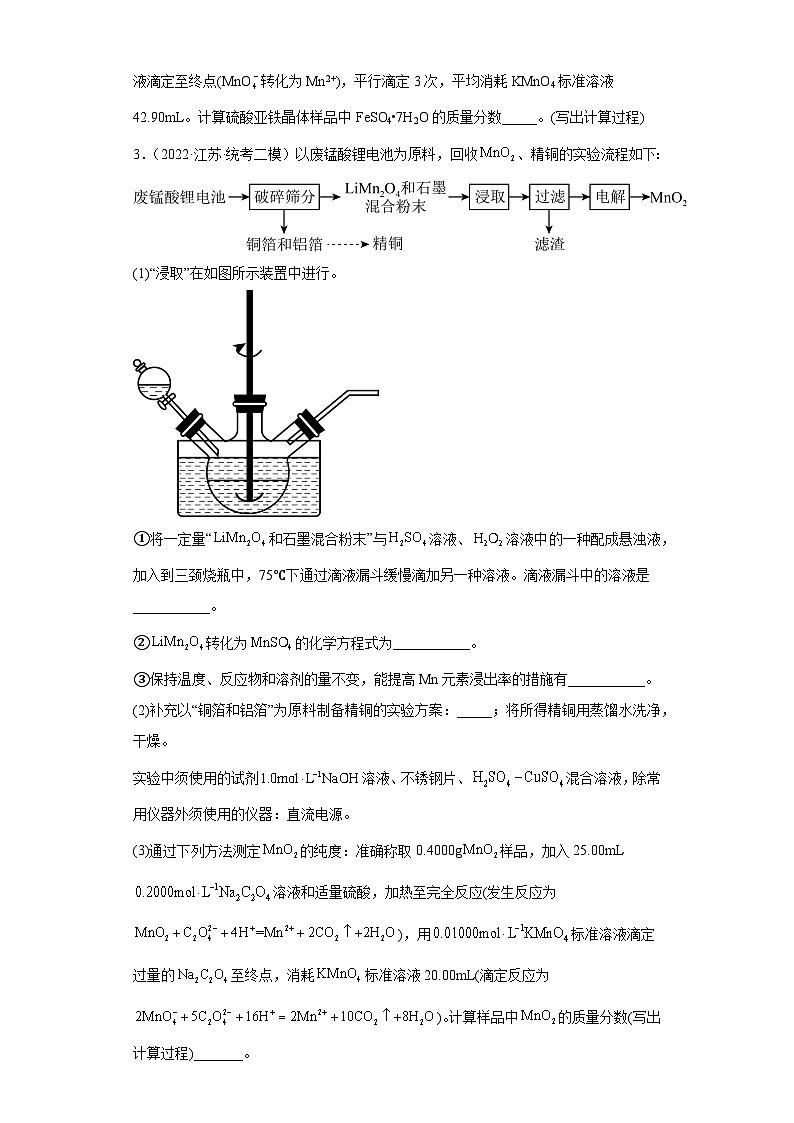
(5)通过下列实验测定硫酸亚铁晶体样品的纯度。准确称取1.2000g样品置于锥形瓶中,用50mL蒸馏水完全溶解,加一定量硫酸和磷酸溶液;用0.02000mol•L-1KMnO4标准溶液滴定至终点(MnO转化为Mn2+),平行滴定3次,平均消耗KMnO4标准溶液42.90mL。计算硫酸亚铁晶体样品中FeSO4•7H2O的质量分数_____。(写出计算过程)
3.(2022·江苏·统考二模)以废锰酸锂电池为原料,回收、精铜的实验流程如下:
(1)“浸取”在如图所示装置中进行。
①将一定量“和石墨混合粉末”与溶液、溶液中的一种配成悬浊液,加入到三颈烧瓶中,75℃下通过滴液漏斗缓慢滴加另一种溶液。滴液漏斗中的溶液是___________。
②转化为的化学方程式为___________。
③保持温度、反应物和溶剂的量不变,能提高Mn元素浸出率的措施有___________。
(2)补充以“铜箔和铝箔”为原料制备精铜的实验方案:_____;将所得精铜用蒸馏水洗净,干燥。
实验中须使用的试剂溶液、不锈钢片、混合溶液,除常用仪器外须使用的仪器:直流电源。
(3)通过下列方法测定的纯度:准确称取0.4000g样品,加入25.00mL溶液和适量硫酸,加热至完全反应(发生反应为),用标准溶液滴定过量的至终点,消耗标准溶液20.00mL(滴定反应为)。计算样品中的质量分数(写出计算过程)_______。
二、有机推断题
4.(2023·江苏·统考二模)化合物E是合成降糖药瑞格列净的重要中间体,其合成路线如图:
(1)A→B的反应类型为_____。
(2)相同条件下,B的沸点比A的高,其主要原因是_____。
(3)B→C的反应中有副产物X(C7H7OBr)生成,X的结构简式为_____。
(4)D的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式_____。
①分子中含有苯环,且只含有两种不同化学环境的氢原子;
②1mol该物质与NaOH溶液反应,最多消耗4molNaOH。
(5)已知:+CO2↑。写出以和为原料制备的合成路线流程图(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。_____
5.(2021·江苏·统考二模)化合物F是合成组蛋白甲基转移酶抑制剂Tazverik的中间体,其合成路线如图:
(1)A中碳原子的杂化轨道类型为_______。
(2)B→C的反应类型为_______。
(3)D的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式_______。
①分子中含有1个手性碳原子;
②在一定条件下完全水解,含苯环产物分子中不同化学环境的氢原子数目比为2:1。
(4)E→F的转化需要化合物X,化合物X的结构简式_______。
(5)已知(R表示烃基)。写出以和为原料制备的合成路线流程图________(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。
6.(2022·江苏·统考二模)F是一种治疗心脑血管疾病药物的中间体,其合成路线如下(表示苯基):
(1)C分子中采取杂化的碳原子数目是___________。
(2)D的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式:___________。
①能发生银镜反应和水解反应。
②分子中有5种不同化学环境的氢原子。
③每个苯环上只含1种官能团。
(3)的反应需经历的过程,中间体X的分子式为。X→F的反应类型为___________。
(4)E—F的反应中有一种分子式为的副产物生成,该副产物的结构简式为___________。
(5)已知:,写出以和为原料制备的合成路线________(无机溶剂和有机溶剂任用,合成路线流程图示例见本题题干)。
三、原理综合题
7.(2023·江苏·统考二模)苯乙烯是合成橡胶和塑料的重要原料,可由乙苯为原料制得。
(1)利用“乙苯脱氢反应”可制备苯乙烯。
C6H5C2H5(g)C6H5CH=CH2(g)+H2(g) ΔH=akJ•mol-1
保持气体总压不变,原料气按以下A、B、C三种投料方式进行:
A.乙苯
B.n(乙苯):n(N2)=1:10
C.n(乙苯):n(CO2)=1:10
三种投料分别达到平衡时,乙苯转化为苯乙烯的转化率[×100%]与温度的关系如图1所示。
①α_____0(填“>”、“<”或“不能确定”)。
②相同温度下,投料方式B乙苯的平衡转化率比投料方式A的高,其原因是_____。
③相同温度下,投料方式C乙苯的平衡转化率比投料方式B的高,其可能原因是_____。
④工业上利用“乙苯脱氢反应”生产苯乙烯时,会产生少量积碳。使用相同条件下的水蒸气代替N2,可较长时间内保持催化剂的催化活性,其原因是_____。
(2)CO2用于制备苯乙烯有助于实现“碳中和”。
①在催化剂X作用下,CO2参与反应的机理如图2所示(α、β表示乙苯分子中C或H原子的位置;A、B为催化剂的活性位点,其中A位点带部分正电荷,B1、B2位点带部分负电荷)。根据元素电负性的变化规律,图2所示的反应机理中步骤I和步骤II可描述为_____。
②保持混合气体总压(p)等其他条件不变,CO2的分压[p(CO2)=×p]与乙苯转化率的关系如图3所示。p(CO2)>14kPa时,乙苯转化率下降的原因是_____。
8.(2021·江苏·统考二模)酸性废水中的砷元素主要以亚砷酸(H3AsO3)形式存在。已知As2S3难溶于水,也不溶于稀硫酸、稀盐酸等无机酸。
(1)工业上采用硫化法(通常用Na2S)去除废水中的砷。
①向酸性废水中加入Na2S,产生的H2S与H3ASO3反应生成As2S3的化学方程式为_______。
②沉淀后,若废水中c(S2-)=1.0×10-4mol·L-1,则c(As3+)=_______。[Ksp(As2S3)=4.0×10-38]。
③为了防止As2S3与过量的S2-形成络合离子而溶解,通常需添加适量的FeSO4溶液,形成FeS,与As2S3共沉淀。验证沉淀中含有FeS的实验方法是_______。
(2)用硫代硫酸钠(Na2S2O3)替代Na2S处理含砷酸性废水可避免H2S污染。
①Na2S2O3去除酸性废水中H3AsO3的反应机理如图1所示,S2O经过“途径I”的除砷过程可描述为________(图中“HS·”为自由基,“·”表示孤单电子)。
②其他条件相同时,在紫外线照射下,将Na2S2O3分别加入到不含H3AsO3的酸性废水和含H3AsO3的酸性废水中,监测到反应过程中部分物质的浓度变化如图2所示,发现均不释放H2S,其原因是_______。
9.(2022·江苏·统考二模)我国学者分别使用Fe2O3和Fe3O4作催化剂对燃煤烟气脱硝脱硫进行了研究。
(1)催化剂制备。在60~100℃条件下,向足量NaOH溶液中通入N2一段时间,再加入适量新制FeSO4溶液,充分反应后得到混合物X;向混合物X中加入NaNO3溶液,充分反应后经磁铁吸附、洗涤、真空干燥,制得Fe3O4催化剂。
①通入N2的目的是___。
②混合物X与NaNO3反应生成Fe3O4和NH3,该反应的化学方程式为___。
(2)催化剂性能研究。如图1所示,当其他条件一定时,分别在无催化剂、Fe2O3作催化剂、Fe3O4作催化剂的条件下,测定H2O2浓度对模拟烟气(含一定比例的NO、SO2、O2、N2)中NO和SO2脱除率的影响,NO脱除率与H2O2浓度的关系如图2所示。
已知•OH能将NO、SO2氧化。•OH产生机理如下。
反应Ⅰ:Fe3++H2O2=Fe2++•OOH+H+(慢反应)
反应Ⅱ:Fe2++H2O2=Fe3++•OH+OH-(快反应)
①与Fe2O3作催化剂相比,相同条件下Fe3O4作催化剂时NO脱除率更高,其原因是___。
②NO部分被氧化成NO2。NO2被NaOH溶液吸收生成两种含氧酸钠盐,该反应的离子方程式为___。
③实验表明•OH氧化SO2的速率比氧化NO速率慢。但在无催化剂、Fe2O3作催化剂、Fe3O4作催化剂的条件下,测得SO2脱除率几乎均为100%的原因是___。
10.(2022·江苏·统考二模)乙醇用途广泛且需求量大,寻求制备乙醇的新方法是研究的热点。
(1)醋酸甲酯催化加氢制备乙醇涉及的主要反应如下:
I.
II.
III.
将的混合气体置于密闭容器中,在2.0MPa和不同温度下反应达到平衡时,的转化率和的选择性[]如图所示。
①若,则500K下反应达到平衡时生成的物质的量为___________mol。
②673〜723K平衡转化率几乎不变,其原因是___________。
(2)以KOH溶液为电解质溶液,在阴极(铜板)转化为的机理如图所示。(表示氢原子吸附在电极表面,也可用表示,其他物种以此类推;部分物种未画出)。
①在阴极上生成的电极反应式为___________。
②转化为的过程可描述为___________。
③与阴极使用铜板相比,阴极使用含的铜板可加快生成的速率,其原因可能是___________。
四、填空题
11.(2021·江苏·统考二模)氧化还原法、沉淀法等是常用于治理水体污染的重要化学方法。
(1)还原法处理含铬废水:铝粉可将废水中的Cr2O还原为Cr3+。如图所示,废水的不同初始pH对Cr2O去除效果有重要影响。
①酸性条件下,铝粉去除Cr2O反应的离子方程式为_______
②初始pH为3.0,反应180min后,废水中Cr2O浓度仍较高的原因是_______。
③实验证明,若初始pH过低,Cr2O的去除效果也不理想,其原因可能是_______。
(2)沉淀法处理含氯废水:向模拟废水(NaCl溶液)中加入Ca(OH)2和NaAlO2粉末,氯离子可转化为Ca4Al2(OH)12Cl2沉淀。
①该反应的化学方程式为_______。
②保持投料比[n(Ca):n(Al):n(Cl)]和其他反应条件不变,溶液中氯离子去除率随溶液初始氯离子浓度的变化如图所示,当初始氯离子浓度高于5g·L-1时,氯离子去除率下降的原因可能是_______。
五、实验题
12.(2021·江苏·统考二模)次硫酸氢钠甲醛(NaHSO2·HCHO·2H2O)在印染、医药以及原子能工业中应用广泛。以Na2SO3、SO2、HCHO和锌粉为原料制备次硫酸氢钠甲醛的实验步骤如下:
步骤1:如图1所示,在烧瓶中加入一定量Na2SO3和水,搅拌溶解,缓慢通入SO2,制得NaHSO3溶液。
步骤2:将装置A中导气管换成橡皮塞。向烧瓶中加入稍过量的锌粉和一定量甲醛溶液,在95~100℃下,反应约3h,冷却至室温,抽滤。
步骤3:将滤液经系列操作得到次硫酸氢钠甲醛晶体。
(1)A中多孔球泡的作用是_______。
(2)①步骤2中,反应生成的Zn(OH)2会覆盖在锌粉表面阻止反应进行,防止该现象发生的措施是_______。
②写出制备NaHSO2·HCHO·2H2O反应的化学方程式:_______。
(3)ZnSO4的溶解度随温度的变化如图2所示,请补充完整由副产品Zn(OH)2获得ZnSO4·7H2O的实验方案:将副产品Zn(OH)2置于烧杯中,_______(实验中可选用的试剂:稀硫酸、无水乙醇)。
(4)通过下列方法测定产品纯度:准确称取2.000 g NaHSO2·HCHO·2H2O样品,完全溶于水配成100.00mL溶液,取20.00mL于碘量瓶中,加入50.00 mL 0.09000 mol·L-1 I2标准溶液,振荡,于暗处充分反应。以淀粉溶液为指示剂,用0.1000 mol·L-1Na2S2O3标准溶液滴定至终点,消耗Na2S2O3溶液 10.00mL。测定过程中发生下列反应:NaHSO2·HCHO·2H2O+2I2=NaHSO4+4HI+HCHO,2S2O+I2=S4O+2I-
计算NaHSO2·HCHO·2H2O样品的纯度(写出计算过程)_______。
参考答案:
1.(1)HCl
(2)11
(3)在碱性条件下,OH-与离子筛中H+反应,使离子筛留出更多“空位”,能吸附更多Li+
(4)随温度升高,“沉锂”反应速率加快,相同时间内Li2CO3沉淀量增大;随温度升高,Li2CO3溶解度减小,Li2CO3沉淀量增大
(5)Li2CO3+H2C2O4+2FePO42LiFePO4+H2O+3CO2↑
(6)4
【分析】粉煤灰浸取液(含Al3+、Li+、Mg2+、Cl-等)为原料进行焙烧进行一定的转化,根据题设问可知,“焙烧”过程中AlCl3最终转化为Al2O3,根据元素守恒和元素价态不变,另一产物是HCl,加水溶解后“浸出”后的滤液中主要含Li+、Mg2+、Cl-等。继续加入NaOH溶液,使镁离子形成Mg(OH)2沉淀,可得到富集的Li+;加入碳酸钠溶液后,发生2Li++CO=Li2CO3↓,得到Li2CO3与H2C2O4和FePO4反应,反应方程式是Li2CO3+H2C2O4+2FePO42LiFePO4+H2O+3CO2↑;
【详解】(1)“焙烧”过程中AlCl3最终转化为Al2O3,根据元素守恒和元素价态不变,另一产物是HCl,故答案是HCl;
(2)“浸出”后的滤液中主要含Li+、Mg2+、Cl-等,加入NaOH溶液,使镁离子形成Mg(OH)2沉淀,根据Ksp[Mg(OH)2]=c(Mg2+)×c2(OH-)=5.5×10-12,欲使c(Mg2+)≤5.5×10-6mol•L-1,则此时溶液中c(OH-)==,故c(H+)===10-11,故“除杂”需要调节溶液的pH不低于11;
(3)离子筛法“富集”锂的原理如图分析,离子筛中含H+和Li+,若在碱性条件下,OH-与离子筛中H+反应,使离子筛留出更多“空位”,能吸附更多Li+,故答案是在碱性条件下,OH-与离子筛中H+反应,使离子筛留出更多“空位”,能吸附更多Li+;
(4)由图像可知,温度越高,Li2CO3溶解度减小,越易产生沉淀;“沉锂”发生2Li++CO=Li2CO3↓,温度越高,反应速率越大,相同时间内产生Li2CO3含量越大,故“沉锂”反应1h,测得Li+沉淀率随温度升高而增加,其原因有随温度升高,“沉锂”反应速率加快,相同时间内Li2CO3沉淀量增大;随温度升高,Li2CO3溶解度减小,Li2CO3沉淀量增大;
(5)“合成”在高温下进行,其化学方程式为Li2CO3与H2C2O4和FePO4反应生成产物LiFePO4,分析元素化合价变化,可知FePO4中铁元素化合价由+3降到+2,做氧化剂,H2C2O4中碳元素化合价由+3价,升高到+4价,其产物是CO2,根据氧化还原反应,故反应方程式是Li2CO3+H2C2O4+2FePO42LiFePO4+H2O+3CO2↑;
(6)由题图可知,小白球表示锂离子,每个晶胞中的锂离子数为8×+4×+4×=4,故一个晶胞中含有LiFePO4的单元数有4个。
2.(1)Fe3O4+8H+=2Fe3++Fe2++4H2O
(2)提高铁元素的浸出率
(3)过滤速度更快
(4)在80℃水浴加热条件下,向“滤液”中加入2.688g铁粉,搅拌下反应2h后,过滤;滤液在真空蒸发仪中蒸发、在冰水浴中冷却结晶、过滤
(5)99.39%
【分析】废渣溶于硫酸生成硫酸亚铁和硫酸铁,过滤后滤液中加足量铁粉将硫酸铁还原为硫酸亚铁,再过滤,通过蒸发浓缩冷却结晶得到粗品,再重结晶得到硫酸亚铁晶体,据此解答。
【详解】(1)Fe3O4与硫酸反应生成硫酸铁和硫酸亚铁,反应离子方程式为:Fe3O4+8H+=2Fe3++Fe2++4H2O,故答案为:Fe3O4+8H+=2Fe3++Fe2++4H2O;
(2)将“滤渣”返回“酸浸”工序,可使Fe3O4和氧化铁更充分与硫酸发生反应,提高铁的浸取率,故答案为:提高铁元素的浸出率;
(3)抽滤装置通过减小锥形瓶内的压强,可以加快过滤速率,故答案为:过滤速度更快;
(4)由图可知温度再80℃时还原率最高,因此温度选80℃;在稳定一定是过量系数为1.2时还原率最高,因此过量系数为1.2,而在前两者相同时反应时间2h时还原率高,因为搅拌时间控制在2h,结合过量系数可得:应加入铁粉的量为氯化铁消耗铁粉量的1.2倍,则100mL“滤液”[其中c(Fe3+)=0.8mol•L-1],结合反应可知消耗铁粉0.04mol,则需加0.04×1.2mol=0.048mol,铁粉质量为0.048×56=2.688g,同时为防止硫酸亚铁被氧化,应在真空蒸发仪中蒸发,然后冷却结晶后过滤,具体步骤为:在80℃水浴加热条件下,向“滤液”中加入2.688g铁粉,搅拌下反应2h后,过滤;滤液在真空蒸发仪中蒸发、在冰水浴中冷却结晶、过滤,故答案为:在80℃水浴加热条件下,向“滤液”中加入2.688g铁粉,搅拌下反应2h后,过滤;滤液在真空蒸发仪中蒸发、在冰水浴中冷却结晶、过滤;
(5)根据电子得失守恒可得关系式:,n()==0.02000mol•L-1×0.0429L×5=0.00429 mol,硫酸亚铁晶体样品中FeSO4•7H2O的质量分数=,故答案为:99.39%。
3.(1) ↑+8H2O 从反应速率和反应物反应的充分程度角度分析,能提高Mn元素浸出率的措施有:适当加快搅拌速率;延长反应时间
(2)边搅拌边向“铜箔和铝箔”中加入溶液,当溶液中不再产生气泡时,过滤;将铜箔压制成片并与直流电源正极相连,不锈钢片与直流电源负极相连,在混合溶液中电解,当铜箔完全溶解时取出不锈钢片,刮出精铜
(3)97.88%
【分析】首先将废锰酸锂电池为原料进行破碎筛分,分离出铜箔和铝箔,以及锰酸锂和石墨混合粉末,之后浸取在酸性条件下用过氧化氢将锰酸锂中的锰还原为+2价,过滤,滤液通过电解得到二氧化锰,铜箔和铝箔通过精制得到精铜,以此解题。
(1)
①反应在75℃下进行,若三颈烧瓶中先加入溶液,向其中滴加硫酸溶液,则容易导致分解,故滴液漏斗中的溶液是溶液;
②过氧化氢作还原剂将中锰元素还原为+2价,方程式为:↑+8H2O;
③从反应速率和反应物反应的充分程度角度分析,能提高Mn元素浸出率的措施有:适当加快搅拌速率;延长反应时间;
(2)
利用铝可以和氢氧化钠反应,铜不能反应,故可以先用氢氧化钠溶液除去铝,之后再用电解精炼的方法得到精铜,故答案为:边搅拌边向“铜箔和铝箔”中加入溶液,当溶液中不再产生气泡时,过滤;将铜箔压制成片并与直流电源正极相连,不锈钢片与直流电源负极相连,在混合溶液中电解,当铜箔完全溶解时取出不锈钢片,刮出精铜;
(3)
根据可知,与MnO反应的C2O的物质的量:,0.4000 g样品中MnO2的物质的量:;;则样品中的质量分数。
4.(1)还原反应
(2)B分子间存在氢键
(3)
(4)
(5)
【分析】分析流程如下:A→B中醛基变为醇羟基,发生还原反应;B→C中醇羟基转化为溴原子,发生取代反应,C→D由-Br引入其他基团,发生取代反应;D→E中在酯基和羰基处发生反应,转化为E。
【详解】(1)A→B中醛基变为醇羟基,发生还原反应;
(2)A中含有醇羟基,分子间存在氢键,故相同条件下,B的沸点比A的高;
(3)根据B的结构,B与HBr反应有副产物C7H7OBr产生,可推知X的结构是;
(4)D()的同分异构体中,分子中含有苯环,且只含有两种不同化学环境的氢原子,说明结构比较对称;1mol该物质与NaOH溶液反应,最多消耗4molNaOH,说明结构中含有酚酯基,故对应结构如下:
(5)参照题目C→D流程和题目信息设计如下,
5. sp2和sp3 取代反应 CH3CHO
【分析】A与DBDMH在浓硫酸作用下发生取代反应生成B,B与CH3I发生取代反应生成C,C中硝基被还原得到D,D与经系列反应得到E,E与化合物X发生类似D生成E的反应得到F,对比E和F的结构简式可知化合物X为CH3CHO。
【详解】(1)A中苯环上以及碳氧双键的碳原子为sp2杂化,甲基中的碳原子为sp3杂化;
(2)B中羧基中的氢原子被甲基代替生成C,所以B生成C的反应属于取代反应;
(3)D的同分异构体满足:
①分子中含有1个手性碳原子,即有一个碳原子上连接了四个不同的原子或原子团;
②在一定条件下完全水解,含苯环产物分子中不同化学环境的氢原子数目比为2:1,则水解生成的含苯环产物应有两个对位的取代基,且两个对位上的取代基相同,则满足条件的同分异构体为;
(4)E与化合物X发生类似D生成E的反应得到F,对比E和F的结构简式可知化合物X为CH3CHO;
(5)根据D生成E的反应可知可以由和发生类似的反应生成,苯环先硝化再被还原可以得到,而苯环与发生题干所给反应生成,所以合成路线为:。
6.(1)13
(2)或
(3)消去反应
(4)
(5)
【分析】有机合成题中常采用对比的方法,找出断键和形成化学键的部位,从而判断出反应类型,据此分析;
【详解】(1)sp2杂化碳原子应是苯环和双键上的碳原子,因此根据C的结构简式,sp2杂化碳原子的数目有13;故答案为13;
(2)根据D的结构简式,能发生银镜反应,说明含有醛基,有两个苯环,无其他环,能发生水解反应,只能是“C-Cl”,有5种不同环境的氢原子,说明是对称结构,每个苯环上只有1中官能团,因此符合条件的是或;故答案为或;
(3)根据F的结构简式,推出F的分子式为C24H21NOCl2,对比X的分子式,X→F少了一个H2O,因此该反应类型为消去反应;故答案为消去反应;
(4)副反应产物的分子式为C24H21NOCl2,该副产物与F互为同分异构体,碳碳双键存在顺反异构,因此推出副产物为;故答案为;
(5)根据路线中B→C,生成,可以有与苯环反应得到,根据CH3COOH在SOCl2作用下生成CH3COCl,可以由反应得到,因此先水解,然后再氧化得到;故答案为。
7.(1) > 加入一定量N2使“乙苯脱氢反应”的Qc<Kc(或Qp<Kp),反应平衡时正向进行程度更大 CO2与C6H5C2H5反应生成C6H5CH=CH2;CO2与H2反应[H2(g)+CO2(g)=CO(g)+H2O(g)]使H2浓度减小,“乙苯脱氢反应”平衡时正向进行程度更大 水蒸气与积碳发生反应H2O(g)+C(s)=CO(g)+H2(g),可消除催化剂表面的积碳
(2) 乙苯α-H带部分正电荷,被带部分负电荷的B1位点吸引,随后解离出H+并吸附在B1位点上;(B1位点上的)H+与B2位点上CO2中带部分负电荷的O作用生成,带部分正电荷的C吸附在带部分负电荷的B2位点上 过多的CO2占据了带部分负电荷的B1位点,使得乙苯α-H的脱除速率降低,乙苯转化率下降
【详解】(1)①根据图像可知转化率是大于0的,故α>0。
②相同温度下,投料方式B乙苯的平衡转化率比投料方式A的高,其原因是加入一定量N2使“乙苯脱氢反应”的Qc<Kc(或Qp<Kp),反应平衡时正向进行程度更大。
③相同温度下,投料方式C乙苯的平衡转化率比投料方式B的高,其可能原因是CO2与C6H5C2H5反应生成C6H5CH=CH2;CO2与H2反应[H2(g)+CO2(g)=CO(g)+H2O(g)]使H2浓度减小,“乙苯脱氢反应”平衡时正向进行程度更大。
④工业上利用“乙苯脱氢反应”生产苯乙烯时,会产生少量积碳。使用相同条件下的水蒸气代替N2,可较长时间内保持催化剂的催化活性,其原因是水蒸气与积碳发生反应H2O(g)+C(s)=CO(g)+H2(g),可消除催化剂表面的积碳。
(2)①图2所示的反应机理中步骤I和步骤II可描述为乙苯α-H带部分正电荷,被带部分负电荷的B1位点吸引,随后解离出H+并吸附在B1位点上;(B1位点上的)H+与B2位点上CO2中带部分负电荷的O作用生成,带部分正电荷的C吸附在带部分负电荷的B2位点上。
②CO2的分压[p(CO2)=×p]与乙苯转化率的关系如图3所示,p(CO2)>14kPa时,乙苯转化率下降的原因是过多的CO2占据了带部分负电荷的B1位点,使得乙苯α-H的脱除速率降低,乙苯转化率下降。
8. 2.0×10-13mol/L 取少量反应后沉淀于过滤器中,用蒸馏水洗涤,向滤液中滴加几滴KSCN溶液和少量氯水,不变红,取少量洗涤干净的沉淀于试管中,加入足量稀盐酸,过滤,向滤液中加入几滴KSCN溶液,若出现红色,则说明原沉淀中含有FeS S2O与氢离子在紫外线照射条件下可以生成HS·,两个HS·可以结合生成H2S2,H2S2分解得到S8和H2S,H2S与H3AsO3发生反应生成AsS3 向不含H3AsO3的酸性废水中加入Na2S2O3时,S2O与H+在紫外线照射条件下生成的H2S可与S2O在紫外线照射条件下生成的亚硫酸根发生反应,转化为S8;向含H3AsO3的酸性废水中加入Na2S2O3,S2O与H+在紫外线照射条件下生成的H2S和H3AsO3反应生成硫化砷沉淀的速率大于H2S与亚硫酸根反应转化为S8的速率
【详解】(1)①H2S与H3ASO3反应生成As2S3的化学方程式为;
②根据沉淀溶解平衡,,即,解得c(As3+)=2.0×10-13mol/L;
③取少量反应后沉淀于过滤器中,用蒸馏水洗涤,向滤液中滴加几滴KSCN溶液和少量氯水,不变红,取少量洗涤干净的沉淀于试管中,加入足量稀盐酸,过滤,向滤液中加入几滴KSCN溶液,若出现红色,则说明原沉淀中含有FeS;
(2) ①S2O经过“途径I”的除砷过程可描述为,S2O与氢离子在紫外线照射条件下可以生成HS·,两个HS·可以结合生成H2S2,H2S2分解得到S8和H2S,H2S与H3AsO3发生反应生成AsS3;
②向不含H3AsO3的酸性废水中加入Na2S2O3时,S2O与H+在紫外线照射条件下生成的H2S可与S2O在紫外线照射条件下生成的亚硫酸根发生反应,转化为S8;向含H3AsO3的酸性废水中加入Na2S2O3,S2O与H+在紫外线照射条件下生成的H2S和H3AsO3反应生成硫化砷沉淀的速率大于H2S与亚硫酸根反应转化为S8的速率;
9.(1) 排除NaOH溶液中的O2,防止Fe2+被氧化为Fe3+ 12Fe(OH)2+NaNO34Fe3O4+NH3↑+NaOH+10H2O
(2) Fe3O4催化剂表面同时存在Fe2+和Fe3+,Fe2+直接通过反应Ⅱ快速产生•OH,c(•OH)更大:Fe2O3催化剂表面仅存在Fe3+,Fe3+需先通过慢反应Ⅰ产生Fe2+再通过快反应Ⅱ产生•OH,总反应速率由慢反应Ⅰ决定,c(•OH)小于前者;故Fe3O4作催化剂比Fe2O3作催化剂时NO脱除率更大 2NO2+2OH-=NO+NO+H2O SO2几乎完全被NaOH溶液吸收
【详解】(1)①氢氧化钠溶液中会溶解有少量空气中的氧气,氧气能氧化亚铁离子生成铁离子,通入N2的目的是排除NaOH溶液中的O2,防止Fe2+被氧化为Fe3+;
②氢氧化钠和硫酸亚铁生成氢氧化亚铁沉淀,混合物X中含有氢氧化亚铁,根据质量守恒可知,氢氧化亚铁会与NaNO3反应生成Fe3O4和NH3、氢氧化钠、水,该反应的化学方程式为12Fe(OH)2+NaNO34Fe3O4+NH3↑+NaOH+10H2O;
(2)①由已知反应机理反应Ⅰ、反应Ⅱ可知:Fe3O4催化剂表面同时存在Fe2+和Fe3+,Fe2+直接通过反应Ⅱ快速产生•OH,c(•OH)更大:Fe2O3催化剂表面仅存在Fe3+,Fe3+需先通过慢反应Ⅰ产生Fe2+再通过快反应Ⅱ产生•OH,总反应速率由慢反应Ⅰ决定,c(•OH)小于前者;故Fe3O4作催化剂比Fe2O3作催化剂时NO脱除率更大
②NO2被NaOH溶液吸收生成两种含氧酸钠盐,根据质量守恒可知为含氮元素的盐,二氧化氮中部分氮元素化合价升高、部分氮元素化合价降低,反应得到亚硝酸盐和硝酸盐,该反应的离子方程式为2NO2+2OH-=NO+NO+H2O
③二氧化硫能溶于水会和氢氧化钠反应被吸收,测得SO2脱除率几乎均为100%的原因是SO2几乎完全被NaOH溶液吸收。
10.(1) 0.81 温度的升高使反应I、反应Ⅱ中CH3COOCH3的平衡转化率下降,使反应Ⅲ中CH3COOCH3的平衡转化率上升,且上升幅度与下降幅度相当
(2) 2CO2+12e-+9H2O=C2H5OH+12OH- 溶液中的H2O在阴极表面得到电子生成,与CO2反应生成,与反应生成和H2O 含F-的铜板中F-与水合钾离子通过库伦作用或氢键促进H2O在阴极表面得到电子生成
【解析】(1)
①令反应I消耗CH3COOCH3的物质的量为amol,反应ⅡCH3COOCH3消耗的物质的量为bmol,反应Ⅲ消耗的物质的量为cmol,根据反应I,推出生成C2H5OH的物质的量为amol,根据题意有:×100%=90%,×100%=90%,解得a=0.81;故答案为0.81;
②反应I、反应Ⅱ为放热反应,根据勒夏特列原理,升高温度,反应I、反应Ⅱ向逆反应方向进行,CH3COOCH3的转化率降低,反应Ⅲ为吸热反应,升高温度,反应Ⅲ向正反应方向进行,当上升幅度与下降幅度相当时,CH3COOCH3的平衡转化率几乎不变,故答案为温度的升高使反应I、反应Ⅱ中CH3COOCH3的平衡转化率下降,使反应Ⅲ中CH3COOCH3的平衡转化率上升,且上升幅度与下降幅度相当;
(2)
①CO2在阴极上得电子,转化成C2H5OH,电极反应式为2CO2+12e-+9H2O=C2H5OH+12OH-;故答案为2CO2+12e-+9H2O=C2H5OH+12OH-;
②根据机理可知,溶液中的H2O在阴极表面得到电子生成,与CO2反应生成,与反应生成和H2O;故答案为溶液中的H2O在阴极表面得到电子生成,与CO2反应生成,与反应生成和H2O;
③根据机理图可知,与反应,F-与水合钾离子形成氢键,使促进水在阴极表面得到电子生成,故答案为含F-的铜板中F-与水合钾离子通过库伦作用或氢键促进H2O在阴极表面得到电子生成。
11. Al的还原性较弱 pH过低,Al和H+反应生成Al3+ Cl-浓度较高时,使得OH-浓度较高,Ca2+、在溶液中浓度降低,导致氯离子去除率下降
【详解】(1)①酸性条件下,铝粉可将废水中的Cr2O还原为Cr3+,化学方程式为:;
②pH为3.0,Al的还原性较弱;
③pH过低,溶液中H+含量较高,Al和H+反应生成Al3+,导致Cr2O的去除效果不理想;
(2)①NaCl溶液、Ca(OH)2和NaAlO2反应生成Ca4Al2(OH)12Cl2沉淀,化学方程式为:;
②保持投料比[n(Ca):n(Al):n(Cl)] 和其他反应条件不变,当初始氯离子浓度高于5g·L-1时,,Cl-浓度较高时,使得OH-浓度较高,Ca2+、在溶液中浓度降低,导致氯离子去除率下降。
12. 增大接触面积,使SO2充分反应 快速搅拌 加入适量稀硫酸使沉淀溶解,通过蒸发浓缩,冷却结晶,控制温度在20℃-39℃之间,使ZnSO4·7H2O析出,用乙醇进行洗涤,干燥后得到ZnSO4·7H2O晶体 77.00%
【分析】步骤1:在烧瓶中加入一定量Na2SO3和水,搅拌溶解,缓慢通入SO2,Na2SO3、H2O、SO2反应生成NaHSO3,A中多孔球泡的是为了增大接触面积,使SO2充分反应;步骤2:将装置A中导气管换成橡皮塞。向烧瓶中加入稍过量的锌粉和一定量甲醛溶液,在95~100℃下,反应约3h ,NaHSO3溶液、锌粉和甲醛反应生成NaHSO2·HCHO·2H2O和,化学方程式为:。
【详解】(1)A中多孔球泡的作用是可以增大接触面积,使SO2充分反应;
(2)①通过快速搅拌可防止Zn(OH)2会覆盖在锌粉的表面;
②NaHSO3溶液、锌粉和甲醛反应生成NaHSO2·HCHO·2H2O和,化学方程式为:;
(3)由副产品Zn(OH)2获得ZnSO4·7H2O的实验方案:将副产品Zn(OH)2置于烧杯中,加入适量稀硫酸使沉淀溶解,通过蒸发浓缩,冷却结晶,控制温度在20℃-39℃之间,使ZnSO4·7H2O析出,用乙醇进行洗涤,干燥后得到ZnSO4·7H2O晶体。
(4)用0.1000 mol·L-1Na2S2O3标准溶液滴定至终点,消耗Na2S2O3溶液 10.00mL,根据离子方程式2S2O+I2=S4O+2I-可知,与NaHSO2·HCHO·2H2O反应后剩余的I2的物质的量为,反应前加入50.00 mL 0.09000 mol·L-1 I2标准溶液,由此可计算出与NaHSO2·HCHO·2H2O反应消耗I2的物质的量为,根据化学方程式NaHSO2·HCHO·2H2O+2I2=NaHSO4+4HI+HCHO,算出NaHSO2·HCHO·2H2O的物质的量为,其纯度为,总计算过程为。
江苏省盐城市2021届-2023届高考化学三年模拟(二模)按题型分类汇编-选择题: 这是一份江苏省盐城市2021届-2023届高考化学三年模拟(二模)按题型分类汇编-选择题,共27页。试卷主要包含了单选题等内容,欢迎下载使用。
江苏省南通市2021届-2023届高考化学三年模拟(二模)按题型分类汇编-非选择题: 这是一份江苏省南通市2021届-2023届高考化学三年模拟(二模)按题型分类汇编-非选择题,共30页。试卷主要包含了原理综合题,有机推断题,工业流程题,实验题,结构与性质,填空题等内容,欢迎下载使用。
江苏省南京市2021届-2023届高考化学三年模拟(二模)按题型分类汇编-非选择题: 这是一份江苏省南京市2021届-2023届高考化学三年模拟(二模)按题型分类汇编-非选择题,共28页。试卷主要包含了工业流程题,有机推断题,原理综合题,填空题,实验题等内容,欢迎下载使用。












