
2023年中考化学冲刺复习推断题模拟新题专练-01推断题突破口之颜色特征
展开这是一份2023年中考化学冲刺复习推断题模拟新题专练-01推断题突破口之颜色特征,共18页。试卷主要包含了推断题等内容,欢迎下载使用。
2023年中考化学冲刺复习推断题模拟新题专练-01推断题突破口之颜色特征
一、推断题
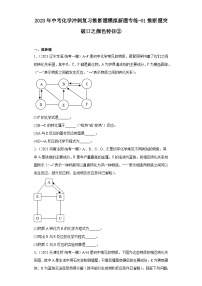
1.(2023·山东滨州·统考二模)图中的 A—F 是初中化学常见物质:A 的浓溶液有吸水性,B 的溶液为蓝色,C 是地壳中含量最高的金属,D 与 A 在物质分类上属于同一类别,E 固体的溶解度随温度升高而减小,F 是一种气体。(注:“一”或“”表示两种物质间能发生反应,“→”表示一种物质能转化为另一种物质,部分反应物、生成物、转化及反应关系已略去,物质间的反应及转化均在溶液中进行,物质是溶液的只考虑溶质)
请回答下列问题:
(1)B 物质的名称 _______。
(2)将 F 通入 E 的溶液中,现象是_______。
(3)A 转化为 D 的化学方程式_______。
(4)C 与 B 的溶液发生反应的基本反应类型为_______反应。
(5)A 和 E 反应的实质是_______。
2.(2023·湖南岳阳·统考二模)A为含三种元素的钠盐,C为相对分子质量为100的白色不溶物,请填空:
(1)A______、B______、C______(填写化学式)。
(2)D中一定含有的溶质是______,理由是(用化学方程式表示)______。
(3)D还可能含有溶质是______。
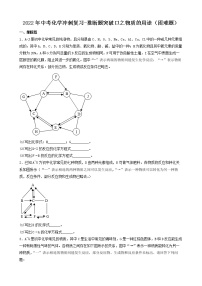
3.(2023·陕西宝鸡·统考二模)如图所示,A一E代表初中常见的不同类别的物质,它们分别由C、Na、Ca、O、H、Cu、Cl中的一种或几种元素组成,其中B为黑色的氧化物,D、E溶液呈碱性,相邻的物质间能反应。请回答下列问题:
(1)A所属的物质类别是______。
(2)B与C反应的化学方程式为______。
(3)将D、E溶液混合反应,可观察到的现象是______。
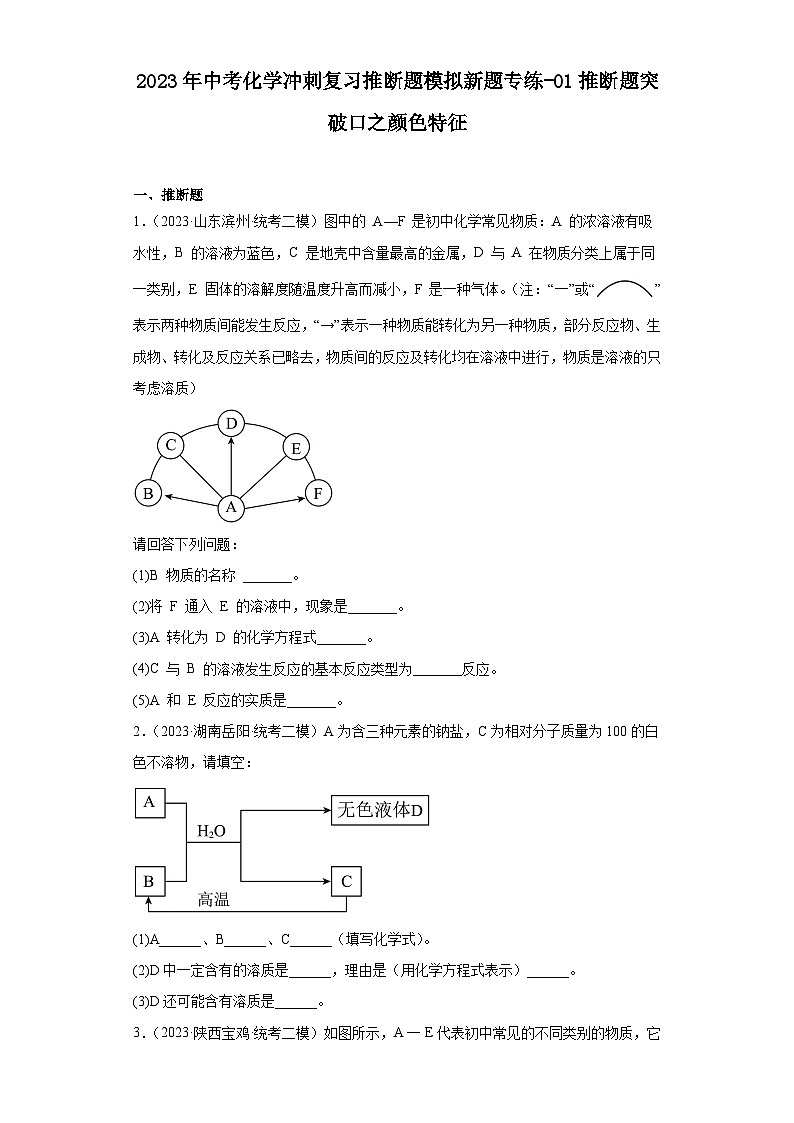
4.(2023·四川成都·统考二模)如图是初中化学常见物质的相互转化关系示意图。A是一种金属氧化物。
回答下列问题:
(1)若甲是稀硫酸,D为蓝色沉淀,则D为______,A跟甲反应的化学反应方程式是______。
(2)若乙是稀硫酸,A为红色固体,则C跟乙反应的化学反应方程式______。
(3)若A和D均为红色固体,则反应①中物质甲所表现出的化学性质是______,甲______(填“一定”或“不一定”)属于单质。
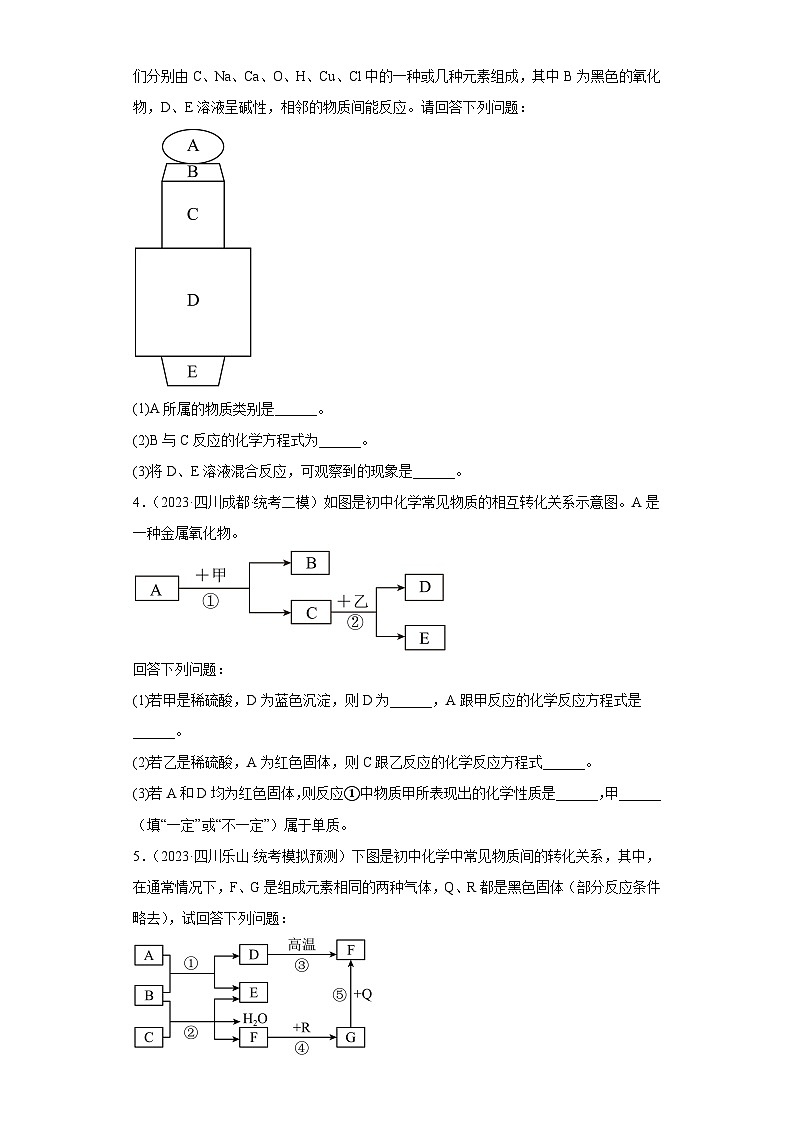
5.(2023·四川乐山·统考模拟预测)下图是初中化学中常见物质间的转化关系,其中,在通常情况下,F、G是组成元素相同的两种气体,Q、R都是黑色固体(部分反应条件略去),试回答下列问题:
(1)G的化学式为:______。
(2)若E是生活中常用的调味剂、防腐剂,则反应①的化学方程式为:______。
(3)图中标出的九种物质按单质、氧化物、酸、碱、盐进行分类,一定没有的物质类别是_________。
(4)反应①—⑤中没有涉及的基本反应类型是______。
6.(2023·山东聊城·统考二模)图中A⁓E为五种不同类别的物质。其中A具有挥发性,B是目前世界年产量最高的金属,C的溶液为蓝色,D的溶液俗称石灰水(图中“”或“一”表示两种物质间能发生反应,“→”表示一种物质能转化为另一种物质,部分反应物、生成物、转化及反应关系已略去,物质间的反应及转化均在溶液中进行,物质是溶液的只考虑溶质)。请回答下列问题:
(1)写出物质C的化学式:______。
(2)B与C的溶液发生反应的基本类型为______。
(3)写出A与D反应的化学方程式:______。
7.(2023·山西晋中·统考二模)某同学将A一E五种物质构建了如下关系图。已知A、C、D、E是四种不同类别的物质,B是铁锈的主要成分,C的水溶液呈蓝色。图中“→”指一种物质可反应生成另一种物质,“一”指两种物质可直接发生反应。
(1)B的化学式是_______。
(2)A→C的化学方程式为_______。
(3)D与E反应的化学方程式为_______。
8.(2023·湖北省直辖县级单位·统考三模)如图是初中化学中常见物质间的相互转化关系图,A与C都是由相同两种元素组成的液体,A、C、E、G也为化合物,G为红棕色粉末,F为金属单质,其余反应条件、反应物和生成物均已省略。请根据如图推断:
(1)A的化学式_______。
(2)反应④的基本反应类型是_______。
(3)写出反应②的化学方程式:_______。
(4)写出反应⑤的化学方程式:_______。
9.(2023·陕西渭南·统考二模)某固体混合物由A、B两种物质组成。其中A由两种元素组成,B属于盐。为了确定它们的成分,取混合物粉末,按以下步骤进行实验:
请回答下列问题:
(1)该实验过程共涉及________种基本反应类型。
(2)B物质的化学式为__________。
(3)写出步骤②中生成白色沉淀D的化学反应方程式__________。
10.(2023·内蒙古包头·模拟预测)下图中A~G是初中化学常见的物质,其中A为黑色固体,E为红色单质,B、C、D均为无色气体,G为蓝色溶液,F为石灰石的主要成分。据图回答下列问题。
(1)在反应①中体现出B的化学性质是______。若将B换成某种固体单质,也可使图中各步反应顺利进行,则这种单质的化学式为______。
(2)写出反应⑤的化学方程式______(写一个即可)。
(3)写出图中属于化合反应的化学方程式______。
11.(2023·江苏宿迁·统考一模)如图表示某些物质间转化关系(反应条件和部分产物已省略)。其中A、E为固体氧化物,且A为黑色粉末;B、D是由相同元素组成的无色液体:C、Y、Z为无色气体,其中Y有毒;X是最常见的金属。请回答下列问题:
(1)写出反应①的化学方程式___________。
(2)写出反应③的化学方程式___________;此反应属于基本反应类型中___________反应。
(3)在日常生活中为防止反应②的发生,可采取的措施是___________(写一点即可)。
(4)在自然界中普遍存在反应⑤,其名称为___________。
12.(2023·陕西延安·模拟预测)实验室有A、B、C、D、E五瓶失去标签的溶液,所含溶质分别是HCl、H2SO4、NaOH、BaCl2、CuSO4中的一种。
(1)同学们发现不需要实验就可以确定A是CuSO4溶液,原因是____________。
(2)实验小组同学又设计了如下实验进行鉴别,实验后观察到A、B混合产生蓝色沉淀,A、C混合产生白色沉淀,C、D混合产生白色沉淀,其余均无明显现象。
①D的溶质是__________(填化学式)。
②A与B反应的化学方程式为___________。
③A与E__________(填“能”或“不能”)发生化学反应。
13.(2023·湖南邵阳·模拟预测)某固体混合物可能含有CuSO4、CaCO3、Na2CO3、KOH一种或两种,为了确定该混合物的成分,进行如下实验:
步骤Ⅰ:取少量固体于烧杯中,加水,搅拌,固体全部溶解,得到无色溶液A。
步骤Ⅱ:取少量溶液A于试管中,滴加过量MgCl2溶液,有白色沉淀产生;再加入过量稀盐酸,沉淀消失,有气泡产生。
(1)步骤Ⅱ中产生的气泡是___________。(填化学式)
(2)根据上述实验推断该混合物的成分,肯定含有的是___________,可能含有的是___________。
14.(2023·湖南湘西·统考模拟预测)有一包白色固体样品,可能含有NaOH、Na2CO3、K2SO4、BaCl2、CuSO4中的一种或几种,为确定其组成,进行如下实验:
(1)步骤Ⅰ:取少量样品于烧杯中,加足量水,充分搅拌,静置,有白色固体产生,上层清液呈无色。则该样品中一定不含_______。
(2)步骤Ⅱ:取步骤Ⅰ所得上层清液于试管中,滴入几滴酚酞溶液,溶液变红色;再滴入过量稀盐酸,无气泡产生,红色逐渐褪去,得到无色溶液。则溶液的红色褪去,发生反应的化学方程式是_____。
(3)步骤Ⅲ:取步骤Ⅰ所得白色固体于试管中,滴入过量稀盐酸,有大量气泡产生,白色固体全部溶解。综合步骤Ⅰ、步骤Ⅱ、步骤Ⅲ分析,该样品中一定含有_______。
15.(2023·河南鹤壁·统考一模)已知A、B、C、D是四种不同类别的物质,它们的转化关系如下图所示。已知A是年产量最高的金属,B中氧元素的质量分数为30%,D的水溶液呈蓝色,常用于配制波尔多液。(“→”表示转化关系,“-”表示能相互反应)
请回答下列问题:
(1)A与D之间发生反应的类型是______。
(2)C→D的化学方程式______。
(3)B→A的化学方程式______。
16.(2023·河南三门峡·统考一模)A、B、C、D、E是初中化学常见的物质,A、B、C含有同一种金属元素且物质类别不同,B是一种白色难溶于水的固体、且相对分子质量为100,D俗称纯碱。物质间的转化关系如图所示。
(1)E的化学式为______;
(2)C与D反应的化学方程式为______。
参考答案:
1.(1)硫酸铜
(2)变浑浊(产生白色沉淀)
(3) [或 ]
(4)置换
(5)氢离子和氢氧根离子结合成生水
【分析】由题干可知,C 是地壳中含量最高的金属,因此,C为单质铝,A 的浓溶液有吸水性,B 的溶液为蓝色,所以,B的溶液中有Cu2+,A 的浓溶液为浓硫酸,A为稀硫酸,由图可知,A能转化为B,推知B为硫酸铜,D 与 A 在物质分类上属于同一类别,故D为酸,即稀盐酸或稀硝酸,E 固体的溶解度随温度升高而减小,E为氢氧化钙,F 是一种气体,且由图可知,F与E反应,A能转化为F,因此,F最常见为二氧化碳,据此思路进行推断。
【详解】(1)由分析可知,B为硫酸铜,故填写:硫酸铜。
(2)由分析可知,F为二氧化碳,E为氢氧化钙溶液,将二氧化碳通入氢氧化钙溶液中,产生不溶于水的碳酸钙白色沉淀和水,因此,现象是变浑浊(产生白色沉淀),故填写:变浑浊(产生白色沉淀)。
(3)由分析可知,D为稀盐酸或稀硝酸,A为稀硫酸,当D为稀盐酸时,A 转化为 D,即硫酸与氯化钡反应,生成氯化氢和硫酸钡白色沉淀,化学方程式为:H2SO4+BaCl2=2HCl+BaSO4↓ ,当D为稀硝酸时,A 转化为 D ,即硫酸与硝酸钡反应,生成硝酸和硫酸钡白色沉淀,化学方程式为:H2SO4+Ba(NO3)2=2HNO3+BaSO4↓ ,故填写:H2SO4+BaCl2=2HCl+BaSO4↓ [或 H2SO4+Ba(NO3)2=2HNO3+BaSO4↓ ]。
(4)由分析可知,C为单质铝,B为硫酸铜,铝与硫酸铜反应,生成单质铜和硫酸铝,符合置换反应的“一换一”特征,属于置换反应,故填写:置换。
(5)由分析可知,A为稀硫酸,E为氢氧化钙,氢氧化钙溶液属于碱,稀硫酸属于酸,酸与碱的反应,属于酸碱中和反应,酸碱中和反应的微观实质是:氢离子和氢氧根离子结合成生水,故填写:氢离子和氢氧根离子结合成生水。
【点睛】该题为框图推断题,解题突破口是:认真审题,寻找突破口,本题突破口为:C 是地壳中含量最高的金属,C为单质铝,E 固体的溶解度随温度升高而减小,E为氢氧化钙,将推出物质代入题干和图中,把剩余未知物质都推出时,再看问题答题。
2.(1) Na2CO3 CaO CaCO3
(2) 氢氧化钠/NaOH 、
(3)Na2CO3或Ca(OH)2
【分析】A为含三种元素的钠盐,C为相对分子质量为100的白色不溶物,可推出C为碳酸钙,碳酸钙高温煅烧生成氧化钙和二氧化碳,且B能与水、A反应生成D和C,可推出B为氧化钙,则A为碳酸钠,D为氢氧化钠,代入验证,符合题意。
【详解】(1)由分析可知,A为碳酸钠,化学式为:Na2CO3;B为氧化钙,化学式为:CaO,C为碳酸钙,化学式为:CaCO3;
(2)氧化钙和水反应生成氢氧化钙,氢氧化钙和碳酸钠反应生成碳酸钙和氢氧化钠,故D中一定含氢氧化钠,发生反应的化学方程式为:、;
(3)D中还可能含有的溶质是过量的碳酸钠或氢氧化钙。
3.(1)单质
(2)CuO+2HCl=CuCl2+H2O
(3)有白色沉淀产生
【分析】A~E代表初中常见的不同类别的物质,它们分别由C、Na、Ca、O、H、Cu、Cl中的一种或几种元素组成,其中B为黑色的氧化物,则B是氧化铜(氧化物);D、E溶液呈碱性,相邻的物质间能反应,C能与氧化铜反应,则C是盐酸(酸),D、E能反应是碳酸钠(盐)、氢氧化钙(碱)中的一种;A能与氧化铜反应,则A是碳或氢气(单质),代入验证,推论合理。
【详解】(1)由分析知,A是碳或氢气,A所属的物质类别是单质;
(2)由分析知,B是氧化铜,C是盐酸,则B与C的反应是氧化铜与盐酸反应生成氯化铜和水,反应的化学方程式为: CuO+2HCl=CuCl2+H2O ;
(3)由分析知,D、E分别是碳酸钠、氢氧化钙中的一种,碳酸钠和氢氧化钙生成碳酸钙白色沉淀和氢氧化钠,因此可观察到的现象是:有白色沉淀产生。
4.(1) 氢氧化铜 CuO+H2SO4=CuSO4+H2O
(2)Fe+H2SO4=FeSO4+H2↑
(3) 还原性 不一定
【详解】(1)若甲是稀硫酸,D为蓝色沉淀,则D是氢氧化铜,可知C中含有铜元素,C中的铜元素由A中转化而来,所以A是氧化铜,故A跟甲反应 为氧化铜和稀硫酸反应生成硫酸铜和水,B是水,乙是可溶性碱,可以和硫酸铜反应生成氢氧化铜,和硫酸盐,代入框图推断正确。
D为氢氧化铜,A和甲反应是氧化铜和稀硫酸反应生成硫酸铜和水,化学方程式为:CuO+H2SO4=CuSO4+H2O。
(2)若乙是稀硫酸,A为红色固体,则A为三氧化二铁,甲可以是还原性物质碳或一氧化碳,C为铁,B为二氧化碳,故C跟乙反应,即铁与硫酸反应生成硫酸亚铁和氢气,化学方程式为:Fe+H2SO4=FeSO4+H2↑。
(3)若A和D均为红色固体,则A为三氧化二铁,D为铜单质,甲可以是还原性物质碳或一氧化碳,C为铁单质,乙是含铜离子的盐溶液,所以反应①中物质甲表现出的化学性质是还原性,甲不一定属于单质。
5.(1)CO
(2)
(3)碱
(4)置换反应
【分析】下图是初中化学中常见物质间的转化关系,其中,在通常情况下,F、G是组成元素相同的两种气体,D在高温下反应生成F,可推出F为二氧化碳,D为碳酸钙,G为一氧化碳,Q、R都是黑色固体,F能与R转化为G,可推出R为碳,G能与Q转化为F,可推出Q为氧化铜,B能与C转化为E、F、水,则C应为酸,B为盐,故B可能是碳酸钠,C为盐酸,则可推出E为氯化钠,A能与B转化为D和E,可推出A为氯化钙,代入验证,符合题意。
【详解】(1)由分析可知,G为一氧化碳,化学式为:CO;
(2)若E是生活中常用的调味剂、防腐剂,可推出E为氯化钠,则反应①为氯化钙和碳酸钠反应生成碳酸钙和氯化钠,该反应的化学方程式为:;
(3)A为氯化钙、B为碳酸钠、D为碳酸钙、E为氯化钠,它们均是由金属离子和酸根离子构成的化合物,属于盐,C为盐酸,盐酸是电离时产生的阳离子都是氢离子的化合物,属于酸,F为二氧化碳、G为一氧化碳,Q为氧化铜,它们和水均是由两种元素组成,其中一种元素是氧元素的化合物,均属于氧化物,R为碳,碳是由碳元素组成的纯净物,属于单质, 一定没有的物质类别是碱;
(4)反应①为氯化钙和碳酸钠反应生成碳酸钙和氯化钠,反应②为碳酸钠和稀盐酸反应生成氯化钠、二氧化碳和水,这两个反应均符合“两种化合物互相交换成分生成另外两种化合物”的反应,均属于复分解反应;反应③为碳酸钙高温煅烧生成氧化钙和二氧化碳,该反应符合“一变多”的特点,属于分解反应,反应④为二氧化碳和碳在高温下反应生成一氧化碳,该反应符合“多变一”的特点,属于化合反应,反应⑤为一氧化碳和氧化铜在加热的条件下反应生成铜和二氧化碳,不属于基本反应类型,故没有涉及的基本反应类型是置换反应。
6.(1)CuCl2
(2)置换反应
(3)
【分析】B是目前世界年产量最高的金属,则B为铁;C 的溶液为蓝色,铜离子在溶液中显蓝色,则 C 可能是铜盐溶液,A具有挥发性,能与B(铁)反应,能转化为C(铜盐),盐酸能与铁反应生成氯化亚铁和氢气,能与氧化铜、氢氧化铜等反应生成氯化铜,盐酸具有挥发性,A可能是盐酸,C是氯化铜;D的溶液俗称石灰水,则D为氢氧化钙;A⁓E为五种不同类别的物质,铁属于单质,氯化铜属于盐,氢氧化钙属于碱,盐酸属于酸,则E为氧化物,E能与D(氢氧化钙)反应,A(盐酸)能转化为E,氢氧化钙能与二氧化碳反应生成碳酸钙和水,盐酸与碳酸钙反应生成氯化钙、水和二氧化碳,则E可能二氧化碳。将猜想代入验证,猜想成立。
【详解】(1)物质C是氯化铜,化学式为:CuCl2;
(2)B与C的溶液发生的反应是铁与氯化铜反应生成氯化亚铁和铜,该反应是由一种单质和一种化合物反应生成一种单质和一种化合物的反应,属于置换反应;
(3)A与D发生的反应是氢氧化钙和盐酸生成氯化钙和水,反应的化学方程式为:。
7.(1)Fe2O3
(2)
(3)
【分析】已知A、C、D、E是四种不同类别的物质,B是铁锈的主要成分,故B为氧化铁,A能转化为水,A能与B反应,C的水溶液呈蓝色(说明含有铜离子),A能转化为C,推测A为盐酸(酸),氧化铁与盐酸反应生成氯化铁和水,盐酸与氧化铜反应生成氯化铜和水,即C为氯化铜(盐),C与E可以反应,A能转化为D,D与E可以反应,推测E为氢氧化钠(碱),D为二氧化碳(氧化物),氯化铜与氢氧化钠反应生成氢氧化铜沉淀和氯化钠,盐酸与碳酸钙反应生成氯化钙、二氧化碳和水,二氧化碳与氢氧化钠反应生成碳酸钠和水,代入验证,推论合理。
【详解】(1)由分析可知,B为氧化铁,化学式为Fe2O3;
(2)A→C为盐酸与氧化铜反应生成氯化铜和水,该反应方程式为;
(3)D与E反应为二氧化碳与氢氧化钠反应生成碳酸钠和水,该反应方程式为。
8.(1)H2O2
(2)置换反应
(3)
(4)
【分析】A与C都是由相同两种元素组成的液体,且A能生成C和B,过氧化氢在二氧化锰催化作用下分解生成水和氧气,则A为过氧化氢,B为氧气,C为水;水电解生成氢气和氧气,则D为氢气;碳燃烧生成E。E能与G反应生成F,F为金属单质,则E为一氧化碳,又由于G为红棕色粉末,则G为氧化铁,F为铁。
【详解】(1)由分析可知,A的化学式为H2O2;
(2)反应④为铁和硫酸反应生成硫酸亚铁和氢气,该反应为一种单质与一种化合物反应生成另一种单质和另一种化合物的反应,属于置换反应;
(3)反应②是水通电分解生成氢气和氧气,反应的化学方程式:;
(4)反应⑤为一氧化碳还原氧化铁生成铁和二氧化碳的反应,化学方程式为。
9.(1)两/2
(2)CuCl2
(3)CaCl2+2AgNO3=2AgCl↓+ Ca(NO3)2
【分析】初中阶段所学过的蓝色沉淀只能是氢氧化铜,则C为氢氧化铜,B为铜盐,A是两种元素组成的化合物,故可推知A溶于水后生成了碱,无色溶液与硝酸银反应生成不溶于硝酸的白色沉淀只能是氯化银,所以混合物中还含有氯元素,故可知该铜盐是氯化铜,氯化铜与氢氧化钙反应生成氢氧化铜蓝色沉淀和氯化钙,氯化钙和硝酸银反应生成氯化银和硝酸钙,则A为氧化钙,B为氯化铜,D为氯化银。
【详解】(1)氧化钙与水反应生成氢氧化钙,属于化合反应,氢氧化钙与氯化铜反应生成氢氧化铜沉淀和氯化钙、氯化钙和硝酸银反应生成氯化银沉淀和硝酸钙,都属于复分解反应,因此实验过程共涉及2种基本反应类型,故填:两或2;
(2)由分析可知,B为氯化铜,其化学式为,故填:CuCl2;
(3)步骤②中氯化钙和硝酸银反应生成氯化银沉淀和硝酸钙,反应的化学方程式为CaCl2+2AgNO3=2AgCl↓+ Ca(NO3)2,故填:CaCl2+2AgNO3=2AgCl↓+ Ca(NO3)2。
10.(1) 还原性 C
(2)
(3)
【分析】A为黑色固体,E为红色单质,B、C、D均为无色气体,G为蓝色溶液,而氧化铜为黑色,氧化铜能与硫酸反应生成硫酸铜和水,溶液中含有硫酸铜时显蓝色,且一氧化碳能与氧化铜反应生成铜和二氧化碳,铜为红色单质,且一氧化碳燃烧生成二氧化碳,则A为氧化铜、B为一氧化碳、C为氧气、D为二氧化碳、E为铜、G为硫酸铜;F为石灰石的主要成分,则为碳酸钙;碳酸钙能与二氧化碳相互转化,符合推断。
【详解】(1)反应①为一氧化碳还原氧化铜的反应,体现了一氧化碳的还原性;
若将B换成某种固体单质,由于碳也能还原氧化铜生成铜和二氧化碳,且碳燃烧生成二氧化碳,则这种单质的化学式为C。
(2)反应⑤为碳酸钙转化为二氧化碳,碳酸钙能与盐酸反应生成氯化钙、水和二氧化碳,反应的化学方程式为。
(3)化合反应是指多种物质生成一种物质的反应,反应②为一氧化碳燃烧生成二氧化碳的反应,属于化合反应,反应的化学方程式为。
11.(1)
(2) 复分解反应
(3)涂油漆、镀金属等合理答案正确
(4)光合作用
【分析】A、E 为固体氧化物,且 A 为黑色粉末;B、D 是由相同元素组成的无色液体,且 B 具有消毒杀菌作用;可知B为过氧化氢,A为二氧化锰,过氧化氢在二氧化锰的作用下生成水和氧气,则D为水,C为氧气,Y 是无色气体,且有毒,Y为一氧化碳;X 是最常见的金属,X为铁;铁、水、氧气共同作用生成E铁锈(主要成分是氧化铁),氧化铁和一氧化碳在高温条件下反应生成铁和Z二氧化碳;氧化铁和盐酸反应得F氯化铁溶液,溶液中有铁离子,显黄色;二氧化碳和水进行光合作用生成有机物和氧气。代入验证,符合题意。
【详解】(1)由分析可知,反应①为过氧化氢在二氧化锰的催化下分解为水和氧气,化学方程式为。
(2)铁、水、氧气共同作用生成铁锈(主要成分是氧化铁),氧化铁和盐酸反应得氯化铁溶液,溶液中有铁离子,显黄色;反应③的反应方程式为Fe2O3+6HCl = 2FeCl3+3H2O,在该反应中两种化合物相互交换成分,生成新的两种化合物,属于复分解反应。
(3)防止铁生锈就是要防止铁同时与水、氧气接触,措施有:刷漆、镀上一层不易锈蚀的金属、保持干燥洁净、制成耐腐蚀的合金等。
(4)反应⑤是二氧化碳和水通过光合作用转化成有机物和氧气。
12.(1)硫酸铜溶液是蓝色的溶液,其他溶液均为无色,故不需要实验就可以确定A是CuSO4溶液。
(2) H2SO4 2NaOH+CuSO4=Cu(OH)2¯+Na2SO4 不能
【分析】A为硫酸铜,A、B混合产生蓝色沉淀,硫酸铜可以与氢氧化钠反应生成氢氧化铜蓝色沉淀和硫酸钠,故B为氢氧化钠,A、C混合产生白色沉淀,硫酸铜与氯化钡反应生成硫酸钡白色沉淀和氯化铜,故C为氯化钡,C、D混合产生白色沉淀,氯化钡和硫酸反应会产生硫酸钡白色沉淀和盐酸,故D为硫酸,故E为盐酸。
【详解】(1)不需要实验就可以确定A是CuSO4溶液,原因是硫酸铜溶液是蓝色的溶液,其他溶液均为无色,故不需要实验就可以确定A是CuSO4溶液。
(2)①、由分析可知:D为硫酸溶液,故溶质为:H2SO4;
②、由分析可知:A与B反应为硫酸铜与氢氧化钠反应生成氢氧化铜蓝色沉淀和硫酸钠,故方程式为:2NaOH+CuSO4=Cu(OH)2¯+Na2SO4;
③、由分析可知:A为硫酸铜,E为稀盐酸,生成物中无沉淀或气体或水,故不符合复分解反应发生的条件,故A与E不能发生化学反应。
13.(1)CO2
(2) 碳酸钠/Na2CO3 氢氧化钾/KOH
【分析】步骤Ⅰ:取少量固体于烧杯中,加水,搅拌,固体全部溶解,得到无色溶液A。碳酸钙难溶于水,故固体混合物中一定不含碳酸钙,硫酸铜溶于水形成蓝色溶液,故固体混合物中一定不含硫酸铜;
步骤Ⅱ:取少量溶液A于试管中,滴加过量MgCl2溶液,有白色沉淀产生;碳酸钠能与氯化镁反应生成碳酸镁和氯化钠,氢氧化钾能与氯化镁反应生成氢氧化镁和氯化钾,再加入过量稀盐酸,沉淀消失,有气泡产生,说明沉淀中含碳酸镁,碳酸镁和稀盐酸反应生成氯化镁、二氧化碳和水,则固体混合物中一定含碳酸钠,不确定是否含氢氧化钾。
【详解】(1)由分析可知,步骤Ⅱ中产生的气泡是二氧化碳,故填:CO2;
(2)由分析可知,固体混合物中肯定含有的是Na2CO3;可能含有的是KOH。
14.(1)CuSO4
(2)
(3)NaOH、Na2CO3、BaCl2
【详解】(1)硫酸铜溶液显蓝色,氢氧化铜沉淀显蓝色,取少量样品于烧杯中,加足量水,充分搅拌,静置,有白色固体产生,上层清液呈无色,则该样品中一定不含CuSO4,故填:CuSO4。
(2)取步骤Ⅰ所得上层清液于试管中,滴入几滴酚酞溶液,溶液变红色,溶液显碱性,可能含有氢氧化钠、碳酸钠中的一种或两种,再滴入过量稀盐酸,无气泡产生,红色逐渐褪去,得到无色溶液,说明上层清液中没有碳酸钠,含有氢氧化钠,即该样品中一定含有氢氧化钠,因为氢氧化钠与盐酸反应生成氯化钠和水,滴入过量稀盐酸,此时溶液显酸性,溶液的红色褪去,反应的化学方程式为:,故填:。
(3)取步骤Ⅰ所得白色固体于试管中,滴入过量稀盐酸,有大量气泡产生,白色固体全部溶解,碳酸钡与盐酸反应生成氯化钡、水和二氧化碳,则白色沉淀全部是碳酸钡,没有硫酸钡,则该样品中一定含有碳酸钠、氯化钡,由②知,该样品中一定含有氢氧化钠,所以该样品中一定含有NaOH、Na2CO3、BaCl2,故填:NaOH、Na2CO3、BaCl2。
15.(1)置换反应
(2)(或)
(3)
【分析】A、B、C、D是四种不同种类的物质,A是年产量最高的金属,故A是铁,B中氧元素的质量分数为30%,B会转化成铁,所以B是铁的氧化物,根据氧元素的质量分数为30%,故铁元素的质量分数为70%,故铁元素和氧元素的质量比为7:3,若设铁的氧化物为FexOy,,故,故B为氧化铁,D的水溶液呈蓝色,常用于配制波尔多液,故D是硫酸铜,C会转化成硫酸铜,会与铁、氧化铁反应,故C是硫酸,经过验证,推导正确。
【详解】(1)由分析可知:A与D之间发生的反应为铁和硫酸铜的反应生成硫酸亚铁和铜,故为单质和化合物生成单质和化合物的反应,故为置换反应。
(2)由分析可知:C→D的反应为硫酸变为硫酸铜,硫酸可以和氧化铜反应生成硫酸铜和水,硫酸也可以与氢氧化铜反应生成硫酸铜和水,故C→D的反应化学方程式为:H2SO4+CuO=CuSO4+H2O 或 H2SO4+ Cu(OH)2=CuSO4+2H2O 。
(3)由分析可知:B→A的反应为氧化铁变为铁,氧化铁可以与还原性物质反应,氧化铁可以与一氧化碳在高温条件下反应生成铁和二氧化碳,也可以与氢气在高温条件下反应生成铁和水,也可以与碳在高温条件下反应生成铁和二氧化碳,故B→A的化学方程式为:
Fe2O3+3CO2Fe+3CO2,Fe2O3+3H22Fe+3H2O,2Fe2O3+3C4Fe+3CO2(任写一个即可)。
16.(1)CO2
(2)
【详解】(1)A、B、C、D、E是初中化学常见的物质,A、B、C含有同一种金属元素且物质类别不同,B是一种白色、难溶于水的固体、且相对分子质量为100,可推出B为碳酸钙,则A、B、C均含钙元素,D俗称纯碱可推出D为碳酸钠,B能转化为A,A能转化为C,C能转化为B,可推出A为氧化钙,C为氢氧化钙,D能转化为E,B能与E相互转化,可推出E为二氧化碳,代入验证,符合题意;
E是二氧化碳,化学式:CO2;
(2)C与D是指氢氧化钙溶液与碳酸钠溶液生成碳酸钙沉淀和氢氧化钠,该反应化学方程式:。
相关试卷
这是一份2023年中考化学冲刺复习推断题模拟新题专练-03推断题突破口之物质状态特征,共13页。试卷主要包含了单选题,推断题等内容,欢迎下载使用。
这是一份2023年中考化学冲刺复习推断题模拟新题专练-02推断题突破口之反应特征②,共17页。试卷主要包含了多选题,单选题,推断题,综合应用题等内容,欢迎下载使用。
这是一份2023年中考化学冲刺复习推断题模拟新题专练-02推断题突破口之反应特征,共19页。试卷主要包含了单选题,推断题等内容,欢迎下载使用。