

统考版2023高考化学二轮专题复习考前非选择题适应性训练训练四
展开非选择题(包括必考题和选考题两部分。第26~28题为必考题,每道题考生都必须作答。第35、36题为选考题,考生根据要求作答。)
(一)必考题(共43分)
26.(14分)一种以辉铜矿(主要成分为Cu2S,含少量SiO2)为原料制备硝酸铜的工艺流程如图所示:
(1)写出“浸取”过程中Cu2S溶解时发生反应的离子方程式: 。
(2)恒温“浸取”的过程中发现铜元素的浸取速率先增大后减少,有研究指出CuCl2是该反应的催化剂,该过程的反应原理可用化学方程式表示为:
①Cu2S+2CuCl2===4CuCl+S;
② 。
(3)“回收S”过程中温度控制在50~60 ℃之间,不宜过高的原因是 。
(4)向滤液M中加入(或通入) (填字母),可得到一种可循环利用的物质。
a.铁 b.氯气c.高锰酸钾 d.氯化氢
(5)“保温除铁”过程中,加入CuO的目的是 ;“蒸发浓缩、冷却结晶”过程中,要用HNO3溶液调节溶液的pH,其理由 。
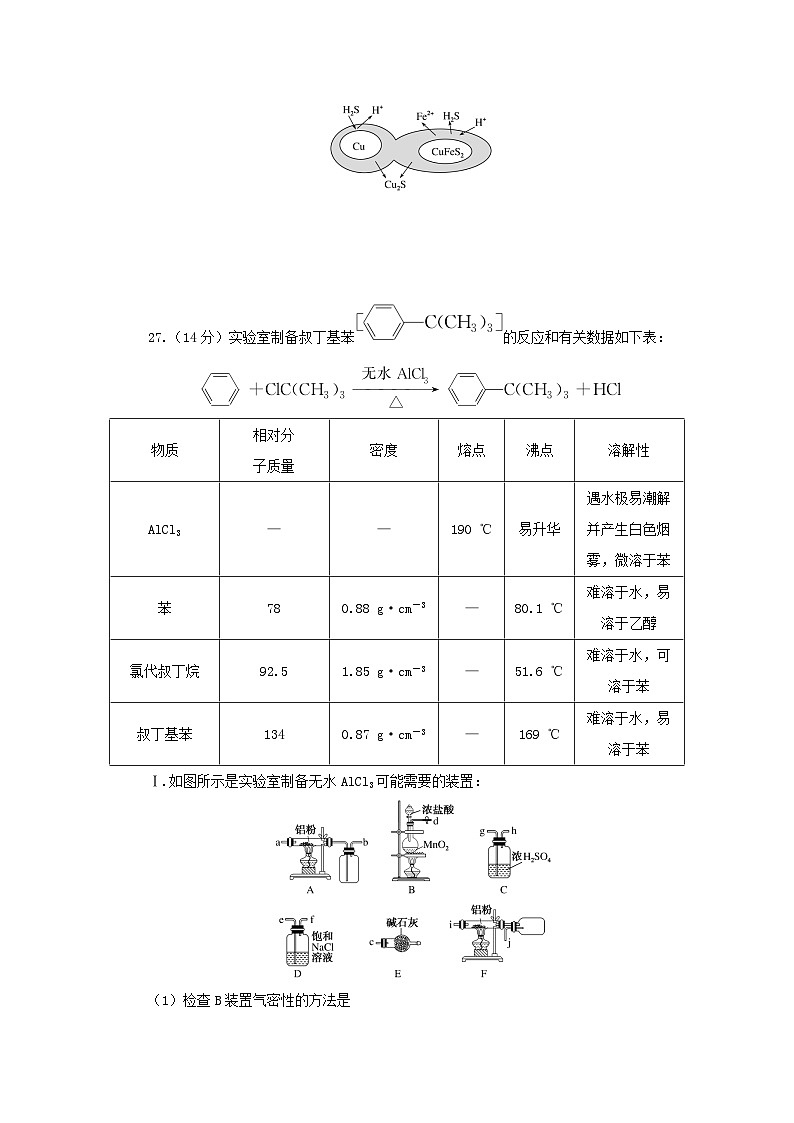
(6)辉铜矿可由黄铜矿(主要成分为CuFeS2)通过电化学反应转变而成,有关转化见图,转化时转移0.2 ml电子,生成Cu2S ml。
27.(14分)实验室制备叔丁基苯的反应和有关数据如下表:
Ⅰ.如图所示是实验室制备无水AlCl3可能需要的装置:
(1)检查B装置气密性的方法是
________________________________________________________________________
________________________________________________________________________
________________________________________________________________________。
(2)制备无水AlCl3的装置合理的连接顺序依次为 (填小写字母),其中E装置的作用是 。
(3)实验时应先加热圆底烧瓶再加热硬质玻璃管,其原因是 。
Ⅱ.如图所示是实验室制备叔丁基苯的装置(夹持装置略):在三颈烧瓶中加入50 mL的苯和适量的无水AlCl3,由恒压漏斗滴加氯代叔丁烷10 mL,一定温度下反应一段时间后,将反应后的混合物洗涤分离,在所得产物中加入少量无水MgSO4固体,静置,过滤,蒸馏得叔丁基苯20 g。
(4)使用恒压漏斗的优点是 ;加入无水MgSO4固体的作用是 。
(5)洗涤混合物时所用的试剂有如下三种,正确的使用顺序是 。(填序号)
①5%的Na2CO3溶液 ②稀盐酸 ③H2O
(6)本实验中叔丁基苯的产率为 。(保留3位有效数字)
28.(15分)研究显示,全球二氧化碳排放量增速趋缓,CO2的综合利用是解决温室问题的有效途径。
(1)一种途径是将CO2转化成有机物实现碳循环。如:
C2H4(g)+H2O(l)===C2H5OH(l)ΔH1=-44.2 kJ·ml-1
2CO2(g)+2H2O(l)===C2H4(g)+3O2(g)ΔH2=+1 411.0 kJ·ml-1
2CO2(g)+3H2O(l)===C2H5OH(l)+3O2(g) ΔH3= 。
(2)CO2甲烷化反应是由法国化学家Paul sabatier提出的,因此,该反应又叫Sabatier反应。CO2催化氢化制甲烷的研究过程如图所示:
①上述过程中,产生H2反应的化学方程式为
________________________________________________________________________。
②HCOOH是CO2转化为CH4的中间体:
CO2 eq \(―――――――――→,\s\up7(Ⅰ),\s\d5(活化能为E1 kJ·ml-1)) HCOOH eq \(――――――――――→,\s\up7(Ⅱ),\s\d5(活化能为E2 kJ·ml-1)) CH4
当镍粉用量增加10倍后,甲酸的产量迅速减少,当增加镍粉用量时,CO2镍催化氢化制甲烷的两步反应中反应速率增加较大的一步是 (填“Ⅰ”或“Ⅱ”)。
(3)CO2经催化加氢可以生成低碳烃,主要有两个竞争反应:
反应Ⅰ:CO2(g)+4H2(g)⇌CH4(g)+2H2O(g)
反应Ⅱ:2CO2(g)+6H2(g)⇌C2H4(g)+4H2O(g)
在1 L恒容密闭容器中充入1 ml CO2和4 ml H2,测得平衡时有关物质的物质的量随温度变化如图甲所示,T1℃时,CO2的转化率为 ,T1℃时,反应Ⅰ的平衡常数K= 。
(4)已知CO2催化加氢合成乙醇的反应原理为2CO2(g)+6H2(g)⇌C2H5OH(g)+3H2O(g) ΔH。
m代表起始时的投料比,即m= eq \f(n(H2),n(CO2)) 。图乙中投料比相同,温度T3>T2>T1,则ΔH (填“>”或“<”)0。
(二)选考题:共15分。请学生从给出的2道题中任选一题作答。如果多做,则按所做第一题计分。
35.[选修3:物质结构与性质](15分)在普通铝中加入少量Cu和Mg后,形成一种称为拉维斯相的MgCu2微小晶粒,其分散在Al中可使得铝材的硬度增加、延展性减小,形成所谓“坚铝”,是制造飞机的主要材料。回答下列问题:
(1)下列状态的镁中,电离最外层一个电子所需能量最大的是 (填标号)。
(2)乙二胺(H2NCH2CH2NH2)是一种有机化合物,分子中氮、碳的杂化类型分别是 、 。乙二胺能与Mg2+、Cu2+等金属离子形成稳定环状离子,其原因是 ,其中与乙二胺形成的化合物稳定性相对较高的是 (填“Mg2+”或“Cu2+”)。
(3)一些氧化物的熔点如下表所示:
解释表中氧化物之间熔点差异的原因
________________________________________________________________________
________________________________________________________________________。
(4)图(a)是MgCu2的拉维斯结构,Mg以金刚石方式堆积,八面体空隙和半数的四面体空隙中,填入以四面体方式排列的Cu。图(b)是沿立方格子对角面取得的截图。可见,Cu原子之间最短距离x= pm,Mg原子之间最短距离y= pm。设阿伏加德罗常数的值为NA,则MgCu2的密度是 g·cm-3(列出计算表达式)。
36.[选修5:有机化学基础](15分)“点击化学”是指快速、高效连接分子的一类反应,例如铜催化的Huisgen环加成反应:
我国科研人员利用该反应设计合成了具有特殊结构的化合物F。合成线路如下:
已知:
(1)A的名称是 。C中官能团的名称是 。
(2)反应④的反应类型为 。
(3)有机物分子中的1 个碳原子上连接4个不同的原子或原子团时,该碳原子称为手性碳原子。上述流程中,存在手性碳原子的有机物有 (填字母)。
(4)反应③属于消去反应,其化学方程式为 。
(5)芳香族化合物G与C互为同分异构体,G的苯环上只有两个对位的取代基,且其中一个取代基为乙烯基(CH2===CH—)。G分子中只有两种官能团,且1 ml G与足量银氨溶液发生银镜反应生成4 ml Ag,则G的结构有 种,其中核磁共振氢谱图中只有7组吸收峰的结构简式为 (写出一种结构即可)。
训练(四)
26.解析:(1)浸取过程中Fe3+将Cu2S氧化,根据电子守恒和元素守恒可得其离子反应方程式;(2)根据Cu2S的最终产物CuCl2可得反应②;(3)回收硫时所用溶剂为苯,苯的熔、沸点较低;(4)M中主要物质为氯化亚铁,通入氯气可生成氯化铁,实现循环使用;(5)“保温除铁”过程要除去Fe3+,故需要加入氧化铜来调节pH,使Fe3+生成氢氧化铁沉淀;铜离子会水解,故在蒸发浓缩和冷却结晶过程中需要加入硝酸来抑制其水解;(6)该转化中Cu被氧化成Cu2S,化合价升高1价,CuFeS2被还原成Cu2S,化合价降低1价,根据电子守恒可知答案为0.2。
答案:(1)Cu2S+4Fe3+===2Cu2++4Fe2++S
(2)CuCl+FeCl3===CuCl2+FeCl2
(3)温度高苯容易挥发
(4)b
(5)调节溶液的pH,使铁元素完全转化为Fe(OH)3沉淀 抑制Cu2+的水解
(6)0.2
27.解析:(1)检查B装置气密性,可利用压强差原理,将分液漏斗注入水后,关闭止水夹,打开分液漏斗的活塞使液体流下,一段时间后液体不能继续流下,说明气密性良好。(2)B装置用于制备氯气,用D、C装置分别除去HCl、水,用F装置制备氯化铝,避免固体堵塞导管,最后连接E装置,以吸收空气中的水,且防止氯气污染空气。(3)实验时应先加热圆底烧瓶再加热硬质玻璃管,原因是若先加热硬质玻璃管,Al先与O2反应,无法制得纯净的AlCl3,加热圆底烧瓶,生成的氯气可将装置内的空气排出。(4)使用恒压漏斗的优点是使液体顺利滴下,MgSO4固体具有吸水作用,加入无水MgSO4固体可起到干燥的作用。(5)反应后混合物中含有氯化铝以及水解生成的氢氧化铝,可加入稀盐酸,然后加入碳酸钠除去盐酸,最后加入水洗涤,则顺序为②①③。(6)50 mL苯的物质的量为 eq \f(50 mL×0.88 g·mL-1,78 g·ml-1) =0.56 ml,10 mL氯代叔丁烷的物质的量为 eq \f(10 mL×1.85 g·mL-1,92.5 g·ml-1) =0.2 ml,加入的苯过量,理论上可生成0.2 ml叔丁基苯,质量为0.2 ml×134 g·ml-1=26.8 g,则产率为 eq \f(20 g,26.8 g) ×100%=74.6%。
答案:(1)分液漏斗注入水后,关闭止水夹,打开分液漏斗的活塞使液体流下,一段时间后液体不能继续流下,说明气密性良好
(2)defghijc 防止空气中的水蒸气进入,吸收多余的氯气
(3)若先加热硬质玻璃管,Al先与O2反应,无法制得纯净AlCl3
(4)使液体顺利滴下 干燥
(5)②①③
(6)74.6%
28.解析:(1)已知反应①C2H4(g)+H2O(l)===C2H5OH(l)
ΔH1=-44.2 kJ·ml-1
②2CO2(g)+2H2O(l)===C2H4(g)+3O2(g)
ΔH2=+1 411.0 kJ·ml-1
结合盖斯定律,反应①+②得:2CO2(g)+3H2O(l)===C2H5OH(l)+3O2(g) ΔH3=ΔH1+ΔH2=-44.2 kJ·ml-1+1 411.0 kJ·ml-1=+1 366.8 kJ·ml-1。(2)①根据流程图可知反应物为Fe、H2O,生成物为H2、Fe3O4,则化学方程式为3Fe+4H2O eq \(=====,\s\up7(300 ℃),\s\d5( )) Fe3O4+4H2。②当镍粉用量增加10倍后,甲酸的产量在迅速减少,说明甲酸的消耗速率大于其生成速率,因此说明反应Ⅱ的速率要比反应Ⅰ的速率增加得快。
(3)反应Ⅰ: CO2(g)+4H2(g)⇌CH4(g)+2H2O(g)
变化量(ml): 0.2 0.8 0.2 0.4
反应Ⅱ: 2CO2(g)+6H2(g)⇌C2H4(g)+4H2O(g)
变化量(ml): 0.4 1.2 0.2 0.8
α(CO2)= eq \f(变化量,起始量) ×100%= eq \f(0.2 ml+0.4 ml,1 ml) ×100%=60%;平衡时,c(CO2)= eq \f(1 ml-0.2 ml-0.4 ml,1 L) =0.4 ml·L-1,c(H2)= eq \f(4 ml-0.8 ml-1.2 ml,1 L) =2 ml·L-1,c(CH4)= eq \f(0.2 ml,1 L) =0.2 ml·L-1,c(H2O)= eq \f(0.4 ml+0.8 ml,1 L) =1.2 ml·L-1,则平衡常数K= eq \f(c(CH4)×c2(H2O),c(CO2)×c4(H2)) = eq \f(0.2×1.22,0.4×24) =0.045。
(4)根据图示,温度越高,H2转化率越低,说明正反应为放热反应,ΔH<0。
答案:(1)+1 366.8 kJ·ml-1
(2)①3Fe+4H2O eq \(=====,\s\up7(300 ℃),\s\d5( )) Fe3O4+4H2 ②Ⅱ
(3)60% 0.045
(4)<
35.解析:本题涉及电离能大小比较、原子轨道杂化方式、配合物稳定性判断、晶体熔点高低比较、晶胞的有关计算,考查学生运用化学用语及文字、图表、模型、图形分析和解决化学问题的能力,借助离子、分子晶体模型解释化学现象,揭示现象本质和规律,体现证据推理与模型认知、宏观辨识与微观探析的学科核心素养。
(1)A表示基态镁原子的第二电离能,B表示基态镁原子的第一电离能,则电离能:A>B;C表示激发态镁原子的第一电离能,则电离能:A>B>C;D表示激发态镁原子的第二电离能,则电离能:A>D。(2)乙二胺分子中,氮原子核外孤电子对数为1,σ键数目为3,则杂化轨道数目为4,故氮原子采取sp3杂化;碳原子核外孤电子对数为0,σ键数目为4,则杂化轨道数目为4,故碳原子采取sp3杂化。乙二胺的两个N提供孤对电子给Mg2+、Cu2+等金属离子,以配位键结合成稳定环状离子。(3)一般来说,晶体熔点:原子晶体>离子晶体>分子晶体。Li2O、MgO均为离子晶体,晶格能:Li2O
答案:
(1)A
(2)sp3 sp3 乙二胺的两个N提供孤对电子给金属离子形成配位键 Cu2+
(3)Li2O、MgO为离子晶体,P4O6、SO2为分子晶体。晶格能MgO>Li2O,分子间作用力(分子量)P4O6>SO2
(4) eq \f(\r(2),4) a eq \f(\r(3),4) a eq \f(8×24+16×64,NAa3×10-30)
36.解析:CH3CH2COCH3与HC≡CH发生加成反应生成B,B与发生取代反应生成C
,
发生反应生成和,D发生“点击化学”生成E,E和CH3CH2COCH3反应生成F。(1)根据A与HC≡CH发生加成反应生成B及B 的结构得到A为CH3CH2COCH3,名称是丁酮;C中官能团的名称是碳碳三键、羟基、醛基。(2)从信息中可以得出反应④的反应类型为加成反应。(3)B、C中连羟基的碳原子上连接4个不同的原子或原子团,因此存在手性碳原子的有机物有B、C。(4)反应③属于消去反应,反应的化学方程式为
(5)芳香族化合物G与C互为同分异构体,G的苯环上只有两个对位的取代基,且其中一个取代基为乙烯基(CH2===CH—)。G分子中只有两种官能团,且1 ml G与足量银氨溶液发生银镜反应生成4 ml Ag,说明一种官能团是碳碳双键,另一种官能团是醛基且有2 ml—CHO,两个—CHO在正丙基的同一个碳上,有3种结构;一个—CHO在的1号碳原子,另外一个—CHO在2号位、3号位共2种;一个—CHO在的2号碳,另外一个—CHO在3号位共1种;两个—CHO在异丙基的同一个碳上,有1种结构;两个—CHO在异丙基的不同碳上,有2种结构;所以G的结构有9种,其中核磁共振氢谱图中只有7组吸收峰的结构简式为
答案:(1)丁酮 羟基、醛基、碳碳三键
(2)加成反应
(3)BC
(4)
(5)9
物质
相对分
子质量
密度
熔点
沸点
溶解性
AlCl3
—
—
190 ℃
易升华
遇水极易潮解并产生白色烟雾,微溶于苯
苯
78
0.88 g·cm-3
—
80.1 ℃
难溶于水,易溶于乙醇
氯代叔丁烷
92.5
1.85 g·cm-3
—
51.6 ℃
难溶于水,可溶于苯
叔丁基苯
134
0.87 g·cm-3
—
169 ℃
难溶于水,易溶于苯
氧化物
Li2O
MgO
P4O6
SO2
熔点/℃
1 570
2 800
23.8
-75.5
统考版2024高考化学二轮专题复习考前非选择题适应性训练训练三(附解析): 这是一份统考版2024高考化学二轮专题复习考前非选择题适应性训练训练三(附解析),共9页。
统考版2024高考化学二轮专题复习考前非选择题适应性训练训练四(附解析): 这是一份统考版2024高考化学二轮专题复习考前非选择题适应性训练训练四(附解析),共9页。
统考版2023高考化学二轮专题复习考前非选择题适应性训练训练一: 这是一份统考版2023高考化学二轮专题复习考前非选择题适应性训练训练一,共11页。












