
2023年安徽省蚌埠市高考化学第二次质检试卷(含解析)
展开
这是一份2023年安徽省蚌埠市高考化学第二次质检试卷(含解析),共17页。试卷主要包含了单选题,流程题,实验题,简答题等内容,欢迎下载使用。
2023年安徽省蚌埠市高考化学第二次质检试卷一、单选题(本大题共7小题,共42.0分)1. 化学与人们的生活密切相关,下列叙述正确的是( )A. 二氧化硫有毒,不能用做食品添加剂
B. 活性炭具有疏松多孔的结构,可用于除异味和杀菌
C. 水泥是应用较广的人造材料,主要化学成分是二氧化硅
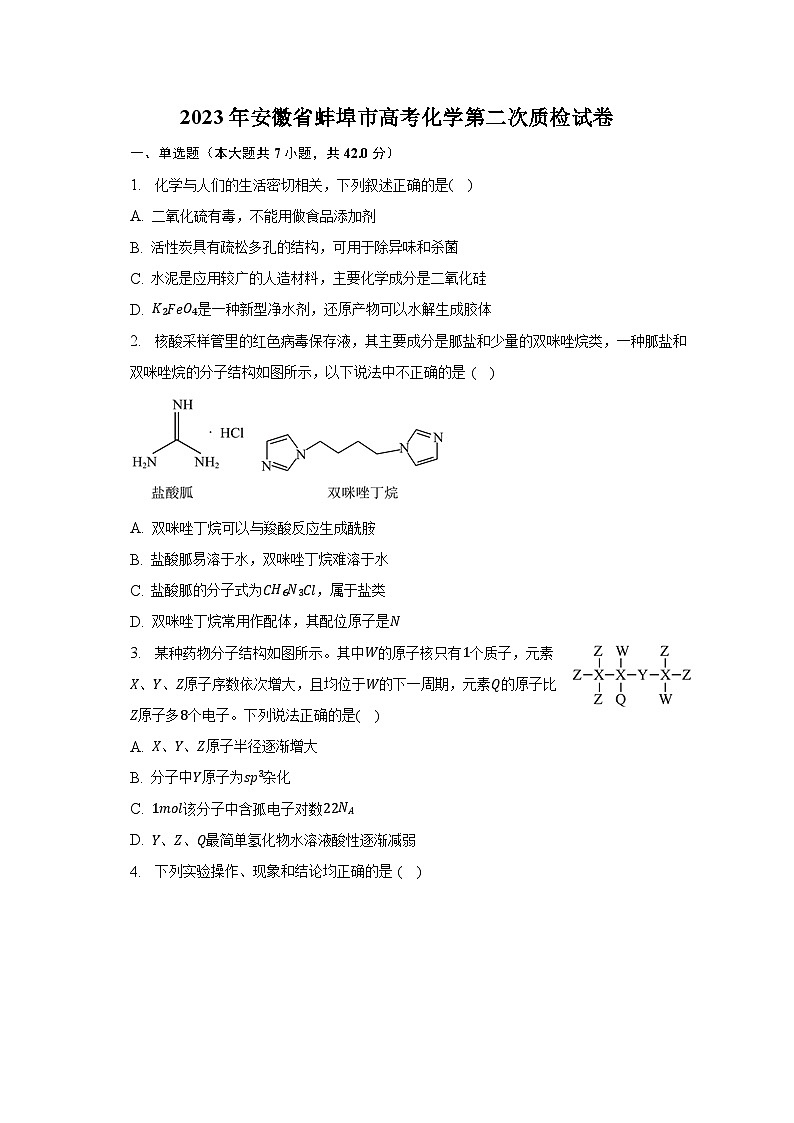
D. 是一种新型净水剂,还原产物可以水解生成胶体2. 核酸采样管里的红色病毒保存液,其主要成分是胍盐和少量的双咪唑烷类,一种胍盐和双咪唑烷的分子结构如图所示,以下说法中不正确的是 ( )
A. 双咪唑丁烷可以与羧酸反应生成酰胺
B. 盐酸胍易溶于水,双咪唑丁烷难溶于水
C. 盐酸胍的分子式为,属于盐类
D. 双咪唑丁烷常用作配体,其配位原子是3. 某种药物分子结构如图所示。其中的原子核只有个质子,元素、、原子序数依次增大,且均位于的下一周期,元素的原子比原子多个电子。下列说法正确的是( )A. 、、原子半径逐渐增大
B. 分子中原子为杂化
C. 该分子中含孤电子对数
D. 、、最简单氢化物水溶液酸性逐渐减弱4. 下列实验操作、现象和结论均正确的是 ( ) 实验操作现象结论向某溶液中滴加氯水,再加溶液溶液变为红色溶液中一定含向蔗糖水解液中加入新制的悬浊液加热煮沸有砖红色沉淀生成蔗糖完全水解向溶液中滴入适量同浓度的溶液,再滴入几滴等浓度溶液先产生蓝色沉淀而后沉淀变黑发生了沉淀的转化加热氯化铵和氢氧化钙混合物,在试管口放一片湿润的蓝色石蕊试纸试纸无明显变化无氨气生成 A. B. C. D. 5. 卡塔尔世界杯上,来自中国的台纯电动客车组成的“绿色军团”助力全球“双碳”战略目标。现阶段的电动客车大多采用电池,其工作原理如图所示,聚合物隔膜只允许通过。的晶胞结构示意图如图所示。围绕和分别形成正八面体和正四面体,它们通过共顶点、共棱形成空间链结构。下列说法中正确的是 ( )
A. 充电时,通过隔膜向阳极迁移
B. 该电池工作时某一状态如图所示,可以推算
C. 充电时,每有电子通过电路,阴极质量理论上增加
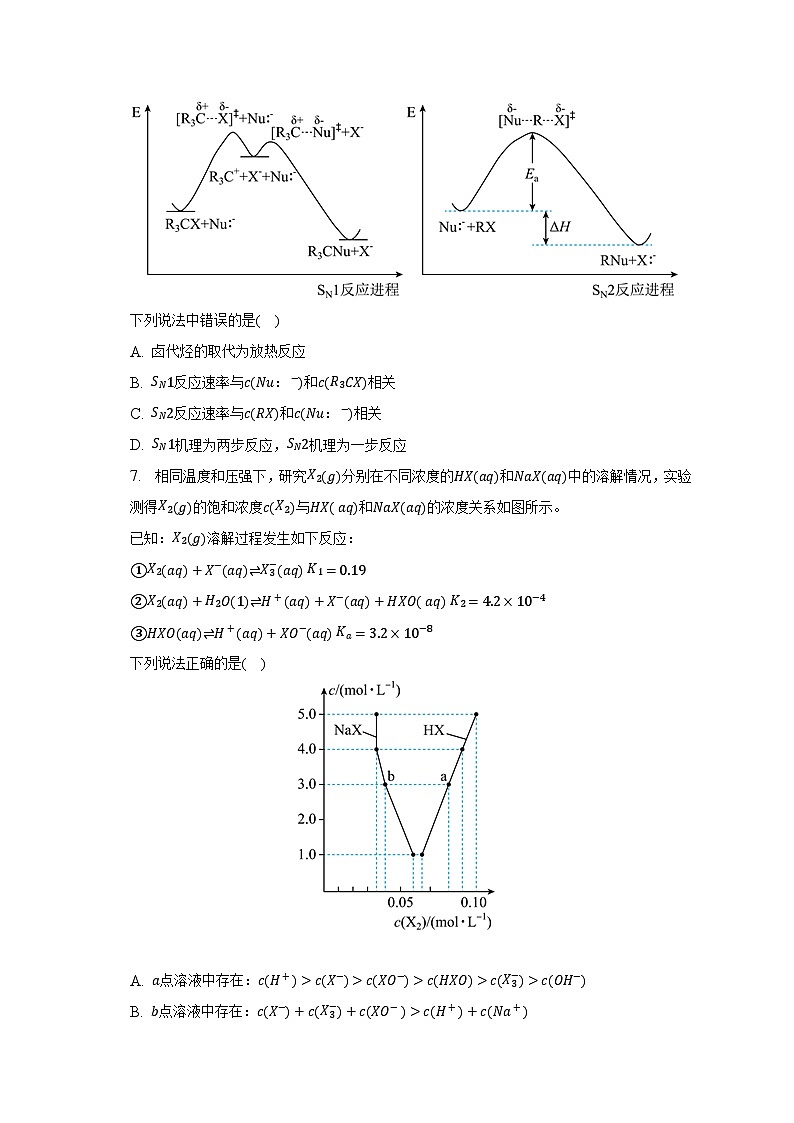
D. 放电时,正极的电极反应方程式为:6. 已知复杂反应的速率由反应历程中活化能最大的一步基元反应决定。卤代烃的取代反应有以下两种反应历程,其反应过程中的能量变化如图所示:
下列说法中错误的是( )A. 卤代烃的取代为放热反应
B. 反应速率与:和相关
C. 反应速率与和:相关
D. 机理为两步反应,机理为一步反应7. 相同温度和压强下,研究分别在不同浓度的和中的溶解情况,实验测得的饱和浓度与和的浓度关系如图所示。
已知:溶解过程发生如下反应:
下列说法正确的是( )
A. 点溶液中存在:
B. 点溶液中存在:
C. 对比图中两条曲线可知对的溶解存在较大的抑制作用
D. 曲线中,随着溶解度的减小,溶液中增大二、流程题(本大题共1小题,共12.0分)8. 如图是以硼镁矿含、及少量、为原料生产硼酸及轻质氧化镁的工艺流程:
回答下列问题:
为了提高硼镁矿的“溶浸”速率,工业中可以采取下列适当措施 ______ 填序号。
A.升高溶浸温度
B.加快搅拌速度
C.缩短酸浸时间
滤渣的主要成分有 ______ 。
吸收过程中发生的离子方程式为 ______ ,的空间构型为 ______ 。
沉镁时调的原因是 ______ 。
已知溶浸后得含的溶液,假定过滤Ⅰ和过滤Ⅱ两步损耗率共,沉镁时沉淀率,最多能生成 ______ 保留到小数点后第位。三、实验题(本大题共1小题,共16.0分)9. 三氯六氨合钴是一种重要的化工产品,实验室制备过程如下:
将一定量的氯化铵和浓氨水置于锥形瓶中,混合均匀;
分批加入氯化钴粉末,边加边搅拌,直至溶液呈棕色稀浆;
再向其中滴加,当固体完全溶解后,慢慢加入浓盐酸加热;
在室温下冷却,过滤,可得到橙黄色晶体。
中的化合价是 ______ ,该配合物中心离子的核外电子排布式为 ______ 。
“加热”应控温在进行,控温方式可采取 ______ ,温度不宜过高的原因是 ______ 。
溶液中、和浓氨水混合后与溶液反应生成的化学方程式是 ______ 。
加入浓盐酸的作用是 ______ 。
沉淀滴定法测定产品中的质量分数:
准确称取的产品,配制成溶液,移取于锥形瓶中;.
滴加几滴溶液为指示剂,用溶液滴定至终点;
重复滴定三次,消耗溶液体积的平均值为,计算晶体中的质量分数。
已知溶解度:,砖红色。
中,滴定至终点的现象是 ______ 。
制备的晶体中的质量分数是 ______ 列计算式即可。四、简答题(本大题共2小题,共30.0分)10. 和两种引发温室效应气体可以转化为合成气和进而可以解决能源问题:
甲醇是新型的汽车动力燃料。工业上可通过和化合制备甲醇,该反应的热化学方程式为。
已知:
表示甲醇燃烧热的热化学方程式为 ______ 。
制备合成气反应通过计算机模拟实验。在,操作压强为条件下,不同水碳比进行了热力学计算,反应平衡体系中的物质的量分数与水碳比、平衡温度的关系如图所示。
据模拟实验可知,该反应是 ______ 填“放热”或“吸热”反应。平衡温度为,水碳比为时,的物质的量分数为,则的转化率为 ______ ,用各物质的平衡分压计算 ______ 。分压总压物质的量分数,结果保留位小数
利用制备的甲醇可以催化制取丙烯,过程中发生如下反应:。
该反应方程的实验数据如图中曲线所示,已知方程为为该反应的焓变,假设受温度影响忽略不计,为平衡常数,和为常数,则该反应的焓变 ______ 。对于另一反应实验数据如图中的曲线所示,若该反应焓变为,则 ______ 填“”“”或“”;此公式说明对于某个反应,当升高相同温度时,其的数值越大,平常数的变化值就 ______ 填“越多”或“越少”。11. 有机化学家科里编制了世界上第一个具有计算机辅助有机合成路线设计程序,获得年诺贝尔化学奖。以下是科里提出的长叶烯的部分合成路线:
回答下列问题:
的目的是 ______ 。
的反应类型是 ______ ,的分子式为 ______ 。
可以与水以任意比例互溶,原因是 ______ 。
、、分子中均含有共轭结构,下列可用于检测共轭体系的是 ______ 。
紫外一可见光谱
红外光谱
核磁共振氢谱
质谱
同时满足下列条件的的同分异构体有 ______ 种不考虑立体异构。
分子中有一个苯环和一个六元碳环以一根键相连
能与溶液发生显色反应
该有机物最多能与发生反应
根据题中信息,写出以为原料合成的路线 ______ 。
答案和解析 1.【答案】 【解析】解:二氧化硫能做某些食品添加剂,如葡萄酒中可添加二氧化硫作抗氧化剂,可以保鲜,故A错误;
B.活性炭具有疏松多孔的结构,可用于除异味,不能杀菌,故B错误;
C.水泥是应用较广的人造材料,主要化学成分是石灰石、二氧化硅和黏土,故C错误;
D.是一种新型净水剂,还原产物可以水解生成胶体,故D正确;
故选:。
A.二氧化硫可抗氧化剂;
B.活性炭具有吸附性;
C.水泥的主要化学成分是石灰石、二氧化硅和黏土;
D.是一种新型净水剂。
本题考查物质的性质及变化,题目难度不大,掌握相关基础知识是解题的关键,平时注意相关知识的积累。
2.【答案】 【解析】解:双咪唑丁烷属于烃的衍生物,不含胺基或亚胺基,不可以与羧酸反应生成酰胺,故A错误;
B.盐酸胍含有胺基和亚胺基,属于盐,易溶于水,双咪唑丁烷为烷烃的含氮衍生物,难溶于水,故B正确;
C.根据结构信息,盐酸胍的分子式为,属于盐类,故C正确;
D.配体中的配位原子含有孤对电子,双咪唑丁烷中的氮原子含有孤对电子,常用作配体,配位原子是,故D正确;
故选:。
A.双咪唑丁烷属于烃的衍生物,不含胺基或亚胺基;
B.盐酸胍含有胺基和亚胺基,属于盐,双咪唑丁烷为烷烃的含氮衍生物;
C.盐酸胍的分子式为;
D.双咪唑丁烷中的氮原子含有孤对电子,常用作配体。
本题考查有机物的结构与性质,侧重考查学生有机基础知识的掌握情况,试题难度中等。
3.【答案】 【解析】解:、、为第二周期元素,随着原子序数的增大,原子半径逐渐减小,故A错误;
B.分子中原子为,形成两个键,含有两个孤对电子,为杂化,故B正确;
C.该分子中含孤电子对的为对、对、对,则该分子中含孤电子对数,故C错误;
D.、、最简单氢化物为、、,水溶液酸性逐渐增强,故D错误;
故选:。
的原子核只有个质子,则为;元素、、原子序数依次增大,且均位于的下一周期,则为第二周期元素,结合物质结构,形成四个共价键,为;形成两个共价键,为;形成一个共价键,为;元素的原子比原子多个电子,为,据此解答。
本题考查原子结构与元素周期律的关系,为高频考点,把握原子序数、物质结构来推断元素为解答关键,注意掌握元素周期律内容及常见元素化合物性质,题目难度不大。
4.【答案】 【解析】解:如果被氧化为也会使溶液变红,向该溶液中滴加氯水,再加溶液,溶液变红,不能说明溶液中一定含有,可能含有,故A错误;
B.蔗糖部分水解,中和酸后,加入新制氢氧化铜悬浊液,也能产生砖红色沉淀,故B错误;
C.加入适量溶液,与恰好完全反应,生成蓝色沉淀,后加入溶液,蓝色沉淀变为黑色沉淀,说明发生了沉淀的转化,故C正确;
D.氨气溶于水,显碱性,能使红色或紫色石蕊变蓝色,即题中应用湿润的红色石蕊试纸,故D错误;
故选:。
A.向该溶液中滴加氯水,再加溶液,溶液变红,不能说明溶液中一定含有,可能含有;
B.蔗糖部分水解,中和酸后,加入新制氢氧化铜悬浊液,也能产生砖红色沉淀;
C.难溶物质会向更难溶的物质转化;
D.氨气溶于水,显碱性,能使红色或紫色石蕊变蓝色。
本题考查离子共存的判断,为高频考点,明确题干暗含信息、常见离子的性质及离子反应发生条件为解答关键,注意掌握常见离子不能共存的情况,试题侧重考查学生的分析与应用能力,题目难度不大。
5.【答案】 【解析】解:充电时,通过隔膜向阴极铜箔迁移,故A错误;
B.图晶胞中原子数为,数为,则化学式为,解得,故B错误;
C.充电时,铜箔作阴极,电极反应式为,每有电子通过电路,阴极质量理论上增加,故C正确;
D.放电时,正极铝箔的电极反应式为,故D错误;
故选:。
由图可知,放电时,负极铜箔的电极反应式为,正极铝箔的电极反应式为,充电时,铜箔作阴极,电极反应式为,铝箔作阳极,电极反应式为,据此作答。
本题考查可充电电池,题目难度中等,能依据图象和信息准确判断正负极和阴阳极是解题的关键。
6.【答案】 【解析】解:由图像可知生成物能量低于反应物,故该反应为放热反应,故A正确;
B.为单分子亲核取代反应,反应物先解离为碳正离子与带负电荷的离去基团,这个过程的活化能大,决定反应速率,所以反应速率只和相关,与:无关,故B错误;
C.反应为双分子亲核取代反应,只有一个阶段,其反应速率与和:相关,故C正确;
D.反应是两步反应,第一步是反应物在溶剂中离解成为碳正离子和由离去基团形成的负离子慢反应,第二步是碳正离子与结合快反应,反应中的断裂与新的键的形成是同时的,为一步反应,故D正确;
故选:。
A.卤代烃的取代反应中生成物能量低于反应物;
B.为单分子亲核取代反应,反应物先解离为碳正离子与带负电荷的离去基团,这个过程的活化能大,决定反应速率;
C.反应为双分子亲核取代反应,只有一个阶段;
D.反应是两步反应,第一步是反应物在溶剂中离解成为碳正离子和由离去基团形成的负离子慢反应,第二步是碳正离子与结合快反应。
本题考查化学反应中能量的变化,着重于对概念的理解,注意放热反应、吸热反应与反应物、生成物之间关系,此题难度中等。
7.【答案】 【解析】解:点主要溶质为、,由于 ,会与反应,所以,故A错误;
B.点溶液中存在:,所以,故B错误;
C.和溶液均能完全电离出,在溶液中,随着增大,的饱和浓度增大,在溶液中,随着减小,的饱和浓度增大,对的溶解度无明显作用,故C错误;
D.溶液中,随着的溶解度减小,其溶液中减小,所以增大,即增大,故D正确;
故选:。
A.由反应可知,为强酸,完全电离,溶液中反应程度,点主要溶质为、,由于 ,会与反应;
B.点溶液中存在电荷守恒:;
C.和溶液均能完全电离出,在溶液中,随着增大,的饱和浓度增大;
D.溶液中,。
本题考查水溶液中的平衡,侧重考查学生微粒浓度关系的掌握情况,试题难度较大。
8.【答案】 、、 正四面体 过小难水解生成,过大生成过多,不利于生成 【解析】解:根据流程图知,硼镁矿粉中加入硫酸铵溶液,为了提高溶浸速率,可以采取适当升温、适当增大溶浸液浓度、研磨成粉末、搅拌等措施,
故答案为:;
根据分析可知,滤渣为难溶性的、、,
故答案为:、、;
得到的气体为,用吸收,发生反应,发生的离子方程式为;中心原子电子对数,中心原子是杂化,没有一对孤电子对,所以的立体结构是正四面体型,
故答案为:;正四面体形;
沉镁时调的原因是:过小难水解生成,过大生成过多,不利于生成,
故答案为:过小难水解生成,过大生成过多,不利于生成;
根据镁守恒可知,最多能生成 的质量为,
故答案为:。
硼镁矿含、及少量、加入硫酸铵溶液,得到气体,根据硼镁矿和硫酸铵化学式知,得到的气体为,用吸收,发生反应,根据过滤及沉镁成分知,过滤中得到的滤渣为难溶性的、、,调节溶液时得到,滤液中含有,沉镁过程发生的反应为,加热分解可以得到轻质;母液中含有。
本题考查混合物分离提纯,为高频考点,把握物质的性质、流程中发生的反应、混合物分离提纯为解答的关键,侧重分析与实验能力的考查,注意元素化合物知识的应用,题目难度中等。
9.【答案】 或 水浴加热 温度过高,会使加快的分解和浓盐酸的挥发 降低的溶解度,便于晶体的析出 滴入最后半滴标准液,溶液中出现砖红色沉淀,半分钟内不消失 【解析】解:中为配体,氯的化合价为价,则的化合价是价,的原子序数是,基态原子核外电子排布式为,失去个电子形成该配合物中心离子,核外电子排布式为或,
故答案为:;或;
“加热”应控温在进行,控温方式可采取水浴加热;温度不宜过高的原因是温度过高,会使加快的分解和浓盐酸的挥发,
故答案为:水浴加热;温度过高,会使加快的分解和浓盐酸的挥发;
溶液中、和浓氨水混合后与溶液反应生成的化学方程式是: ,
故答案为: ;
加入浓盐酸可增大氯离子浓度,作用是降低 的溶解度,便于晶体的析出,
故答案为:降低 的溶解度,便于晶体的析出;
由题可知:的溶解度小于的溶液度,所以在滴加时会与反应生成沉淀,当消耗完时再与结合,所以滴定终点时是与结合生成砖红色沉淀,
故答案为:滴入最后半滴标准液,溶液中出现砖红色沉淀,半分钟内不消失;
由沉淀的化学式可知:反应时与物质的量之比为:,滴定时消耗的物质的量为,则溶液中物质的量为,溶液中的质量为:,故质量分数,
故答案为:。
根据题意,在氨气和氯化铵存在条件下,用双氧水氧化溶液来制备,反应的化学方程式为 ;将粗产品溶于热的稀盐酸中,再向滤液中缓慢加入浓盐酸,有大量橙黄色晶体析出,冰浴冷却后过滤,说明加入热的稀盐酸后应过滤;先用冷的溶液洗涤晶体,再用少许乙醇洗涤,干燥,得产品;
滴定终点时是与结合生成砖红色沉淀;
由沉淀的化学式可知:反应时与物质的量之比为:,滴定时消耗的物质的量为,则溶液中物质的量为,溶液中的质量为:,故质量分数。
本题考查实验方案的设计,侧重考查物质之间的转化和滴定的掌握情况,试题难度中等。
10.【答案】 吸热 或 越多 【解析】解:, , , ,根据盖斯定律可知,,得到甲醇的燃烧热的热化学方程式为 ,
故答案为: ;
根据图像可知,随着温度升高,氢气物质的量分数增大,平衡向正反应方向移动,根据勒夏特列原理,该反应正反应方向为吸热反应;水碳比为,令水蒸气物质的量为,甲烷物质的量为,消耗甲烷物质的量为,则达到平衡时,,,,,
单位:
开始
转化
平衡
氢气的物质的量分数为,解得,即甲烷转化率为;达到平衡时、、、物质的量分数分别为、、、,用分压表示的压强平衡常数,
故答案为:吸热;;;
根据图像可知,,,两式联立解得或;根据图像以及表达式可知,;该方程说明了当升高相同温度时,越大,平衡常数的变化值越多,
故答案为:或;;越多。
根据盖斯定律进行分析;
根据图像可知,随着温度升高,氢气物质的量分数增大,平衡向正反应方向移动,水碳比为,令水蒸气物质的量为,甲烷物质的量为,消耗甲烷物质的量为,则达到平衡时,,,,,
单位:
开始
转化
平衡
氢气的物质的量分数为,解得,即可计算甲烷的转化率;达到平衡时、、、物质的量分数分别为、、、,用分压表示的压强平衡常数;
根据图像可知,,,两式联立解得的值;根据图像以及表达式可知,;该方程说明了当升高相同温度时,越大,平衡常数的变化值越多。
本题考查化学原理部分知识,包含盖斯定律的应用,化学平衡的移动,化学平衡常数的计算,均为常见高频考点,意在考查学生综合分析问题的能力,题目难度中等。
11.【答案】保护羰基 取代反应 可以与水形成分子间氢键 【解析】解:由和分子中都含有六元环羰基可知,的目的是保护羰基,
故答案为:保护羰基;
由分析可知, 的反应为与发生取代反应生成,的结构简式为,分子式为,
故答案为:取代反应;;
分子中含有的羟基能与水分子形成分子间氢键,所以可以与水以任意比例互溶,
故答案为:可以与水形成分子间氢键;
由结构简式可知,紫外一可见光谱可用于检测、、分子中的共轭体系,
故答案为:;
的同分异构体分子中有一个苯环和一个六元碳环以一根键相连,能与氯化铁溶液发生显色反应,该有机物最多能与 氢氧化钠发生反应说明同分异构体分子中含有的官能团为酚羟基和羧基,或酚羟基和酯基,可以视作、、分子中环上的氢原子被或取代所得结构,共有种,
故答案为:;
由题给信息可知,以为原料合成的合成步骤为、作用下转化为,作用下与发生取代反应生成,条件下,在高氯酸锂、碳酸钙作用下转化为,合成路线为,
故答案为:。
由有机物的转化关系可知,作用下与发生加成反应、取代反应生成,与发生取代反应生成,、作用下转化为,作用下与发生取代反应生成,条件下,在高氯酸锂、碳酸钙作用下转化为,条件下,发生消去反应生成。
本题考查有机物的合成,侧重考查学生有机物命名、官能团、反应类型,同分异构体和合成路线的掌握情况,试题难度中等。
相关试卷
这是一份(已拆)2023年安徽省合肥市高考化学第一次质检试卷,共30页。试卷主要包含了选择题,解答题等内容,欢迎下载使用。
这是一份2020-2021学年安徽省蚌埠市光明中学高三化学月考试卷含解析,共22页。试卷主要包含了实验题,综合题等内容,欢迎下载使用。
这是一份2020-2021学年安徽省蚌埠市第十七中学高三化学月考试卷含解析,共27页。试卷主要包含了单选题,实验题,综合题等内容,欢迎下载使用。








