




09.微专题9 溶解度及溶解度曲线课件PPT
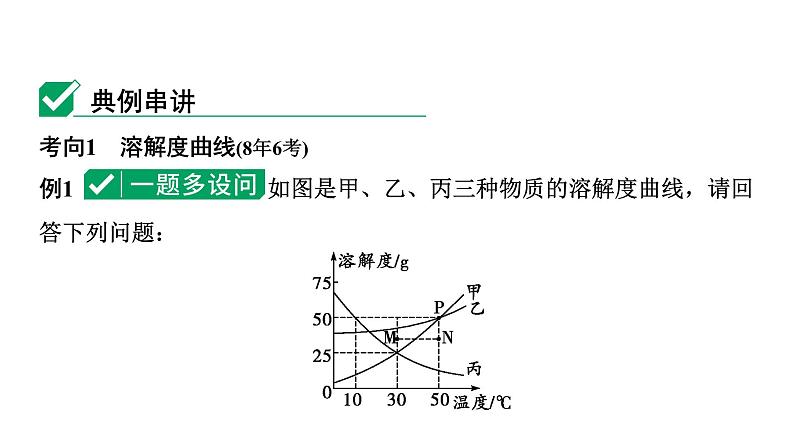
展开考向1 溶解度曲线(8年6考)例1 如图是甲、乙、丙三种物质的溶解度曲线,请回答下列问题:
命题点1 点的含义、溶解度大小的判断及比较(8年5考)(1)M点表示30 ℃甲物质的______(填“饱和”或“不饱和”)溶液,表示乙物质的饱和溶液的点是___(填字母)。(2)P点表示的含义为_________________________________________。(3)10 ℃时,丙物质的溶解度为_____。(4)50 ℃时,甲、乙、丙三种物质的溶解度大小关系为__________。
50 ℃时,甲、乙物质的溶解度相等,均为50 g
命题点2 物质溶解度随温度变化的情况(8年3考)(5)甲、乙两物质的溶解度随温度的升高而______(填“增大”或“减小”,下同),其中溶解度受温度变化影响较大的为____。(6)丙物质的溶解度随温度的升高而______。
命题点3 物质结晶或提纯方法的判断[2021.23(3)②](7)若甲中混有少量乙(或丙)时,提纯甲所用的方法为__________________________。(8)若乙中混有少量甲时,提纯乙的方法为_________。(9)若丙中混有少量甲(或乙)时,提纯丙的方法为________________。(10)从甲的饱和溶液中得到固体甲最好采用的方法是___________________________。
降温结晶(或冷却热饱和溶液)
命题点4 饱和溶液与不饱和溶液的判断及转化(8年4考)(11)30 ℃时将10 g甲加入到50 g水中,充分溶解后得到的是________(填“饱和”或“不饱和”,下同)溶液。(12)将30 ℃时丙的饱和溶液升温到50 ℃,得到的溶液是_____溶液。(13)10 ℃时,将甲的不饱和溶液转化为饱和溶液的方法是________________________。
增加溶质(或恒温蒸发溶剂)
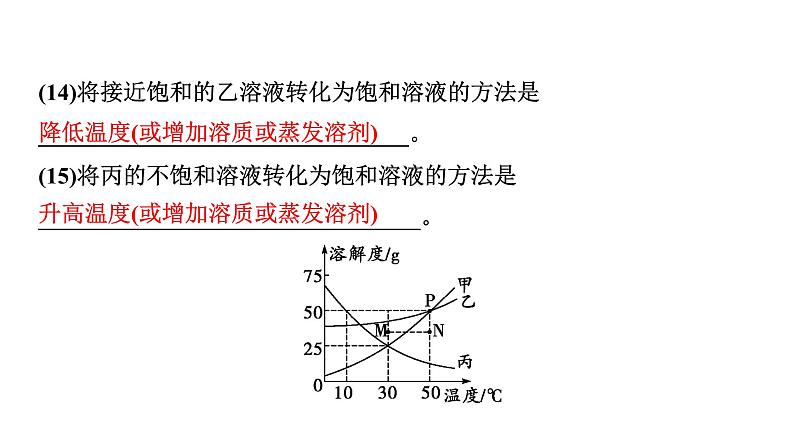
(14)将接近饱和的乙溶液转化为饱和溶液的方法是________________________________。(15)将丙的不饱和溶液转化为饱和溶液的方法是_________________________________。
降低温度(或增加溶质或蒸发溶剂)
升高温度(或增加溶质或蒸发溶剂)
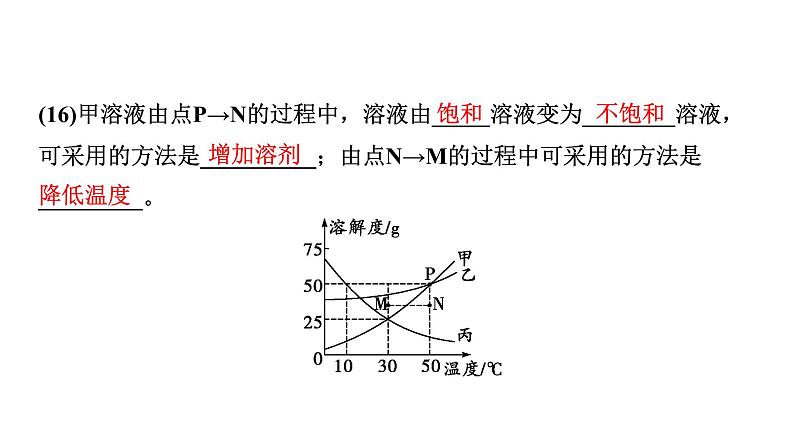
(16)甲溶液由点P→N的过程中,溶液由_____溶液变为________溶液,可采用的方法是__________;由点N→M的过程中可采用的方法是_________。
命题点5 溶液、溶剂、溶质质量及溶质质量分数的计算及比较(8年3考)(17)30 ℃时,50 g水中溶解______g甲恰好形成饱和溶液。(18)10 ℃时,将60 g丙加入100 g水中,充分溶解所得溶液的质量为____g,溶质质量分数为_______。(19)30 ℃时,甲的饱和溶液的溶质质量分数为_____,将100 g甲的饱和溶液配制成10%的溶液,需加水____g。
(20)50 ℃时,甲、乙、丙的饱和溶液的溶质质量分数由大到小的顺序为____________。(21)10 ℃时,配制等质量的甲、乙的饱和溶液,所需溶剂的质量关系为______。(22)50 ℃时,将等质量的甲、乙、丙三种物质分别配制成饱和溶液,所得溶液的质量由大到小的顺序为___________。
命题点6 改变温度时溶液中相关量的变化(8年5考)(23)将50 ℃等质量的甲、乙、丙的饱和溶液同时降温到10 ℃,下列说法一定正确的是_____(填字母)。A. 溶质质量分数:丙>乙>甲B. 溶剂质量:丙>甲=乙C. 溶液质量:丙>乙>甲D. 溶质质量:甲>乙>丙E. 析出晶体质量:甲=乙=丙
(24)30 ℃时将等质量的甲、丙两种物质的饱和溶液升温到50 ℃,两种物质的溶质质量分数的大小关系为______,有固体析出的是____。
考向2 溶解度表格(2022.19)例2 根据表格回答下列问题:
(1)20 ℃时,NaCl的溶解度为_____g,60 ℃时KNO3的溶解度为____g。
(2)由表格数据可知,______________的溶解度随温度的升高而增大,其中溶解度受温度影响较大的物质是______。(3)根据表格分析,氯化钠和硝酸钾溶解度相等的最小温度范围是__________。
①比较不同温度下氯化钠和硝酸钾的溶解度大小;②找出氯化钠溶解度大于硝酸钾、硝酸钾溶解度大于氯化钠时的温度;③确定最小的温度范围。
(4)60 ℃时,将20 g NaCl固体加入50 g水中充分溶解,得到溶液的质量为______g。(5)将等质量的氯化钠、硝酸钾、氢氧化钙饱和溶液分别由60 ℃降温到20 ℃,所得溶液中溶质质量分数由大到小的关系为_____________________。
NaCl>KNO3>Ca(OH)2
考向1 溶解度曲线(8年6考)1. (2022扬州)KNO3与KCl的溶解度曲线如图所示。下列说法正确的是( )A. 10 ℃时,KNO3的溶解度比KCl大B. KCl的溶解度受温度影响的程度比KNO3大C. 60 ℃时,P点表示的KNO3溶液还能继续溶解KNO3固体D. 将60 ℃的KCl饱和溶液降温至10 ℃,溶液中溶质质量分数不变
2. (2019云南省卷)甲和乙两种物质的溶解度曲线如图所示。下列叙述正确的是( )①甲的溶解度随温度的升高而增大②40 ℃时,使甲的饱和溶液析出晶体可用加热升温、冷却降温和蒸发溶剂三种方法③20 ℃时,向125 g溶质质量分数为20%的乙溶液中加入15 g乙固体并振荡,有固体不溶解④将相同质量的甲和乙的饱和溶液分别从40 ℃降温至10 ℃,甲析出晶体的质量大A. ①② B. ③④ C. ①③④ D. ②③④
根据上述图示,下列说法正确的是________(填字母)。①40 ℃时,甲、乙两种溶液的溶质质量分数甲>乙②20 ℃时,将等质量的甲、乙两种物质加水溶解,配成饱和溶液,所得溶液质量甲>乙③将50 ℃时甲、乙的饱和溶液降温至40 ℃时,所得溶液的溶质质量分数为甲>乙
3. (2020昆明卷)甲、乙、丙三种物质的溶解度曲线如图所示,下列说法正确的是( )A. 甲是易溶物B. 60 ℃时,将等质量的甲、乙饱和溶液降温至40 ℃,溶质的质量乙>甲C. 60 ℃时, 将100 g乙的饱和溶液配成质量分数为5%的溶液,需加水380 gD. 甲中混有少量丙,若要得到较纯净的甲,常采用蒸发结晶的方法
4. [选做题](2018昆明卷)如图为四种物质的溶解度曲线。向Na2Cr2O7溶液中加入适量KCl,经蒸发浓缩,冷却结晶,过滤之后得到K2Cr2O7固体。下列有关说法错误的是( )A. 上述过程中涉及的化学反应属于复分解反应B. 80 ℃时100 g四种溶液中,溶质质量分数最小的是NaCl溶液C. 上述冷却结晶过程中,冷却到10 ℃时得到的K2Cr2O7固体比60 ℃时多D. 在0~100 ℃时,相同温度下,四种物质中溶解度最大的均是Na2Cr2O7
5. (2022南充改编)海洋中蕴藏着丰富的化学资源,按目前测定,海水中含有的化学元素有80多种。其中由某些元素组成的盐(均不含结晶水)的溶解度曲线如图所示。(1)在____℃时,氯化钠和硝酸钾的溶解度相等。(2)将接近饱和的硒酸镉溶液变为饱和溶液的方法有_______________________________(任写一种)。
增加溶质(或蒸发溶剂或升高温度)
(3)t2 ℃时,将硝酸钾溶液的状态由N点变为M点,可采用的方法是_______________________________。(4)t1℃时,将三种物质的等质量饱和溶液升温至t3 ℃(不考虑溶剂蒸发),下列说法正确的是______(填选项)。A. 有晶体析出的是硒酸镉溶液B. 溶质质量分数大小关系是: 硝酸钾溶液>氯化钠溶液>硒酸镉溶液C. 溶剂质量大小关系是: 硝酸钾溶液=氯化钠溶液>硒酸镉溶液
增加硝酸钾固体(或恒温蒸发溶剂)
6. [图像创新] 将等质量的甲、乙两种固体分别加入等质量t0 ℃的水中,充分溶解后均有固体剩余,将温度升高到t3 ℃后,剩余固体质量随温度的变化情况如图所示。(1)t3 ℃时,甲溶液是______(填“饱和”或“不饱和”)溶液。(2)t0 ~ t2 ℃乙物质的溶解度随温度的升高而______(填“增大”或“减小”)。
(3)t2 ℃时,甲、乙两种物质的溶解度甲___(填“>”“<”或“=”,下同)乙,降温至t1 ℃,甲、乙两溶液的溶质质量分数甲____乙。
考向2 实物图型(2015.21)7. (2022安徽)已知KNO3在20 ℃、30 ℃时的溶解度分别为31.6 g、45.8 g。某同学按如图所示步骤进行实验,下列说法正确的是( )A. Ⅰ中 KNO3 的质量分数为10.0%B. Ⅱ中溶液是30 ℃时KNO3的不饱和溶液C. Ⅱ中KNO3的质量分数是Ⅰ中的2倍D. Ⅲ中有KNO3晶体析出
8. 一定温度下,对溶有固体甲的溶液进行蒸发,每次蒸发后恢复到原温度。实验记录如下:根据上述实验,以下结论不正确的是( )
A. ①②溶液为不饱和溶液 B. 固体甲在该温度下的溶解度为15 gC. 固体甲的溶解度随温度的升高而增大D. ①~④溶液溶质质量分数:①<②<③=④
考向3 溶解度表格9. (2022德阳)NaOH是常见的碱,其在不同温度下的溶解度如下表所示。下列有关说法正确的是( )A. 20 ℃时,200 g水中能溶解218 g NaOHB. NaOH的溶解度随温度的升高而减小C. 将40 ℃的NaOH饱和溶液升高到60 ℃,其质量分数增大D. 将80 ℃的NaOH饱和溶液降温至20 ℃,析出晶体205 g
10. (2022昆明卷节选)NH4Cl和 KNO3在不同温度时的溶解度如下表,回答下列问题。
(1)40 ℃时,NH4Cl的溶解度是_____g。60 ℃时,向100 g水中加入120 g KNO3固体,所得溶液的质量是____g。
(2)将等质量的NH4Cl、KNO3饱和溶液分别由50 ℃降温至20 ℃,所得NH4Cl溶液中溶质的质量分数___(填“<”“=”或“>”) KNO3溶液中溶质的质量分数。
(3)氯化铵和硝酸钾溶解度相等的最小温度范围是__________。(4)60 ℃时,将105 g KNO3饱和溶液降温至______时,溶液质量变为72.9 g。
(5)30 ℃时,将200 g溶质质量分数为20%的NH4Cl溶液变为该温度下的饱和溶液,至少应向溶液中再加入______g NH4Cl固体。
考向4 综合型(2022.19)11. (2022官渡区二模)图1为甲、乙、丙三种物质的溶解度曲线。兴趣小组进行如图2实验,R是物质甲、乙、丙中的一种。下列说法正确的是( )A. 三种物质的溶解度大小关系为甲>乙>丙B. R是甲物质C. t1℃时, 甲、丙溶液溶质的质量分数相等D. ②③烧杯中的溶液均为饱和溶液
2024沈阳中考化学二轮专题突破 微专题 溶解度及溶解度曲线(课件): 这是一份2024沈阳中考化学二轮专题突破 微专题 溶解度及溶解度曲线(课件),共36页。PPT课件主要包含了蒸发结晶,不饱和,物质的溶解度,t3℃时甲,甲或恒温蒸发溶剂,加溶剂,降温或增加溶剂,加溶质,乙>甲=丙,丙>乙>甲等内容,欢迎下载使用。
2024宁夏中考化学二轮重点专题突破 微专题 溶解度及溶解度曲线(课件): 这是一份2024宁夏中考化学二轮重点专题突破 微专题 溶解度及溶解度曲线(课件),共31页。PPT课件主要包含了丙>乙>甲,不饱和,增加溶剂,蒸发结晶,升温结晶,甲>乙,甲>乙>丙,乙>丙>甲,答案D,降温结晶等内容,欢迎下载使用。
2024辽宁中考化学二轮重点专题研究 微专题 溶解度及溶解度曲线(课件): 这是一份2024辽宁中考化学二轮重点专题研究 微专题 溶解度及溶解度曲线(课件),共39页。PPT课件主要包含了不饱和,蒸发结晶,升高温度,剂或升高温度,增加溶质或蒸发溶,增加溶剂或升高温度,甲>乙或乙<甲,丙>甲=乙,甲丙或乙>,甲>丙等内容,欢迎下载使用。












