






2024届高考一轮复习化学课件第十章 有机化学基础第 63讲 卤代烃 醇 酚
展开1.了解卤代烃的组成、结构特点,掌握卤代烃的性质,能利用卤代烃的形成和转化进 行有机合成。2.能从结构的角度辨识醇和酚,了解重要醇、酚的性质和用途。3.能从官能团、化学键的特点及基团之间的相互影响分析醇和酚的反应规律,并能正 确书写有关反应的化学方程式。
1.卤代烃的概念(1)卤代烃是烃分子里的氢原子被 取代后生成的化合物。通式可表示为R—X(其中R—表示烃基)。(2)官能团是 。
2.卤代烃的物理性质(1)沸点:比同碳原子数的烃沸点要 。(2)溶解性: 于水, 于有机溶剂。(3)密度:一般一氟代烃、一氯代烃比水小,其余比水大。
3.卤代烃的水解反应和消去反应
特别提醒 卤代烃能发生消去反应的结构条件①卤代烃中碳原子数≥2;②存在β-H;③苯环上的卤素原子不能消去。
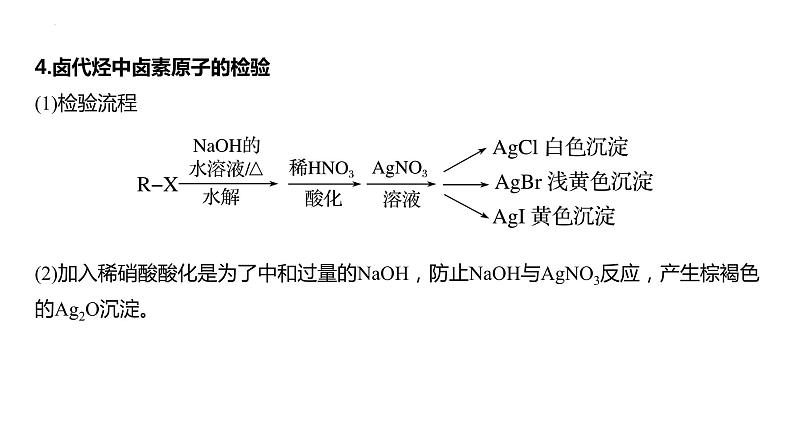
4.卤代烃中卤素原子的检验(1)检验流程
(2)加入稀硝酸酸化是为了中和过量的NaOH,防止NaOH与AgNO3反应,产生棕褐色的Ag2O沉淀。
5.卤代烃的获取(1)不饱和烃与卤素单质、卤化氢等的加成反应
CH3—CH==CH2+Br2―→ ;CH3—CH==CH2+HBr __________________;CH≡CH+HCl ____________。
CH3CHBrCH2Br
(2)取代反应CH3CH3+Cl2 ; +Br2 __________________;C2H5OH+HBr 。
CH3CH2Cl+HCl
1.在卤代烃RCH2CH2X中化学键如图所示,下列说法正确的是
A.发生水解反应时,被破坏的键是①和③B.发生消去反应时,被破坏的键是①和④C.发生水解反应时,被破坏的键是①D.发生消去反应时,被破坏的键是②和③
2.下列化合物中,既能发生水解反应,又能发生消去反应,且消去后只生成一种不饱和化合物的是A.CH3Cl B.C. D.
二、卤代烃制备与有机合成
3.已知有机化合物X、Y、Z、W有如下转化关系,下列说法错误的是A.反应①②③分别为取代反应、取代反应、加成反应B.反应②的条件为NaOH的醇溶液并加热C.W在一定条件下可发生反应生成CH≡C—CH2OHD.由X经三步反应可制备甘油
4.已知二氯烯丹是一种播前除草剂,其合成路线如下:
D在反应⑤中所生成的E,其结构只有一种。
(1)写出下列反应的反应类型:反应①是___________,反应③是____________,反应⑥是___________。
(2)写出下列物质的结构简式:A._______________,E.______________________。(3)写出反应③的化学方程式: _________________________________________________________________________。
CH3—CH==CH2 CH2Cl—CCl==CHCl
CH2Cl—CCl==CH2+NaCl+H2O
1.醇的概念及分类(1)羟基与饱和碳原子相连的化合物称为醇,饱和一元醇的通式为CnH2n+1OH(n≥1)。
思考 (1)醇比同碳原子烃的沸点高的原因为__________________。
(2)甲醇、乙醇、丙醇可与水以任意比例互溶的原因为_________________________。
它们与水分子间形成氢键
3.几种重要醇的物理性质和用途
4.从官能团、化学键的视角理解醇的化学性质(1)根据结构预测醇类的化学性质醇的官能团羟基(—OH),决定了醇的主要化学性质,受羟基的影响,C—H的极性增强,一定条件下也可能断键发生化学反应。(2)醇分子的断键部位及反应类型
按要求完成下列方程式,并指明反应类型及断键部位。
(ⅰ)乙醇与Na反应:______________________________________________________。(ⅱ)乙醇与HBr反应:___________________________________________________。
2CH3CH2OH+2Na―→2CH3CH2ONa+H2↑,置换反应,①
CH3CH2OH+HBr CH3CH2Br+H2O,取代反应,②
(ⅲ)醇分子内脱水(以2-丙醇为例):__________________________________________ _________________。
(ⅳ)醇分子间脱水a.乙醇在浓H2SO4、140 ℃条件下:_________________________________________________________________。
b.乙二醇在浓H2SO4、加热条件下生成六元环醚:_____________________________________________________。
+H2O,取代反应,①②
2H2O,取代反应,①②
(ⅴ)醇的催化氧化a.乙醇:__________________________________________________________。b.2-丙醇:_______________________________________________________________。
5.加成反应、取代反应、消去反应的特点
A1—B2 A2—B1
A==B+x-y(小分子)
1.下列关于醇的化学性质的说法正确的是A.乙醇分子中的氢原子均可被金属钠取代B.乙醇在浓硫酸作催化剂时加热至140 ℃可以制备乙烯C.所有的醇都可以被氧化为醛或酮D.交警检查司机酒后驾车是利用了乙醇能被重铬酸钾氧化的性质
2.某兴趣小组用乙醇和浓硫酸制取乙烯,并验证乙烯气体的生成,所用实验装置如图所示。下列说法正确的是
A.装置A烧瓶中应加入浓硫酸,再沿烧瓶内壁缓 慢加入乙醇B.反应时应迅速升温到170 ℃,并控制温度保持 不变C.为除去乙烯中混有的SO2杂质,装置B洗气瓶中 应装入酸性KMnO4溶液D.实验中有少量副产物乙醚生成,分离乙醇和乙醚的混合物可以采用分液的方法
3.α-萜品醇的键线式如图,下列说法不正确的是
A.1 ml该物质最多能和1 ml氢气发生加成反应B.分子中含有的官能团只有羟基C.该物质能和金属钾反应产生氢气D.该物质能发生消去反应生成两种有机物
二、醇类催化氧化产物的判断
4.下列四种有机物的分子式均为C4H10O。①CH3CH2CH2CH2OH②③④分析其结构特点,用序号回答下列问题:(1)其中能与钠反应产生H2的有__________。
所有的醇都能与活泼金属钠反应产生H2。
①CH3CH2CH2CH2OH②③④(2)能被氧化成含相同碳原子数的醛的是________。
能被氧化成醛的醇分子中必含有基团“—CH2OH”,①和③符合题意。
①CH3CH2CH2CH2OH②③④(3)能被氧化成酮的是______。
能被氧化成酮的醇分子中必含有基团“ ”,②符合题意。
①CH3CH2CH2CH2OH②③④(4)能发生消去反应且生成两种产物的是_____。
若与羟基相连的碳原子的邻位碳原子上的氢原子类型不同,则发生消去反应时,可以得到两种产物,②符合题意。
醇类催化氧化产物的判断
三、常见有机反应类型的判断
5.请观察下图中化合物A~H的转化反应的关系(图中副产物均未写出),并填写空白:
已知:① ② 。
R—CH==CH2+CH3COOH;
(1)写出图中化合物C、G、H的结构简式:C________________,G_______________,H______________________。(2)属于取代反应的有__________(序号,下同)。(3)属于消去反应的是________。
(4)写出反应⑨的化学方程式并指明其反应类型:________________________________________________,___________。
1.概念酚是 直接相连而形成的化合物。
下列化合物中,属于酚类的是_____(填字母)。
2.苯酚的化学性质(1)弱酸性
+H3O+,苯酚具有 ,俗称石炭酸。酸性:H2CO3> > ,苯酚不能使酸碱指示剂变色,其酸性仅表现在与金属、强碱的反应中。
与NaOH反应:__________________________________________;与Na2CO3反应:___________________________________________。
(2)与溴水的取代反应苯酚滴入过量浓溴水中产生的现象为 。化学方程式:
_____________________________________。
(3)显色反应:与FeCl3溶液作用显 色。
(4)苯酚与甲醛在催化剂作用下,可发生缩聚反应,化学方程式:_________________ ____________________________________。
(5)氧化反应:易被空气氧化为 色。
注意 苯酚有毒,浓溶液对皮肤有强腐蚀性,如皮肤不慎沾上苯酚溶液,应立即用乙醇冲洗,再用水冲洗。
3.基团之间的相互影响(1)苯酚与溴的取代反应比苯、甲苯易进行,原因是______________________________________________________________________。
(2)醇、酚、羧酸分子中羟基上氢原子的活泼性比较
羟基对苯环的影响使苯环在羟基
的邻、对位上的氢原子变得活泼,易被取代
1.下列说法正确的是A.苯甲醇和苯酚都能与浓溴水反应产生白色沉淀B.苯甲醇、苯酚在分子组成上相差一个CH2原子团,故两者互为同系物C. 、 、 互为同分异构体D.乙醇、苯甲醇、苯酚都既能与钠反应,又能与NaOH反应
2.某化妆品的组成Z具有美白功效,可用如图反应制备。下列叙述不正确的是
A.可以通过红外光谱来鉴别X和YB.可用酸性高锰酸钾溶液鉴定Z中是否含有YC.Y、Z均可与溴水反应,但反应类型不同D.X可作缩聚反应单体,Y可作加聚反应单体
3.苯酚的性质实验如下:步骤1:常温下,取1 g苯酚晶体于试管中,向其中加入5 mL蒸馏水,充分振荡后液体变浑浊,将该液体平均分成三份。步骤2:向第一份液体中滴加几滴FeCl3溶液,观察到溶液显紫色(查阅资料可知配离子[Fe(C6H5O)6]3-显紫色)。步骤3:向第二份液体中滴加少量浓溴水,振荡,无白色沉淀。步骤4:向第三份液体中加入5% NaOH溶液并振荡,得到澄清溶液,再向其中通入少量CO2,溶液又变浑浊,静置后分层。
下列说法错误的是A.步骤1说明常温下苯酚的溶解度小于20 gB.步骤2中紫色的[Fe(C6H5O)6]3-由Fe3+提供空轨道C.步骤3中生成的2,4,6-三溴苯酚溶解在过量的苯酚中,观察不到沉淀D.步骤4中CO2与苯酚钠反应生成苯酚和Na2CO3
新高考化学一轮复习精品课件 第10章 第63讲 卤代烃 醇 酚 (含解析): 这是一份新高考化学一轮复习精品课件 第10章 第63讲 卤代烃 醇 酚 (含解析),共60页。PPT课件主要包含了卤代烃,必备知识,关键能力,乙醇及醇类,苯酚及酚类,应用举例,真题演练明确考向,课时精练等内容,欢迎下载使用。
2024年高考化学一轮复习课件(鲁科版)第9章 第57讲 卤代烃 醇 酚: 这是一份2024年高考化学一轮复习课件(鲁科版)第9章 第57讲 卤代烃 醇 酚,文件包含第9章第57讲卤代烃醇酚pptx、第9章第57练卤代烃醇酚docx、第9章第57讲卤代烃醇酚docx等3份课件配套教学资源,其中PPT共60页, 欢迎下载使用。
2024年高考化学一轮复习(新高考版) 第10章 第63讲 卤代烃 醇 酚: 这是一份2024年高考化学一轮复习(新高考版) 第10章 第63讲 卤代烃 醇 酚,文件包含2024年高考化学一轮复习新高考版第10章第63讲卤代烃醇酚pptx、2024年高考化学一轮复习新高考版第10章第63讲卤代烃醇酚docx、第10章第63讲卤代烃醇酚docx、第10章第63练卤代烃醇酚docx等4份课件配套教学资源,其中PPT共60页, 欢迎下载使用。












