

还剩14页未读,
继续阅读
所属成套资源:2023届高考化学考前静悟
成套系列资料,整套一键下载
2023届高考化学考前静悟 专题2 重温理论体系框架
展开
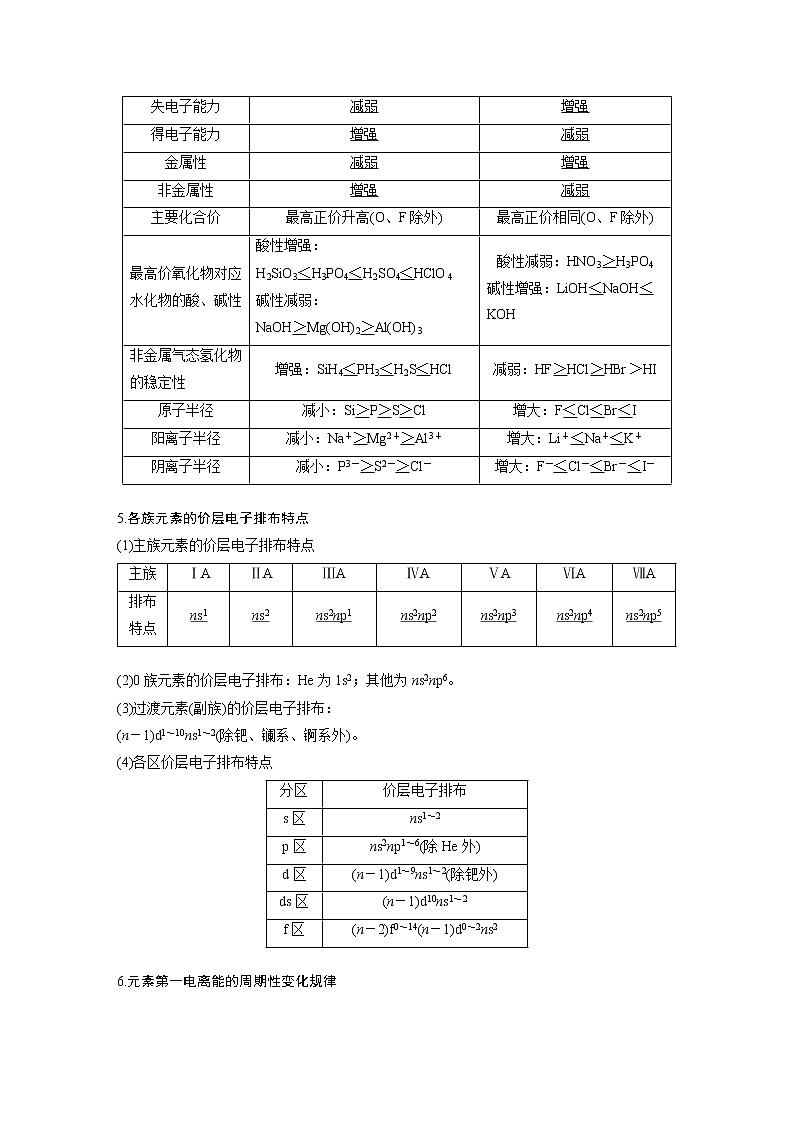
一、元素周期律1.电子运动状态的各种特征(以Mn为例,1s22s22p63s23p63d54s2)(1)不同运动状态的电子数:25(2)不同空间运动状态的电子数:15(3)形状不同的电子云种类:3(4)不同能级(能量)的电子种类:7(5)最高能级的电子数:5(6)最高能层的电子数:22.1~36号元素原子的空轨道数目3.1~36号元素原子的未成对电子数(m)(1)m=1:ns1(4)、ns2np1(3)、ns2np5(3)、3d14s2(1)、3d104s1(1),共12种。(2)m=2:ns2np2(3)、ns2np4(3)、3d24s2(1)、3d84s2(1),共8种。(3)m=3:ns2np3(3)、3d34s2(1)、3d74s2(1),共5种。(4)m=4:3d64s2(1),共1种。(5)m=5:3d54s2(1),共1种。(6)m=6:3d54s1(1),共1种。4.元素周期律的应用5.各族元素的价层电子排布特点(1)主族元素的价层电子排布特点(2)0族元素的价层电子排布:He为1s2;其他为ns2np6。(3)过渡元素(副族)的价层电子排布:(n-1)d1~10ns1~2(除钯、镧系、锕系外)。(4)各区价层电子排布特点6.元素第一电离能的周期性变化规律7.元素周期表中特殊位置的元素(1)族序数=周期数的短周期元素:H、Be、Al。(2)族序数=周期数2倍的元素:C、S;3倍的元素:O。(3)周期数是族序数2倍的元素:Li;3倍的元素:Na。(4)最高正价与最低负价代数和为零的短周期元素:C、Si;最高正价是最低负价绝对值3倍的短周期元素:S。(5)除H外,原子半径最小的元素:F。(1)最外层电子数为2的元素一定在第 ⅡA族( )(2)硅、锗位于金属与非金属元素的交界线处,二者均可以制作半导体材料( )(3)第 ⅠA族元素的金属性一定比同周期的第 ⅡA族的强( )(4)第三周期元素的离子半径从左至右逐渐减小( )(5)气态氢化物的热稳定性:H2O>NH3>SiH4( )(6)碳酸的酸性强于次氯酸,因而碳的非金属性强于氯( )(7)非金属元素原子不可能形成离子化合物( )(8)同主族元素非金属性越强,其简单阴离子的还原性越强( )(9)三氟化硼分子中,B原子最外层满足8电子结构( )(10)第 ⅠA族元素与第 ⅦA族元素结合时,所形成的化学键都是离子键( )(11)元素的第一电离能:I1(Cl)N>C>H( )答案 (1)× (2)√ (3)√ (4)× (5)√ (6)× (7)× (8)× (9)× (10)× (11)× (12)√经典例题例1 下表是分别含元素X、Y的物质性质的比较及得出的结论,其中结论错误的是( )答案 C解析 根据判断元素金属性和非金属性强弱的比较,可知A、B、D三项正确;金属元素的最高化合价不能用于判断元素金属性的强弱,如Al、Na的最高价依次为+3、+1价,但Na比Al的金属性强(活泼),C项错误。例2 a、b、c、d四种元素的原子序数均小于18,a的原子中只有1个电子,b2-和c+的电子层结构相同,d与b的最外层电子数相同。下列叙述错误的是( )A.a与b、d两种元素只能形成两种二元化合物B.b与c元素形成的一种化合物可作为供氧剂C.c的原子半径是这四种元素中最大的D.d和a形成的化合物的水溶液呈弱酸性答案 A解析 a的原子中只有1个电子,则a为氢元素;a、b、c、d四种元素的原子序数均小于18,b2-和c+的电子层结构相同,则b为氧元素,c为钠元素;d与b的最外层电子数相同,则d为硫元素。H和O、S可形成H2O、H2O2、H2S三种二元化合物,A项错误;氧与钠两种元素形成的Na2O2可作为供氧剂,B项正确;根据原子半径的变化规律可知原子半径:Na>S>O>H,C项正确;d和a形成的化合物为H2S,H2S的水溶液呈弱酸性,D项正确。例3 (2022·辽宁沈阳重点高中联合体12月联考)X、Y、Z、W、R均是短周期主族元素,X和Z同主族,Y、Z、W、R同周期。它们组成的某种化合物的结构如图所示,下列叙述正确的是( )A.简单氢化物的稳定性:Y>Z>WB.简单离子半径:Rc(CH3COO-)( )(11)常温下,pH=7的氯化铵和氨水的混合溶液中,离子浓度顺序为c(NHeq \o\al(+,4))=c(Cl-)>c(OH-)=c(H+)( )(12)常温下NaHSO4===Na++H++SOeq \o\al(2-,4),pH=1的NaHSO4溶液中:c(H+)=c(SOeq \o\al(2-,4))+c(OH-)( )(13)锅炉中沉积的CaSO4可用饱和Na2CO3溶液浸泡,再将不溶物用稀盐酸溶解除去( )(14)常温下,在NaHS溶液中滴入少量CuCl2溶液,产生黑色沉淀,水的电离程度增大( )(15)常温下,等体积的盐酸和CH3COOH的pH相同,由水电离出的c(H+)相同( )(16)0.2 mol·L-1CH3COONa与0.1 mol·L-1盐酸等体积混合后的溶液中(pH<7):c(CH3COO-)> c(Cl-)>c(CH3COOH)>c(H+)( )(17)向0.10 mol·L-1 NaHSO3溶液中通入NH3至溶液pH=7:则c(Na+)>c(SOeq \o\al(2-,3))>c(NHeq \o\al(+,4))( )(18)NH4HSO4溶液中各离子浓度的大小关系是c(H+)>c(SOeq \o\al(2-,4))>c(NHeq \o\al(+,4))>c(OH-)( )(19)0.1 mol·L-1氨水中加入CH3COONH4固体,eq \f(cOH-,cNH3·H2O)比值变大( )(20)用标准NaOH溶液滴定未知浓度的CH3COOH溶液到终点时,c(Na+)=c(CH3COO-)( )(21)25 ℃时,用0.01 mol·L-1盐酸滴定20 mL某浓度的氨水时,应选用酚酞作为指示剂( )(22)向含AgCl、AgBr的浊液中加入少量AgNO3,溶液中eq \f(cCl-,cBr-)不变( )(23)强电解质溶液的导电能力一定比弱电解质溶液的导电能力强( )(24)H2CO3的电离常数表达式:Ka=eq \f(c2H+· cCO\o\al(2-,3),cH2CO3)( )(25)常温下,将pH=3的酸和pH=11的碱等体积混合,所得溶液的pH=7( )(26)16.25 g FeCl3水解形成的Fe(OH)3胶体粒子数为0.1NA( )(27)向硫酸铝溶液中滴加碳酸钠溶液的离子方程式为2Al3++3COeq \o\al(2-,3)===Al2(CO3)3↓( )答案 (1)√(2)× c(H+)减小,c(OH-)增大(3)√(4)× 固体物质不写入平衡常数表达式(5)× 反例:BaSO4在饱和Na2CO3溶液中可转化为BaCO3(6)√(7)× 醋酸的浓度大于盐酸,消耗NaOH的量较多(8)√ (9)√(10)× 由于溶液显酸性,CH3COOH的电离程度大于CH3COONa的水解程度,因而c(CH3COO-)>c(Na+)(11)√ (12)√ (13)√(14)× HS-+Cu2+===CuS↓+H+,水的电离程度减小(15)√ (16)√ (17)√ (18)√(19)× CH3COONH4电离的NHeq \o\al(+,4)抑制氨水的电离,c(OH-)减小,c(NH3·H2O)增大,因而比值减小(20)× 滴定终点的生成物为CH3COONa,CH3COO-水解,因而c(Na+)>c(CH3COO-)(21)× 盐酸滴定氨水,终点呈酸性,应选用甲基橙作指示剂(22)√ (23)× 溶液的导电性与离子浓度和离子所带电荷数有关(24)× 多元弱酸分步电离,平衡常数表达式应分步书写(25)× 未指明酸碱的强弱,无法判断(26)× Fe(OH)3胶粒是大量Fe(OH)3的集合体(27)× Al2(CO3)3在水溶液中不存在,应生成氢氧化铝沉淀和二氧化碳气体经典例题例1 常温下,将0.1 mol·L-1 NaOH溶液分别滴加到0.1 mol·L-1的HX、HY、HZ三种酸溶液中,根据三种溶液的pH变化与所加0.1 mol·L-1 NaOH溶液的体积关系所绘制的曲线如图所示。下列说法正确的是( )A.滴定时,三种酸溶液中所加的指示剂一定相同B.滴定至终点时,溶液中由水电离出的c(H+):HZ>HY>HXC.把滴定至终点的三种溶液混合:c(Na+)>c(Z-)>c(X-)>c(Y-)>c(OH-)>c(H+)D.三种酸的pKa越大,滴定时pH突跃的范围越小(pKa=-lg Ka)答案 D解析 由题给图像可知,HZ溶液的pH从1.0开始增大,所以HZ为强酸,HY、HX为弱酸,并且酸性HY>HX。用NaOH溶液滴定HY、HX溶液时,属于强碱滴定弱酸,恰好反应时溶液显碱性,用酚酞作指示剂;而NaOH溶液滴定HZ溶液时,属于强碱滴定强酸,恰好反应时溶液显中性,用酚酞、甲基橙作指示剂都可以,A项不正确;滴定至终点时,生成的NaZ为强酸强碱盐,对水的电离既不促进也不抑制;NaY、NaX为强碱弱酸盐,促进水的电离,因酸性HY>HX,则NaX的促进作用大于NaY的,则溶液中由水电离出的c(H+)的大小关系为HX>HY>HZ,B项不正确;滴定至终点的溶液为等浓度的NaZ、NaY、NaX溶液,因酸性HY>HX,根据“越弱越水解”规律,X-的水解程度比Y-的水解程度大,c(Y-)>c(X-),C项不正确;酸性越弱,Ka越小,pKa越大,根据题给图像可知pH突跃的范围越小,D项正确。例2 常温下,向NaOH溶液中逐滴滴入二元弱酸亚磷酸(H3PO3),含磷微粒的分布分数δ(某含磷微粒的浓度占各含磷微粒浓度之和的分数)与pOH[pOH=-lg c(OH-)]的关系如图所示。下列说法正确的是( )A.曲线b代表的是δ(HPOeq \o\al(2-,3))B.M点的横坐标为9.95C.pOH=7时,c(Na+)=c(H2POeq \o\al(-,3))+2c(HPOeq \o\al(2-,3))+3c(POeq \o\al(3-,3))D.Na2HPO3溶液呈碱性是因为HPOeq \o\al(2-,3)的水解程度大于其电离程度答案 B解析 四、电化学原理1.原电池、电解池的区别2.离子交换膜3.电解原理的应用(1)电镀:待镀件作阴极、镀层金属作阳极、含镀层金属离子的溶液作电镀液。(2)电解精炼铜:纯铜作阴极、粗铜作阳极、硫酸铜溶液作电解质溶液。4.金属(以铁为例)的电化学腐蚀与防护(1)吸氧腐蚀电极反应负极:2Fe-4e-===2Fe2+;正极:O2+4e-+2H2O===4OH-。(2)析氢腐蚀电极反应负极:Fe-2e-===Fe2+;正极:2H++2e-===H2↑。(3)防护方法①原电池原理——牺牲阳极法:与较活泼的金属相连,较活泼的金属作负极被腐蚀,被保护的金属作正极;②电解池原理——外加电流法:被保护的金属与原电池负极相连,形成电解池,作阴极。5.电化学中的易错点再提醒1.判断下列说法是否正确,正确的打“√”,错误的打“×”(1)Cu+2H+===Cu2++H2↑既可在原电池中完成,也可在电解池中完成( )(2)铅蓄电池充电时,标记着“-”的电极应与电源的负极相连( )(3)在Mg、Al和NaOH溶液组成的原电池中,因Mg比Al活泼,故Mg作负极( )(4)铅蓄电池放电时的负极和充电时的阴极均发生还原反应( )(5)电解质溶液导电的过程实际上就是电解的过程( )(6)电解时,电子流动路径是:负极→外电路→阴极→溶液→阳极→正极( )(7)用惰性电极电解MgCl2溶液时,阴极可能得到固体镁( )(8)用惰性电极电解KOH溶液时,阴极的电极反应式是O2+2H2O+4e-===4OH-( )(9)以Pt电极电解电解质溶液时,若两极只有H2和O2析出,则溶液的浓度一定改变( )(10)镀锌铁,若保护层被破坏后,就完全失去了对金属铁的保护作用( )答案 (1)× (2)√ (3)× (4)× (5)√ (6)× (7)× (8)× (9)× (10)×2.下列关于原电池的五个装置图的说法是否正确,正确的打“√”,错误的打“×”(1)图1装置为有阳离子交换膜的锌铜原电池,电池工作一段时间后,甲池的c(SOeq \o\al(2-,4))减小( )(2)控制合适的条件,将反应2Fe3++2I-2Fe2++I2设计成如图2所示的原电池。则反应开始时,乙中石墨电极上发生氧化反应,甲中石墨电极上Fe3+被还原( )(3)通过加入适量乙酸钠,设计成微生物电池可以将废水中的氯苯转化为苯而除去,其原理如图3所示。b极为负极,电极反应式为CH3COO--8e-+2H2O===2CO2↑+7H+,a极为正极,发生还原反应,电极反应式为+2e-+H+===Cl-+ ( )(4)我国最近在太阳能光电催化—化学耦合分解硫化氢研究中取得新进展,相关装置如图4所示。该装置工作时,H+由b极区放电生成氢气,H+由a极区流向b极区,a极上发生的电极反应为Fe2+-e-===Fe3+( )(5)某原电池装置如图5所示,电池总反应为2Ag+Cl2===2AgCl。当电路中转移0.01 mol e-时,交换膜左侧溶液中约减少0.01 mol离子( )答案 (1)× (2)√ (3)√ (4)√ (5)×解析 (1)由于阳离子交换膜只允许阳离子和水分子通过,故甲池的c(SOeq \o\al(2-,4))不变。(5)AgCl/Ag为负极,电极反应为Ag-e-+Cl-===AgCl,当电路中转移0.01 mol e-时,有0.01 mol AgCl沉淀形成,同时还必然有0.01 mol H+通过阳离子交换膜进入正极区,因而左侧减少0.02 mol离子。3.下列关于电解池的五个装置图的说法是否正确,正确的打“√”,错误的打“×”(1)在固态金属氧化物电解池中,高温条件下电解H2O-CO2混合气体制备H2和CO是一种新的能源利用方式,基本原理如图1所示。X是电源的负极,电池总反应是H2O+CO2eq \o(=====,\s\up7(电解))H2+CO+O2( )(2)某模拟“人工树叶”电化学实验装置如图2所示。该装置能将H2O和CO2转化为O2和燃料(C3H8O)。a电极的电极反应式为3CO2+18H+-18e-===C3H8O+5H2O( )(3)三室式电渗析法处理含Na2SO4废水的原理如图3所示,采用惰性电极,ab、cd均为离子交换膜,在直流电场的作用下,两膜中间的Na+和SOeq \o\al(2-,4)可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室。该法在处理含Na2SO4废水时可以得到NaOH和H2SO4产品( )(4)亚磷酸钠(Na2HPO3)溶液电渗析法制备H3PO3(亚磷酸)的原理如图4所示,膜①③均为CM,阳极的电极反应式为2H2O-4e-===4H++O2↑( )(5)近年来,我国多条高压直流电线路的瓷绝缘子出现铁帽腐蚀现象,在铁帽上加锌环能有效防止铁帽的腐蚀,如图5所示,该装置为牺牲阳极法,瓷绝缘子表面产生的OH-向阴极移动( )答案 (1)√ (2)× (3)√ (4)√ (5)×解析 (2)a极为阴极,CO2中碳由+4价变为C3H8O中的-2价,应为得电子的还原反应。(5)该装置为外加电流法,OH-向阳极移动。
空轨道数价电子构型元素种类1ns2np2(3)32ns2np1(3)、3d34s2(1)433d24s2(1)、4s24p1(1)243d14s2(1)1性质同周期(自左而右)同主族(自上而下)电子层结构层数相同层数增大失电子能力减弱增强得电子能力增强减弱金属性减弱增强非金属性增强减弱主要化合价最高正价升高(O、F除外)最高正价相同(O、F除外)最高价氧化物对应水化物的酸、碱性酸性增强:H2SiO3<H3PO4<H2SO4<HClO4碱性减弱:NaOH>Mg(OH)2>Al(OH)3酸性减弱:HNO3>H3PO4碱性增强:LiOH<NaOH<KOH非金属气态氢化物的稳定性增强:SiH4<PH3<H2S<HCl减弱:HF>HCl>HBr>HI原子半径减小:Si>P>S>Cl增大:F<Cl<Br<I阳离子半径减小:Na+>Mg2+>Al3+增大:Li+<Na+<K+阴离子半径减小:P3->S2->Cl-增大:F-<Cl-<Br-<I-主族ⅠAⅡAⅢAⅣAⅤAⅥAⅦA排布特点ns1ns2ns2np1ns2np2ns2np3ns2np4ns2np5分区价层电子排布s区ns1~2p区ns2np1~6(除He外)d区(n-1)d1~9ns1~2(除钯外)ds区(n-1)d10ns1~2f区(n-2)f0~14(n-1)d0~2ns2一般规律同一周期,随着原子序数的增加,元素的第一电离能呈现增大的趋势,稀有气体元素的第一电离能最大,碱金属元素的第一电离能最小;同一主族,随着电子层数的增加,元素的第一电离能逐渐减小特殊情况第一电离能的变化与元素原子的核外电子排布有关。通常情况下,当原子核外电子排布在能量相等的轨道上形成全空(p0、d0、f0)、半满(p3、d5、f7)和全满(p6、d10、f14)结构时,原子的能量较低,该元素具有较大的第一电离能选项物质性质比较结论A最高价氧化物对应的水化物X(OH)m比Y(OH)m碱性强金属性X比Y强B气态氢化物HmX比HmY热稳定性强非金属性X比Y强CX的最高化合价比Y的最高化合价高金属性X比Y强D常温下,X(金属)的单质与盐酸反应比Y(金属)的单质与水反应剧烈不能确定X与Y的金属性强弱强电解质弱电解质概念在水溶液中能够完全电离的电解质在水溶液中只能部分电离的电解质电离程度完全电离部分电离溶质在溶液中存在的形式只有电离出的阴、阳离子既有电离出的阴、阳离子,又有电解质分子化合物类别离子化合物部分共价化合物部分共价化合物实例绝大多数的盐(包括难溶性盐);强酸:HCl、HNO3、H2SO4等;强碱:KOH、NaOH、Ba(OH)2等少数盐;弱酸:CH3COOH、H2CO3、HClO等;弱碱:NH3·H2O、Cu(OH)2、Fe(OH)3等;水致误原因应对策略解释或举例混淆电解池和原电池原理根据电池反应,充电时为电解池,放电时为原电池;与电源连接的为电解池,提供电流的为原电池电池的总反应为Li1-xMnO2+LixC6eq \o(,\s\up7(放电),\s\do5(充电))LiMnO2+C6,放电时负极反应式为LixC6-xe-===C6+xLi+,充电时阳极反应式为LiMnO2-xe-===Li1-xMnO2+xLi+电解时忽视惰性电极和非惰性电极的区别惰性电极为石墨、Pt、Au等,Cu、Fe等金属都是非惰性电极惰性电极与电源正极相连接,电极不参与反应,非惰性电极与电源正极相连接,发生氧化反应不清楚电池正、负极所带电荷情况,错误判断离子迁移方向原电池中,负极附近溶液带正电,阴离子向负极迁移,正极附近溶液带负电,阳离子向正极迁移;电解池中阴离子向阳极迁移,阳离子向阴极迁移在Cu、Zn、H2SO4形成的原电池中,SOeq \o\al(2-,4)向Zn(负极)迁移、H+向Cu(正极)迁移;电解NaCl溶液时,Na+、H+向阴极移动,Cl-、OH-向阳极移动不理解电解反应,错误判断加入复原物质需根据电解反应方程式判断电解CuSO4溶液,2CuSO4+2H2Oeq \o(=====,\s\up7(电解))2Cu+2H2SO4+O2↑,对于此反应,每生成1 mol O2,析出2 mol Cu,加入2 mol CuO或2 mol CuCO3,溶液可复原,加入2 mol Cu(OH)2则多了2 mol H2O
相关资料
更多









