
- 突破05 催化剂、活化能与反应历程(1)-备战2023年高考化学《反应原理综合大题》逐空突破系列 试卷 1 次下载
- 突破07 催化剂、活化能与反应历程(3) 快慢反应-备战2023年高考化学《反应原理综合大题》逐空突破系列 试卷 1 次下载
- 突破08 催化剂、活化能与反应历程(4)——循环反应-备战2023年高考化学《反应原理综合大题》逐空突破系列 试卷 1 次下载
- 突破09 化学平衡图像说理题(一)——温度、压强对平衡的影响-备战2023年高考化学《反应原理综合大题》逐空突破系列 试卷 1 次下载
- 突破11 化学平衡图像说理题(三)——图像中转化率、产率变化分析-备战2023年高考化学《反应原理综合大题》逐空突破系列 试卷 2 次下载
突破10 化学平衡图像说理题(二)——选择反应最佳条件-备战2023年高考化学《反应原理综合大题》逐空突破系列
展开 化学平衡图像说理题(二)
——选择反应最佳条件
【化工生产适宜条件选择的一般原则】
条件
原则
从化学反应速率分析
既不能过快,又不能太慢
从化学平衡移动分析
既要注意外界条件对速率和平衡影响的一致性,又要注意二者影响的矛盾性
从原料的利用率分析
增加易得廉价原料,提高难得高价原料的利用率,从而降低生产成本
从实际生产能力分析
如设备承受高温、高压能力等
从催化剂的使用活性分析
注意催化剂的活性对温度的限制
【真题感悟】
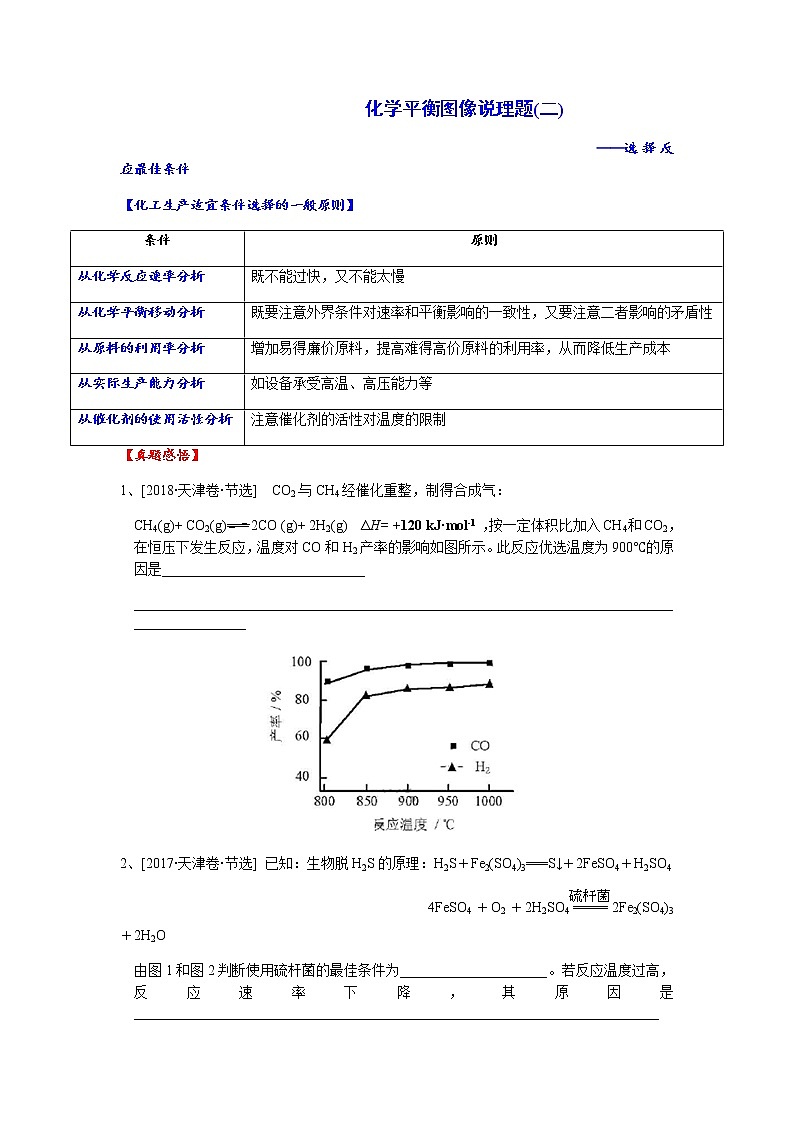
1、[2018·天津卷·节选] CO2与CH4经催化重整,制得合成气:
CH4(g)+ CO2(g)2CO (g)+ 2H2(g) ΔH= +120 kJ·mol-1 ,按一定体积比加入CH4和CO2,在恒压下发生反应,温度对CO和H2产率的影响如图所示。此反应优选温度为900℃的原因是_____________________________
_____________________________________________________________________________________________
2、[2017·天津卷·节选] 已知:生物脱H2S的原理:H2S+Fe2(SO4)3===S↓+2FeSO4+H2SO4
4FeSO4+O2+2H2SO42Fe2(SO4)3+2H2O
由图1和图2判断使用硫杆菌的最佳条件为_____________________。若反应温度过高,反应速率下降,其原因是___________________________________________________________________________
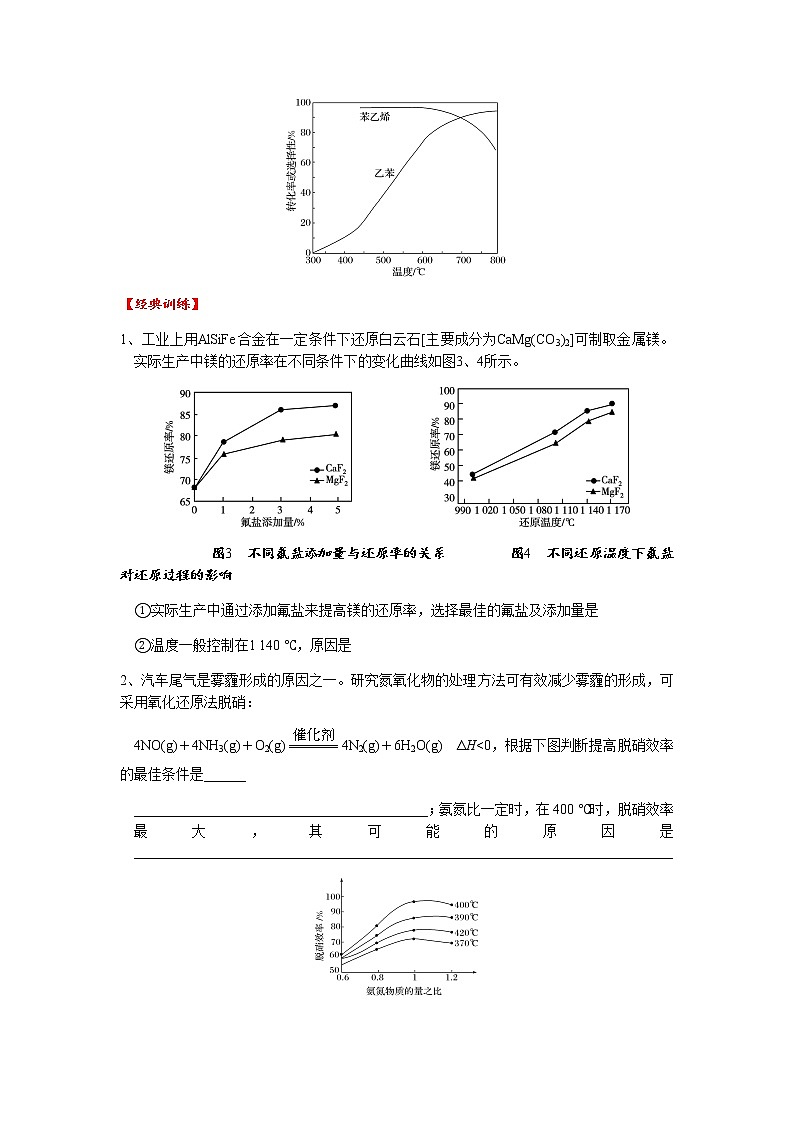
3、[2016·全国卷Ⅱ·节选] 以丙烯、氨、氧气为原料,在催化剂存在下生成丙烯腈(C3H3N)和副产物丙烯醛(C3H4O)的热化学方程式如下:①C3H6(g)+NH3(g)+O2(g)===C3H3N(g)+3H2O(g) ΔH=-515 kJ·mol-1
②C3H6(g)+O2(g)===C3H4O(g)+H2O(g) ΔH=-353 kJ·mol-1
丙烯腈和丙烯醛的产率与n(氨)/n(丙烯)的关系如图所示。由图可知,最佳n(氨)/n(丙烯)约为__________,理由是______________________________________________
4、[2015·浙江卷·节选]乙苯催化脱氢制苯乙烯反应:+H2(g)
ΔH=+124 kJ·mol-1,工业上,通常在乙苯蒸气中掺混水蒸气(原料气中乙苯和水蒸气的物质的量之比为1∶9),控制反应温度600 ℃,并保持体系总压为常压的条件下进行反应。在不同反应温度下,乙苯的平衡转化率和某催化剂作用下苯乙烯的选择性(指除了H2以外的产物中苯乙烯的物质的量分数)变化如图,控制反应温度为600 ℃的理由___________________________________________________________________________________
_________________________________________________________________________________
【经典训练】
1、工业上用AlSiFe合金在一定条件下还原白云石[主要成分为CaMg(CO3)2]可制取金属镁。实际生产中镁的还原率在不同条件下的变化曲线如图3、4所示。
图3 不同氟盐添加量与还原率的关系 图4 不同还原温度下氟盐对还原过程的影响
①实际生产中通过添加氟盐来提高镁的还原率,选择最佳的氟盐及添加量是
②温度一般控制在1 140 ℃,原因是
2、汽车尾气是雾霾形成的原因之一。研究氮氧化物的处理方法可有效减少雾霾的形成,可采用氧化还原法脱硝:
4NO(g)+4NH3(g)+O2(g)4N2(g)+6H2O(g) ΔH<0,根据下图判断提高脱硝效率的最佳条件是______
__________________________________________;氨氮比一定时,在400 ℃时,脱硝效率最大,其可能的原因是_____________________________________________________________________________
3、下图是在一定时间内,使用不同催化剂Mn和Cr在不同温度下对应的脱氮率,由图可知工业使用的最佳催化剂为________、相应温度为________;使用Mn作催化剂时,脱氮率b~a段呈现如图变化的可能原因是_____
_______________________________________________________________________________________________
4、大气中CO2含量的增加会加剧温室效应,为减少其排放,需将工业生产中产生的CO2分离出来进行储存和利用。以TiO2/Cu2Al2O4为催化剂,可以将CO2和CH4直接转化为乙酸,请写出该反应的化学方程式:____________。在不同温度下催化剂的催化效率与乙酸的生成速率的关系如图所示。在温度为____________时,催化剂的活性最好,效率最高。请解释图中250~400℃时乙酸生成速率变化的原因:250~300℃时____________________
________________________;300~400℃时________________________________________________________
5、为更有效处理工业废气中排放的氮氧化物(NOx)、SO2等,减少大气污染。科学家不断对相关反应进行研究尝试。
(1)脱硝反应机理如图,Cu+的作用是____________,C2H4参与的反应方程式 ______________
(2)选择性催化还原技术(SCR)是目前较为成熟的烟气脱硝技术,其反应原理主要为:
4NH3(g)+4NO(g)+O2(g)4N2(g)+6H2O(g);ΔH= -1627 kJ•mol-1
①该方法应控制反应温度在315~400℃之间,反应温度不宜过高的原因是_____________________________
_____________________________________________________________________
②氨氮比 n(NH3)/n(NO) 会直接影响该方法的脱硝率。如图为350 ℃时,只改变氨气的投放量,NO的百分含量与氨氮比的关系图。当 n(NH3)/n(NO)>1.0时,烟气中NO含量反而增大,主要原因是______________
__________________________________________________________________________________________
(3)烟气脱硫、脱硝一体化技术是大气污染防治研究的热点。ClO2及NaClO2均是性能优良的脱硫脱硝试剂。某研究小组用ClO2进行单独脱除SO2实验时,测得SO2的脱除率随溶液pH变化如图所示。当3
6、CO可用于合成甲醇,反应方程式为CO(g)+2H2(g)CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如图所示。该反应ΔH_____0(填“>”或“<”)。实际生产条件控制在250 ℃、1.3×104 kPa左右,选择此压强的理由是________________________________________________________________________________
7、研究发现利用NH3可消除硝酸工业尾气中的NO污染。NH3与NO的物质的量之比分别为1∶3、3∶1、4∶1时,NO脱除率随温度变化的曲线如图所示。
(1)曲线a中,NO的起始浓度为6×10-4 mg·m-3,从A点到B点经过0.8 s,该时间段内NO的脱除速率为_______
mg·m-3·s-1。
(2)曲线b对应的NH3与NO的物质的量之比是________,其理由是_______________________________________
________________________
8、针对反应3CO(g)+3H2(g)CH3OCH3(g)+CO2(g),在恒定压强下,该反应的反应物CO的平衡转化率随温度和不同投料比的变化如图所示。研究发现,使用CuMn合金作催化剂,可以有效加快该反应的反应速率,实验测得反应体系中各物质的产率或转化率与催化剂中n(Mn)/n(Cu)的关系如图所示。则催化剂中n(Mn)/n(Cu)约为________时最有利于二甲醚的合成。在实际生产过程中,需要加入催化剂,而且反应器必须要进行热交换,以保证反应器的温度控制在270~340 ℃,其原因是_________________________________________________
______________________________________________________________________________________________
9、T ℃时,向一恒容密闭容器中加入3 mol H2和1 mol Se,发生反应:H2(g)+Se(s)H2Se (g) ΔH<0,温度对H2Se产率的影响如图:
550 ℃时H2Se产率最大的原因:________________________________________________。
10、二醚水蒸气重整制氢过程涉及反应如下:CH3OCH3(g)+3H2O(g)===2CO2(g)+6H2(g) ΔH=+122.6kJ·mol-1
CO会造成燃料电池催化剂中毒,重整反应体系中CO体积分数随水醚比与温度的变化关系如图2。
①相同温度下,水醚比为________时,CO体积分数最高。
②实际生产中选择反应温度为250 ℃的原因为______________________________________________________;
选择水醚比为3~6的原因为_____________________________________________
11、氨气制取尿素[CO(NH2)2]的合成塔中发生反应:2NH3(g)+CO2(g)CO(NH2)2(l)+H2O(g)。下图为合成塔中不同氨碳比a [] 和水碳比b[]时二氧化碳转化率(α)。b宜控制在 范围内
A.0.6~0.7 B.1~1.1 C.1.5~1.6
a宜控制在4.0左右,理由是
12、汽车使用乙醇汽油并不能减少NOx的排放,某研究小组在实验室以耐高温试剂Ag-ZSW-5催化,测得NO转化为N2的转化率随温度变化情况如下图所示,在=1条件下,最佳温度应控制在______左右
13、用催化转化装置净化汽车尾气,装置中涉及的反应之一为2NO(g)+2CO(g)N2(g)+2CO2(g)。探究上述反应中NO的平衡转化率与压强、温度的关系,得到如图所示的曲线。催化装置比较适合的温度和压强是______
14、采用一种新型的催化剂(主要成分是Cu-Mn合金),利用CO和H2制备二甲醚(CH3OCH3)
主反应:2CO(g)+4H2(g)CH3OCH3(g)+H2O(g)
副反应:CO(g)+H2O(g)CO2(g)+H2(g)
CO(g)+2H2(g)CH3OH(g)
测得反应体系中各物质的产率或转化率与催化剂的关系如图所示,则催化剂中n(Mn)/n(Cu)约为________时最有利于二甲醚的合成
15、二甲醚催化重整制氢的反应过程,主要包括以下几个反应(以下数据为25 ℃、1.01×105 Pa测定):
Ⅰ:CH3OCH3(g)+H2O(l)2CH3OH(l) ΔH>0
Ⅱ:CH3OH(l)+H2O(l)CO2(g)+3H2(g) ΔH>0
Ⅲ:CO(g)+H2O(l)CO2(g)+H2(g) ΔH<0
Ⅳ:CH3OH(l)CO(g)+2H2(g) ΔH>0
工业生产中测得不同温度下各组分体积分数及二甲醚转化率的关系如图所示,你认为反应控制的最佳温度应为________
A.300~350 ℃ B.350~400 ℃ C.400~450 ℃ D.450~500 ℃
16、煤制天然气发生2个反应,反应Ⅰ:C(s)+H2O(g)CO(g)+H2(g) ΔH=+135 kJ·mol-1,
反应Ⅱ:CO(g)+H2O(g)CO2(g)+H2(g) ΔH=-41 kJ·mol-1。下图表示不同温度条件下,煤气化反应Ⅰ发生后的汽气比(水蒸气与原料气中CO物质的量之比)与CO平衡转化率的变化关系。若煤气化反应Ⅰ发生后的汽气比为0.8,经煤气化反应Ⅰ和水气变换反应Ⅱ后,得到CO与H2的物质的量之比为1∶3,则反应Ⅱ应选择的温度是________(填“T1”“T2”或“T3”)
17、重晶石主要成分为BaSO4,含少量的SiO2、CaO和MgO杂质,以下是一种制取Ba(NO3)2的工业流程。
焙烧过程中主反应为:BaSO4 + 4CBaS + 4CO↑,除此以外还可能有BaCO3等副产物生成,通过改变温度以及煤粉的用量可减少副反应发生
(1)依据图1判断生成BaS的反应是________(填“放热”或“吸热”)反应;反应温度至少应控制在________以上。
(2)控制BaSO4的量不变,改变C的量,测得原料中碳的物质的量对平衡组成的影响如图2所示,判断原料中至少为________
a.1.5 b.2.0 c.3.75
18、以乙烯(C2H4)作为还原剂脱硝(NO),脱硝机理如图1,则总反应的化学方程式为_________________________;
脱硝率与温度、负载率(分子筛中催化剂的质量分数)的关系如图2,为达到最佳脱硝效果,应采用的条件是____
_______________________
【化学平衡图像说理题(二)——选择反应最佳条件】答案
【真题感悟】
1、900 ℃时,合成气产率已经较高,再升高温度产率增幅不大,但能耗升高,经济效益降低。
解析:根据图3得到,900℃时反应产率已经比较高,温度再升高,反应产率的增大并不明显,而生产中的能耗和成本明显增大,经济效益会下降,所以选择900℃为反应最佳温度
2、30 ℃、pH=2.0 蛋白质变性(或硫杆菌失去活性)
解析:由图1可知,温度在30 ℃左右时,Fe2+氧化速率最快;由图2可知,反应混合液的pH=2.0左右时,Fe2+氧化速率最快。由此可推断使用硫杆菌的最佳条件为温度为30 ℃、混合液的pH=2.0。硫杆菌属于蛋白质,若反应温度过高,受热变性失活,导致反应速率下降。
3、1.0 该比例下丙烯腈产率最高,而副产物丙烯醛产率最低
4、600 ℃,乙苯的转化率和苯乙烯的选择性均较高。温度过低,反应速率慢,转化率低;温度过高,选择性下降,高温还可能使催化剂失活,且能耗大
【经典训练】
1、 ①CaF2、3% ②该温度时,镁的还原率已近90%,温度低还原率低,温度太高能耗高
2、在氨氮物质的量之比为1,温度在400 ℃时,脱硝效率最大 在400 ℃时催化剂的活性最好,催化效率最高,同时400 ℃温度较高,反应速率快
3、Mn 200 ℃左右 b~a段,开始温度较低,催化剂活性较低,脱氮反应速率较慢,反应还没达到化学平衡,随着温度升高反应速率变大,一定时间参与反应的氮氧化物变多,导致脱氮率逐渐升高
4、CO2+CH4CH3COOH
250℃ 催化剂效率下降是影响乙酸生成速率的主要原因 温度升高是影响乙酸生成速率的主要原因
解析:CO2和CH4发生反应:CO2+CH4CH3COOH;根据图像,当温度为250℃时,乙酸的生成速率最大,催化剂的催化效率最大;在250℃~300℃过程中,催化剂是影响速率的主要因素,因此催化效率的降低,导致反应速率也降低;而在300℃~400℃时催化效率低且变化程度小,但反应速率增加较明显,因此该过程中温度是影响速率的主要因素,温度越高,反应速率越大。
5、(1)催化剂 2C2H4 + 6Cu+(NO2) = 3N2 + 4CO2 + 4H2O + 6Cu+
(2)正反应放热,温度过高会降低NO的转化率 NH3和O2再次反应生成NO(或4NH3+5O2=4NO+6H2O) (3)pH<7时,随着pH值的增大,ClO2的稳定性降低氧化性减弱,SO2的脱除率降低。 当pH>7.8后,随着
碱性的增强,生成ClO2-增多,氧化性增强,SO2的脱除率上升
解析:(1) 催化剂在化学反应前后性质、质量不变,图示中Cu+在反应前后不变,为催化剂;用乙烯进行脱硝(NO),从图示可以知道,乙烯被NO氧化成二氧化碳(其中C由-2→+4),NO自身被还原成N2(其中N由+2→0),反应方程式为:2C2H4 + 6Cu+(NO2) = 3N2 + 4CO2 + 4H2O + 6Cu+,因此,本题正确答案是:催化剂;2C2H4 + 6Cu+(NO2) = 3N2 + 4CO2 + 4H2O + 6Cu+;
(2)①该方法应控制反应温度在315~400℃之间,反应温度不宜过高,温度过高,使脱硝的主要反应的平衡向逆方向移动,脱硝率降低,因此,本题正确答案是:正反应放热,温度过高会降低NO的转化率; ③当n(NH3)/n(NO) >1.0时,过量的氨气与氧气反应生成NO,所以烟气中NO浓度增大,因此,本题正确答案是:NH3和O2再次反应生成NO;
(3)由图可知,当3
6、< 在1.3×104 kPa下,CO的转化率已较高,再增大压强CO转化率提高不大,同时生产成本增加,得不偿失
解析:从图像来看,随着温度的升高,CO的转化率变小,故ΔH<0,综合温度、压强对CO转化率的影响来看,在1.3×104 kPa下,CO的转化率已经很大,不必再增大压强。
7、(1)1.5×10-4
(2)3∶1 NH3与NO的物质的量之比越大,NH3的量越多,促使平衡向正反应方向移动,NO的脱除率越大,再根据图像,可推得曲线b对应的NH3与NO的物质的量之比为3∶1
解析:从A点到B点的浓度变化为(0.75-0.55)×6×10-4 mg·m-3=1.2×10-4 mg·m-3,脱除速率为=1.5×10-4 mg·m-3·s-1;根据勒夏特列原理,NH3与NO的物质的量之比越大,NH3的量越多,促使平衡向正反应方向移动,NO的脱除率越大,再根据图像,可推得曲线b对应的NH3与NO的物质的量之比为3∶1。
8、2.0(与2.0接近的值均算正确,如2.1) 制取二甲醚的反应是放热反应,随着反应的进行,反应器内的温度必然升高,而温度升高,化学平衡向左移动,同时,温度不断升高,催化剂的活性将降低,均不利于二甲醚的合成
9、低于550 ℃时,温度越高反应速率越快,H2Se的产率越大;高于550 ℃时,反应达到平衡,该反应为放热反应,温度升高平衡逆向移动,H2Se的产率越小
10、①1 ②相同条件下,温度过高CO体积分数较高,温度过低反应速率较小
相同条件下,水醚比<3,CO体积分数过高,水醚比>6,H2含量过低
解析:①如图所示,相同温度下,水醚比为1时CO体积分数最高。②根据题干信息结合工业生产需要分析得,实际生产中选择反应温度为250 ℃的原因为相同条件下,温度过高CO体积分数较高,温度过低反应速率较小;选择水醚比为3~6的原因为相同条件下,水醚比<3,CO体积分数过高,水醚比>6,H2含量过低。
11、A 当氨碳比大于4.0时,增大氨气的量CO2转化率增加不大,但生产成本提高了;氨碳比太小,CO2转化率低
解析:控制变量,作垂直于横轴的一条直线交三条曲线于三点,转化率越高越好,所以选择A。选择最佳氨碳比,可看最上面曲线的走势,整体增加,曲线先陡后平(略上升),依然选择拐点,当氨碳比大于4.0时,增大氨气的量CO2转化率增加不大,但生产成本提高了;氨碳比太小,CO2转化率低。
12、(1)870 K(860~880 K范围内都可以)
13、400 K,1 MPa
14、2.0
解析:由题图可知当催化剂中n(Mn)/n(Cu)约为2.0时,CO的转化率最大,生成的二甲醚最多
15、C
解析:400~450 ℃二甲醚的转化率较高,再升高温度,增大成本,转化率提高有限,温度太低,反应速率太慢
16、T3
解析:要知道反应的温度,根据图像,只能求CO的转化率。
设反应Ⅰ开始时n(H2O)=a mol,平衡时转化的n(H2O)=x mol,反应Ⅱ平衡时转化的n(H2O)=y mol,则
C(s)+H2O(g)CO(g)+H2(g)
起始: a 0 0
变化: x x x
平衡: a-x x x
汽气比为0.8,得出=0.8,
CO(g)+H2O(g)CO2(g)+H2(g)
起始: x a-x 0 0
变化: y y y y
平衡: x-y a-x-y y y
因此有:=,解得=,即CO的转化率为50%,对应温度是T3。
17、(1)吸热 600 ℃ (2)c
解析:(1)由图可知升高温度,CO的物质的量增大,则升高温度平衡正向移动,为吸热反应,为减少副反应的发生,应在600 ℃以上进行。
(2)由图像可知加入C可以减少副反应,使硫酸钡完全转化生成BaS,且C生成CO,BaS为0.2 mol,CO为0.75 mol,根据原子守恒,则判断原料中至少为3.75。
18、6NO+3O2+2C2H43N2+4CO2+4H2O 350 ℃左右、负载率3.0%
解析:根据图1可以知道,在催化剂的作用下,C2H4与NO、O2反应最终生成N2、CO2、H2O,总反应的化学方程式为:6NO+3O2+2C2H43N2+4CO2+4H2O;由图可知,b曲线的最高点处,脱硝率高,负载率低,温度适宜,适宜条件为350 ℃左右、负载率3.0%。
05 常考题空5 平衡图像原因解释之选择反应最佳条件 (附答案解析)-备战高考化学大题逐空突破系列(全国通用): 这是一份05 常考题空5 平衡图像原因解释之选择反应最佳条件 (附答案解析)-备战高考化学大题逐空突破系列(全国通用),共9页。
突破11 化学平衡图像说理题(三)——图像中转化率、产率变化分析-备战2023年高考化学《反应原理综合大题》逐空突破系列: 这是一份突破11 化学平衡图像说理题(三)——图像中转化率、产率变化分析-备战2023年高考化学《反应原理综合大题》逐空突破系列,共11页。
突破09 化学平衡图像说理题(一)——温度、压强对平衡的影响-备战2023年高考化学《反应原理综合大题》逐空突破系列: 这是一份突破09 化学平衡图像说理题(一)——温度、压强对平衡的影响-备战2023年高考化学《反应原理综合大题》逐空突破系列,共14页。












