

- 突破05 催化剂、活化能与反应历程(1)-备战2023年高考化学《反应原理综合大题》逐空突破系列 试卷 1 次下载
- 突破07 催化剂、活化能与反应历程(3) 快慢反应-备战2023年高考化学《反应原理综合大题》逐空突破系列 试卷 1 次下载
- 突破09 化学平衡图像说理题(一)——温度、压强对平衡的影响-备战2023年高考化学《反应原理综合大题》逐空突破系列 试卷 1 次下载
- 突破10 化学平衡图像说理题(二)——选择反应最佳条件-备战2023年高考化学《反应原理综合大题》逐空突破系列 试卷 1 次下载
- 突破11 化学平衡图像说理题(三)——图像中转化率、产率变化分析-备战2023年高考化学《反应原理综合大题》逐空突破系列 试卷 2 次下载
突破08 催化剂、活化能与反应历程(4)——循环反应-备战2023年高考化学《反应原理综合大题》逐空突破系列
展开催化剂、活化能与反应历程(4)
——循环反应
1、[2014·全国卷Ⅰ]我国科研人员提出了由CO2和CH4转化为高附加值产品CH3COOH的催化反应历程。该历程示意图如下。下列说法不正确的是( )
A.生成CH3COOH总反应的原子利用率为100% B.CH4→CH3COOH过程中,有C—H键发生断裂
C.①→②放出能量并形成了C—C键 D.该催化剂可有效提高反应物的平衡转化率
2、甲烷直接氧化制甲醇是富有挑战性的课题,Sen等在CF3COOH水溶液中成功将甲烷转化为CF3COOCH3(水解生成CH3OH),其反应机理如图所示,下列说法正确的是( )
A.上述反应的总反应式为CH4+CF3COOH+O2→CF3COOCH3
B.CF3COOCH3水解生成CH3OH的反应式为CF3COOCH3+H2O→CF3COOH+CH3OH
C.Pd2+是该反应的中间产物
D.每生成1molCH3OH,消耗标准状况下O2的体积为22.4L
3、碱式氯化铜[CuaClb(OH)c·xH2O]是一种重要的无机杀虫剂,它可以通过以下步骤制备。步骤1:将铜粉加入稀盐酸中,并持续通空气反应生成CuCl2。已知Fe3+对该反应有催化作用,其催化原理如下图所示。步骤2:在制得的CuCl2溶液中,加入石灰乳充分反应后即可制备碱式氯化铜。下列有关说法正确的是( )
A.a、b、c 之间的关系式为:a=b+c
B.图中M、N分别为Fe2+、Fe3+
C.步骤1充分反应后,加入少量CuO是为了除去Fe3+
D.若制备1 mol的CuCl2,理论上消耗11.2 LO2
4、据报道,中科院大连化学物理研究所的研究团队利用多功能催化剂首次实现了CO2直接加氢制汽油的过程。其转化过程如图所示。下列说法正确的是( )
A. 反应①的产物中含有水
B. 反应②为化合反应
C. 所制得汽油的主要成分是烃和烃的含氧衍生物
D. 这种人造汽油用作汽车的燃料时,汽车尾气中不含氮氧化物
5、我国在CO2催化加氢制取汽油方 面取得突破性进展,CO2转化过程示意图如下,下列说法不正确的是( )
A.反应①的产物中含有水 B.反应②中只有碳碳键形成
C.汽油主要是C5~C11的烃类混合物 D.图中a的名称是2-甲基丁烷
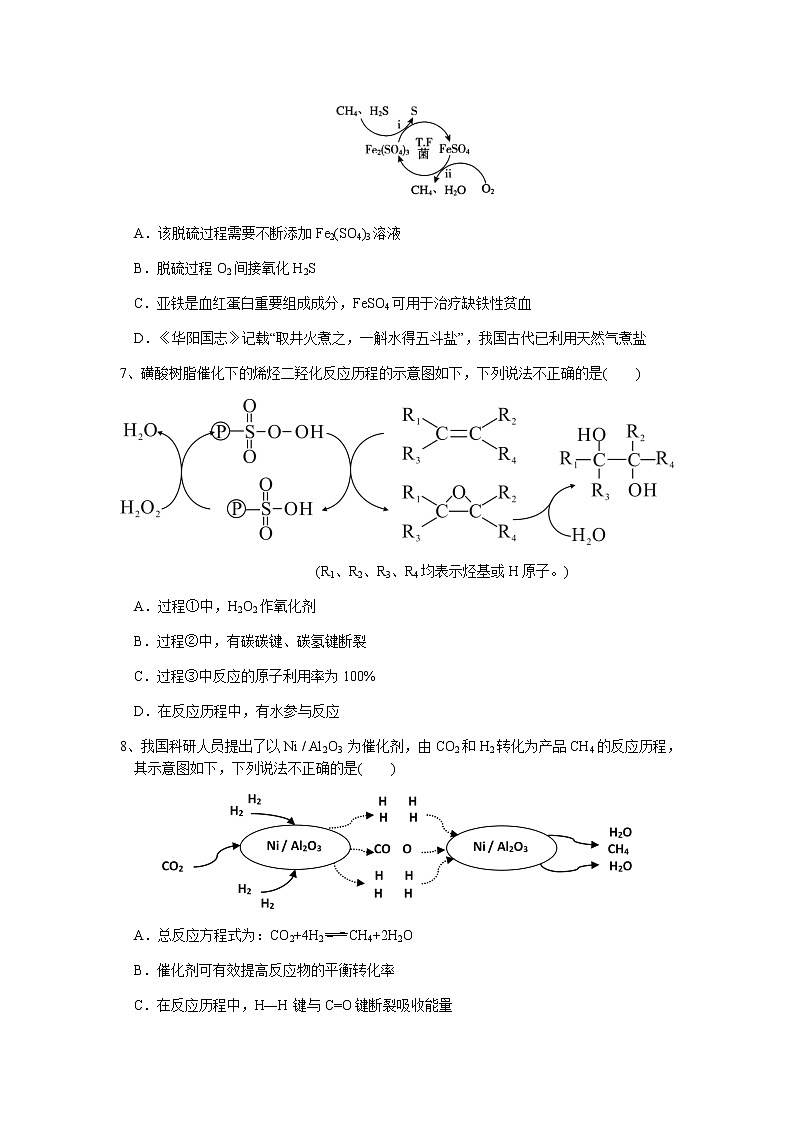
6、天然气因含有少量H2S等气体开采应用受限。T.F菌在酸性溶液中可实现天然气的催化脱硫,其原理如图所示。下列说法不正确的是( )
A.该脱硫过程需要不断添加Fe2(SO4)3溶液
B.脱硫过程O2间接氧化H2S
C.亚铁是血红蛋白重要组成成分,FeSO4可用于治疗缺铁性贫血
D.《华阳国志》记载“取井火煮之,一斛水得五斗盐”,我国古代已利用天然气煮盐
7、磺酸树脂催化下的烯烃二羟化反应历程的示意图如下,下列说法不正确的是( )
(R1、R2、R3、R4均表示烃基或H原子。)
A.过程①中,H2O2作氧化剂
B.过程②中,有碳碳键、碳氢键断裂
C.过程③中反应的原子利用率为100%
D.在反应历程中,有水参与反应
8、我国科研人员提出了以Ni / Al2O3 为催化剂,由CO2和H2转化为产品CH4的反应历程,其示意图如下,下列说法不正确的是( )
A.总反应方程式为:CO2+4H2CH4+2H2O
B.催化剂可有效提高反应物的平衡转化率
C.在反应历程中,H―H键与C=O键断裂吸收能量
D.反应过程中,催化剂参与反应,改变反应路径,降低反应的活化能
9、我国科研人员研究了在Cu-ZnO-ZrO2催化剂上CO2加氢制甲醇过程中水的作用机理,其主反应历程如图所示(H2→*H+* H)。下列说法错误的是( )
A.向该反应体系中加入少量的水能增加甲醇的收率
B.带*标记的物质是该反应历程中的中间产物
C.二氧化碳加氢制甲醇的过程中原子利用率达100%
D.第③步的反应式为*H3CO+ H2O→CH3OH+*HO
10、利用某分子筛作催化剂,NH3可脱除废气中的NO和NO2,生成两种无毒物质,其反应历程如下图所示,下列说法正确的是( )
A.X是N2 B.汽车尾气中含有的氮氧化合物是由于汽油燃烧产生的
C.NH4+中含有非极性共价键 D.上述历程的总反应为:2NH3+NO +NO22N2+3H2O
11、研究表明N2O与CO在Fe+作用下发生反应的能量变化及反应历程如图所示,下列说法错误的是( )
A.总反应是放热反应 B.Fe+使反应的活化能降低
C.FeO+也是该反应的催化剂 D.Fe++N2O→FeO++N2、FeO++CO→Fe++CO2两步反应均为放热反应
12、CO2和CH4催化重整可制备合成气,对减缓燃料危机具有重要的意义,其反应历程示意图如下,下列说法不正确的是( )
A.合成气的主要成分为CO和H2 B.①→②既有碳氧键的断裂,又有碳氧键的形成
C.①→②吸收能量 D.Ni在该反应中做催化剂
13、已知烯烃和H2O2在磺酸树脂()作用下可以生成二元醇,其反应历程的示意图如下(R1、R2、R3、R4均表示烃基或H原子。下列说法错误的是( )
A.整个过程的总反应为H2O2+ B.是该反应的催化剂
C.操作时温度不能过高或过低 D.过程③中反应的原子利用率为100%
14、联氨(N2H4)可用于处理锅炉水中的溶解氧,防止锅炉被腐蚀,其中一种反应机理如图所示。下列叙述错误的是( )
A.①转化中是还原剂
B.③中发生反应后溶液的pH减少
C.1mol N2H4可处理水中1 mol O2
D.工业上也可使用Na2SO3处理锅炉水中的溶解氧
15、以下是镍催化乙烯与氢气的反应机理示意图,下列说法不正确的是( )
A.乙烯与氢气发生加成反应 B.过程②吸收能量,过程③、④释放能量
C.催化剂可改变反应的焓变 D.反应中有非极性键断裂、极性键形成
16、电催化N2还原制NH3的一种反应机理如图所示,其中吸附在催化剂表面的物种用*表示,下列说法不正确的是( )
A.N2生成NH3是通过多步还原反应实现的
B.两个氮原子上的加氢过程同时进行
C.析氢反应(H*+H*→H2)会影响NH3的生成
D.NH3的及时脱附有利于增加催化剂活性位
17、我国科学家在绿色化学领域取得新进展。利用双催化剂Cu和Cu2O,在水溶液中用H将CO2高效还原为重要工业原料之一的甲醇,其反应机理如图所示。则下列有关说法不正确的是( )
A.CO2生成甲醇是通过多步氧化反应实现的 B.该催化反应过程中涉及了化学键的形成及断裂
C.有可能通过调节控制反应条件获得甲醛等有机物 D.催化剂Cu结合氢原子,催化剂Cu2O结合含碳微粒
18、2007年诺贝尔化学奖授予埃特尔以表彰其对于合成氨反应机理的研究,氮气和氢气分子在催化剂表面的部分变化过程如图所示,下列说法不正确的是( )
N2(g)+3H2(g)2NH3(g) △H = −92 kJ/mol
A.升高温度不能提高一段时间内NH3的产率 B.图①→②过程吸热,图②→③过程放热
C.N2在反应过程中三键均发生断裂 D.反应过程中存在−NH−、−NH2等中间产物
19、我国科研人员使用催化剂CoGa3实现了H2还原肉桂醛生成肉桂醇,反应机理的示意图如下,下列说法不正确的是( )
A.肉桂醛分子中不存在顺反异构现象 B.苯丙醛分子中有6种不同化学环境的氢原子
C.还原反应过程发生了极性键和非极性键的断裂 D.该催化剂实现了选择性还原肉桂醛中的醛基
20、1894年,Fenton发现采用Fe2+和H2O2混合溶液,能产生具有高反应活性和强氧化性的羟基自由基(-OH),从而氧化降解有机污染物,称为Fenton反应。电Fenton法采用惰性电极电解法,下图为其中一个电极的反应机理,其中含有Fenton 反应。下列说法不正确的是( )
A.羟基自由基(-OH) 的电子式为:
B.右图所在的惰性电极应与外接电源的负极相连
C.Fenton反应: Fe2++H2O2==Fe3++OH-+-OH
D.右图所在的惰性电极每消耗22.4LO2 (标准状况),理论上在外电电路中转移4mole-
21、(多选)《环境科学》刊发了我国采用零价铁活化过硫酸钠(Na2S2O8,其中S为+6价)去除废水中的+5价砷[As(V)]的科研成果,反应机理如图。设NA为阿伏加德罗常数的值,Ksp[Fe(OH)3]=2.7×10-39。下列叙述正确的是( )
A.1mol过硫酸钠(Na2S2O8)含2NA个过氧键
B.若56gFe参加反应,共有1.5NA个S2O82-被还原
C.碱性条件下,硫酸根自由基发生反应的方程式为:SO4-·+ OH- =SO42- +·OH
D.室温下,pH越大,越有利于去除废水中的+5价砷,溶液中c(Fe3+)为2.7×10-27mol·L-1
22、2007年诺贝尔化学奖授予德国化学家Gerhard Ertl,以表彰他在表面化学领域研究
所取得的开拓性成就。某反应在Pd/Al2O3/Ba催化剂表面吸附与解吸作用的机理如下图所示(图中HC表示碳氢化合物,nitrate指硝酸盐),该机理研究是指( )
A.汽车尾气催化转化机理 B.钢铁生锈机理
C.合成氨工业催化氧化机理 D.氢氧燃烧电池电极反应机理
23、中国科学家在合成氨(N2+3H22NH3△H<0)反应机理研究中取得新进展,首次报道了LiH-3d过渡金属这一复合催化剂体系,并提出了“氮转移”催化机理。如图所示,下列说法不正确的是( )
A.转化过程中有非极性键断裂与形成
B.复合催化剂降低了反应的活化能
C.复合催化剂能降低合成氨反应的焓变
D.低温下合成氨,能提高原料转化率
【催化剂、活化能与反应历程(4)——循环反应】答案
1、D。解析:催化剂不能使平衡发生移动,故不能提高反应物的平衡转化率,D错;CH4+CO2―→CH3COOH,反应的原子利用率为100%,A对;由题图可知,CH4→CH3COOH有C—H键发生断裂,B对;反应物总能量高于生成物总能量,反应放出能量,①→②形成了C—C键,C对。
2、B。解析:A项,根据①②③④加和可得上述反应的总反应式为CH4+CF3COOH+1/2O2→CF3COOCH3+H2O,故A错误。B项,CF3COOCH3发生水解反应的产物为CF3COOH和CH3OH,故生成CH3OH的反应式为CF3COOCH3+H2O→CF3COOH+CH3OH,故B正确;C项,反应①中Pd2+参与反应,反应②中又生成等物质的量的Pd2+,故Pd2+为催化剂不是中间产物,故C错误;D项,根据反应CH4+CF3COOH+1/2O2→CF3COOCH3+H2O、CF3COOCH3+H2O→CF3COOH+CH3OH可得制甲醇的反应方程式为CH4+1/2O2→CH3OH,故每生成1molCH3OH,消耗标准状况下O2的体积为11.2L,故D错误。故选B。
3、C。【解析】A项,根据化合物中正负化合价的代数和等于0,可知:2a=b+c,A错误;B项,根据题干叙述可知反应方程式2Cu+O2+4HCl=2CuCl2+2H2O,可知M是O2,N是H2O,B错误;C项,Fe3+水解使溶液显酸性,CuO与H+反应产生Cu2+和水,当溶液的pH增大到一定程度,Fe3+形成Fe(OH)3程度而除去,从而达到除去Fe3+的目的,C正确;D项,制备1 mol的CuCl2,转移2mol电子,根据电子守恒,需要消耗0.5molO2,由于不清楚氧气所处的条件,所以不能确定气体的体积,D错误;故选C。
4、A。解析:A项,根据质量守恒定律可以判断反应①的产物中含有水,A正确;B项,反应物CO含有氧元素,而生成物(CH2)n不含有氧元素,所以反应②不可能为化合反应,B错误;C项,所制得汽油的主要成分是烃,C错误;D项,在燃烧产生的高温条件下,N2+O2=2NO,所以这种人造汽油用作汽车的燃料时与其它燃料一样,汽车尾气中都含有氮氧化物,D错误。
5、B。解析:A项,通过图示可以得到反应①为,根据原子守恒,得到反应①为,所以正确,不符合题意;B项,反应②生成的中含有碳氢键和碳碳键,所以错误,符合题意;C项,汽油中各物质均只含C、H两种元素,因此属于烃类,且为的烃类混合物,所以正确,不符合题意;D项,观察可以发现图中a的结构简式为,其名称为2-甲基丁烷,所以正确,不符合题意。
6、A。解析:A.T.F菌在酸性溶液中可实现天然气的催化脱硫,Fe2(SO4)3氧化硫化氢,自身被还原成硫酸亚铁(相应反应为2Fe3++H2S=2Fe2++S↓+2H+),硫酸亚铁被氧气氧化成硫酸铁(相应反应为4Fe2++O2+4H+=4Fe3++2H2O),根据反应可知,该脱硫过程不需要不断添加Fe2(SO4)3溶液,A错误;B.脱硫过程:Fe2(SO4)3氧化硫化氢,自身被还原成硫酸亚铁,硫酸亚铁被氧气氧化成硫酸铁,脱硫过程O2间接氧化H2S,B正确;C.亚铁是血红蛋白的重要组成成分,起着向人体组织传送O2的作用,若缺铁就可能出现缺铁性贫血,FeSO4可用于治疗缺铁性贫血,C正确;D.天然气主要成分为甲烷,甲烷燃烧放出热量,《华阳国志》记载“取井火煮之,一斛水得五斗盐”,我国古代已利用天然气煮盐,D正确;故合理选项是A。
7、B。解析:A.过程①中H2O2中的氧元素由-1价降低到-2价得电子发生还原反应生成H2O,H2O2作氧化剂,故A正确;B.过程②中 和生成和,断裂的是中的碳碳键和中的硫氧键、氧氧键,故B错误;C.过程③中只生成了 ,没有其他物质生成,原子利用率为100%,故C正确;D.过程③中有水参与反应,故D正确。答案选B。
8、B。解析:A.由图可知CO2和H2转化为产品CH4,还生成水,则总反应方程式为CO2+4H2⇌CH4+2H2O,A正确;B.催化剂对平衡移动无影响,则使用催化剂时转化率不变,B错误;C.化学变化中有化学键的断裂和生成,则反应历程中,H-H键与C=O键断裂吸收能量,C正确;D.催化剂改变反应的途径、降低反应的活化能,则该过程中催化剂参与反应,改变反应路径,降低反应的活化能,D正确;故合理选项是B。
9、C。解析:A. 反应历程第③步需要水,所以向该反应体系中加入少量的水能增加甲醇的收率,故A正确;
B. 根据图知,带*标记的物质在反应过程中最终被消耗,所以带*标记的物质是该反应历程中的中间产物,故B正确;C. 根据图知,二氧化碳和氢气反应生成甲醇和水,该反应中除了生成甲醇外还生成水,所以二氧化碳加氢制甲醇的过程中原子利用率不是100%,故C错误;D. 第③步中•H3CO、H2O生成CH3OH和•HO,反应方程式为•H3CO+H2O→CH3OH+•HO,故D正确;故答案为C。
10、D。解析:A.图示反应可以生成X的反应为[(NH4)2(NO2)]2++NO=[(NH4)(HNO2)]++X+H+,原子守恒判断X为N2和H2O,故A错误;B.汽油是碳氢化合物的混合物,而汽车尾气中含有的氮氧化合物是由空气中的N2氧化产生的,故B错误;C.NH4+中含有四个N-H极性共价键,而不是非极性键,故C错误;D.由反应历程图可知,氨气、二氧化氮和一氧化氮是反应物,氮气与水是生成物,所以总反应为:2NH3+NO+NO22N2+3H2O,故D正确;故答案为D。
11、C。解析:【分析】A.由图可知,反应物总能量大于生成物总能量;B.Fe+作催化剂;C. FeO+是反应过程的中间产物;D.由图可知,Fe++N2O→FeO++N2、FeO++CO→Fe++CO2两步中均为反应物总能量大于生成物总能量。
【详解】A.由图可知,反应物总能量大于生成物总能量,为放热反应,A正确;B.Fe+在反应前后的质量和性质保持不变,故其作催化剂,使反应的活化能减小,B正确;C.催化剂是加入的物质,可以改变反应速率,但其质量和化学性质不变,而FeO+是反应过程的中间产物,因此不是催化剂,C错误;D.由图可知,Fe++N2O→FeO++N2、FeO++CO→Fe++CO2两步中均为反应物总能量大于生成物总能量,因此二者均为放热反应,D正确;故合理选项是C。
12、C。解析:A.由图示可知CO2和CH4在Ni催化作用下,最终生成CO和H2,故A正确;B.化学反应的过程中存在构成反应物的键的断裂和生成物中键的形成,由图示可知①→②过程中既有碳氧键的断裂,又有碳氧键的形成,故B正确;C.①的能量总和大于②的能量总和,则①→②的过程放出能量,故C错误;D.由图示可知CO2和CH4催化重整生成CO和H2的过程中Ni的质量和化学性质没有发生变化,则Ni为催化剂,故D正确;故答案为C。
13、B。解析:A.从反应的起始和终止可以看出,整个过程的总反应为H2O2+,选项A正确;B.才是该反应的催化剂,是该反应中的中间产物,最后又转为,选项B错误;C.温度过高H2O2分解,温度过低反应速率慢,选项C正确;D.过程③中产物为一种,没有其它物质生成,原料分子中的原子全部转化成所需要的产物,原子利用率为100%,选项D正确;答案选B。
14、B。解析:【详解】A.转化中变成,N的价态升高,是还原剂,A正确;B.中发生反应的离子方程式为4Cu(NH3)2++O2+2H2O+8NH3=4Cu(NH3)42++4OH-,所以溶液的增大,B错误;C.根据反应的机理可知本质上可看成氧气氧化了,根据化合价升降数值相等可知可处理水中,C正确;
D.2Na2SO3+O2=2Na2SO4,Na2SO3成本低,所以工业上也可使用Na2SO3处理锅炉水中的溶解氧,D正确;
故选B。
15、C。解析:A.乙烯分子中含碳碳双键,与氢气发生的反应为加成反应,故A正确;B.过程②是H-H断裂吸收能量,过程③、④是形成C-H键释放能量,故B正确;C.催化剂通过改变反应活化能改变反应的化学反应速率,但不改变化学平衡、不改变反应焓变,故C错误;D.从反应过程中可知断裂的H-H键为非极性键,形成的C-H键为极性键,反应中有非极性键断裂、极性键形成,故D正确;答案为C。
16、B。解析:A、由图可知,N2生成NH3是通过N2→*N2→*NNH……NH3多步还原反应实现的,故A不符合题意;B、由图可知,加氢过程是分步进行的(*N2→*NNH→*NHNH),故B符合题意;C、析氢反应(H*+H*→H2)会导致NH3中H不足,从而影响NH3的生成,故C不符合题意;D、NH3的及时脱附,能够增加催化剂与反应物的接触面积,即有利于增加催化剂活性位,故D不符合题意;故答案为B。
17、A。解析:A. CO2生成COOH,为还原反应;CO生成CHO,为还原反应;CHO生成CH2O,为还原反应;CH2O生成CH3O,为还原反应;CH3O生成CH3OH,为还原反应,所以CO2生成甲醇是通过多步还原反应实现,A错误;B. 该催化过程发生化学反应,所以该反应中有化学键的形成和断裂,B正确;C. CHO和H生成CH2O,需要Cu2O作催化剂,可以调节控制反应条件获得甲醛等有机物,C正确;D. 根据图知,催化剂Cu结合H原子,催化剂Cu2O结合含CHO微粒,催化剂Cu结合氢原子,催化剂Cu2O结合含碳微粒,D正确;答案为A。
18、A。解析:由图可知:在催化剂表面,氮气断开三键,并逐一与氢形成N一H键,最终形成氨气。A项、升高温度能提高反应速率,所以在达到平衡前升高温度能提高一段时间内氨气的产率,A选项错误;B项、图①→②是N≡N断裂过程,断键吸热;图②→③是N一H键形成过程,成键放热B选项正确;C项、虽然本反应是可逆反应,但反应中,所有氮气均能断开三键,只是同时又有新的氮氮三键形成,因此体系中总含有氮气,C选项正确;D项、从图中可知,断键产生的氮原子,能逐一和氢结合形成-NH-、-NH2和NH3,D选项正确;
19、A。解析:A. 肉桂醛()分子中碳碳双键两端分别连接2个不同的基团,存在顺反异构现象,故A错误;B. 苯丙醛()分子中有6种不同化学环境的氢原子,如图示:,故B正确;C. 根据图示,还原反应过程中肉桂醛与氢气反应转化成了肉桂醇,分别断开了H-H键和C=O键,发生了极性键和非极性键的断裂,故C正确;D. 根据图示,还原反应过程中肉桂醛转化成了苯丙醛和肉桂醇,而没有转化为苯丙醛,体现了该催化剂选择性的还原肉桂醛中的醛基,故D正确;
答案选A。
20、D。解析:羟基自由基(-OH) 的电子式为:,A正确;右图所在的惰性电极为电解池的阴极,发生还原反应,在充电时,必须与外接电源的负极相连,B正确;Fe2+被H2O2氧化为铁离子,同时产生羟基自由基(-OH),Fenton反应: Fe2++H2O2==Fe3++OH-+-OH,C正确;根据图示可知:22.4LO2 即为1molO2,1molO2转化为H2O2时转移电子数为2mole-,理论上在外电电路中转移2mole-,D错误;正确选项D。
21、BC。解析:A. 过硫酸钠(Na2S2O8)中S为+6价,Na为+1价,假设含有x个O2−,含有y个O22−,则x + 2y = 8,(+1) ×2+ (+6) ×2 + ( −2)×x+( −2)×y =0,则x =6,y=1,因此1mol过硫酸钠(Na2S2O8)含NA个过氧键,故A错误;B. 若56gFe参加反应即1mol,1mol Fe先和S2O82−变为1mol Fe2+,根据A选项的1mol过硫酸钠(Na2S2O8)含1mol过氧键,再根据得失电子守恒消耗1mol S2O82−,接着是1molFe2+与S2O82−反应生成1molFe3+,根据得失电子守恒消耗0.5mol S2O82−,因此总共消耗1.5mol S2O82−,即共有1.5NA个S2O82−被还原,故B正确;C. 碱性条件下,根据反应机理,硫酸根自由基发生反应的方程式为:SO4-·+ OH-=SO42− +·OH,故C正确;D. 室温下,pH越大,亚铁和铁离子变为氢氧化亚铁和氢氧化铁,越有利于去除废水中的+5价砷,Fe(OH)3溶于水存在沉淀溶解平衡:Fe(OH)3(s) Fe3+ (aq) + 3OH-(aq),此溶液碱性极弱,pH接近7,即c(OH-) = 1×10−7mol·L−1,因为,则 ,故D错误。综上所述,答案为BC。
22、A。解析:试题分析:A、从机理图上分析,气体的吸附和解吸可知,氮氧化物,一氧化碳等污染气体在催化剂表面转化为无毒气体二氧化碳和氮气,属于汽车尾气的催化转化机理,正确,选A。B、钢铁生锈机理是原电池的反应被做伏击被水膜中的氧气氧化,发生吸氧腐蚀,错误,不选B;C、工业合成氨是高温高压催化剂作用下氮气和氢气在催化剂表面反应生成氨气,错误,不选C;D、氢氧燃料电池是氢气和氧气发生的氧化还原反应,是原电池反应,错误,不选D。
23、C。解析:A. 合成氨为可逆反应,氮气和氢气在反应过程中有消耗和生成,故转化过程中有非极性键断裂与形成,A项正确;B. 催化剂能降低反应的活化能,加快反应速率,B项正确;C. 催化剂不能改变反应的焓变,焓变只与反应物和生成物总能量的相对大小有关系,C项错误;D. 合成氨的正反应为放热反应,降低温度,平衡向正向移动,能提高原料转化率,D项正确;答案选C。
01 化学反应原理综合题型集训之催化剂、活化能与反应历程(附答案解析)-备战高考化学大题逐空突破系列(全国通用): 这是一份01 化学反应原理综合题型集训之催化剂、活化能与反应历程(附答案解析)-备战高考化学大题逐空突破系列(全国通用),共16页。试卷主要包含了三甲胺[N3]是重要的化工原料等内容,欢迎下载使用。
突破06 催化剂、活化能与反应历程(2) 过渡态-备战2023年高考化学《反应原理综合大题》逐空突破系列: 这是一份突破06 催化剂、活化能与反应历程(2) 过渡态-备战2023年高考化学《反应原理综合大题》逐空突破系列,共12页。
突破07 催化剂、活化能与反应历程(3) 快慢反应-备战2023年高考化学《反应原理综合大题》逐空突破系列: 这是一份突破07 催化剂、活化能与反应历程(3) 快慢反应-备战2023年高考化学《反应原理综合大题》逐空突破系列,共8页。












