






2023届高三化学高考备考二轮复习专题突破:陌生方程式的书写课件
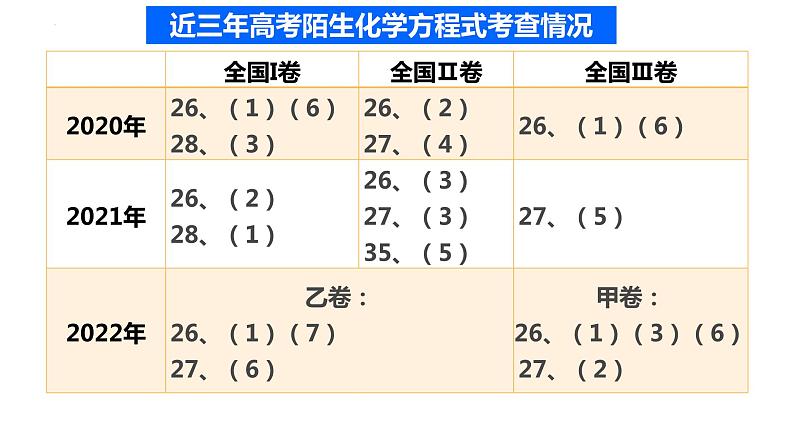
展开近三年高考陌生化学方程式考查情况
高考题中考察方程式的题目
1、选择题中:有关NA计算的题,转移电子数与方程式中某物质的量的关系(大多为熟知的方程式);电化学题。
2、化学实验题中:物质的制备、除杂、性质、尾气的处理等相关的方程式。
3、工艺流程题中:原料的预处理、除杂、净化、产品的分离提纯、排放物的无害化处理等环节中的方程式,以及产率、纯度计算的相关方程式。
4、化学反应原理题中:热化学方程式;电化学题中电极方程式及涉及计算相关的方程式。
高考题中考察方程式的类型
1、化学反应方程式2、化学反应离子方程式3、电极反应方程式4、热化学方程式 氧化还原型PK非氧化还原型
题型一:氧化还原类方程式的书写
一、书写信息型氧化还原反应的步骤(4步法):第1步:根据题干信息或流程图,判断氧化剂、还原剂、氧化产物、还原产物第2步:按“氧化剂+还原剂-还原产物+氧化产物”写出方程式, 根据得失电子守恒配平氧化剂、还原剂、还原产物、氧化产物的化学计量数,得失电子数=变价原子个数×(高价-低价)。第3步:根据电荷守恒和溶液的酸碱性,在反应方程式的一端添加H+或OH-使方程式的两端的电荷守恒。第4步:根据原子守恒,在反应方程式一端添加H2O(或其他小分子)使方程式两端的原子守恒。
例1:KMnO4能与热的硫酸酸化的Na2C2O4溶液反应,生成CO2,该反应的离子方程式是____。
例2:碱性环境下,Cl2可将水中的CN-转化为两种无毒的气体,写出离子方程式 。
2MnO4-+5C2O42-+16H+ 2Mn2++10CO2↑+8H2O
2CN-+8OH-+5Cl2=2CO2+N2+10Cl-+4H2O
常见氧化剂、还原剂及对应的产物
【高考实例】1、【2022·全国甲卷】硫酸锌(ZnSO4)是制备各种含锌材料的原料,在防腐、电镀、医学上有诸多应用。硫酸锌可由菱锌矿制备。菱锌矿的主要成分为ZnCO3,杂质为SiO2以及Ca、Mg、Fe、Cu等的化合物。其制备流程如下:
向80~90℃的滤液①中分批加入适量KMnO4溶液充分反应后过滤,滤渣②中有MnO2,该步反应的离子方程式为。
3Fe2+ + MnO4-+ 7H2O==3Fe(OH)3↓+ MnO2↓+ 5H+
【高考实例】2、【2021·全国甲卷】以NaIO3为原料制备I2的方法是:先向NaIO3溶液中加入计量的NaHSO3,生成碘化物;再向混合溶液中加入NaIO3溶液,反应得到I2 ,上述制备 的离子方程式为:
2IO3-+ 5HSO3-==I2 + 5SO42-+ H2O + 3H+
【高考实例】3、【2022·年全国乙卷】废旧铅蓄电池的铅膏中主要含有PbSO4 、PbO2、PbO、和Pb。还有少量Ba、Fe、Al的盐或氧化物等。为了保护环境、充分利用铅资源,通过下图流程实现铅的回收。
(3)在“酸浸”中,除加入醋酸(HAc),还要加入H2O2。(ⅰ)能被H2O2氧化的离子是________;(ⅱ)H2O2促进了金属Pb在醋酸中转化为Pb(Ac)2,其化学方程式为________;(ⅲ)H2O2也能使PbO2转化为Pb(Ac)2,H2O2的作用是________。
Pb+H2O2+2HAc=Pb(Ac)2+2H2O
【考点演练】1.NaClO2是一种重要的杀菌消毒剂,也常用来漂白织物等,其一种生产工艺如下:
写出“反应”步骤中生成ClO2的化学方程式: 。
2NaClO3+H2SO4+SO2===2ClO2+2NaHSO4
【考点演练】2.以废旧铅酸电池中的含铅废料(Pb、PbO、PbO2、PbSO4及炭黑等)和H2SO4为原料,制备高纯PbO,实现铅的再生利用。其工作流程如下:
过程Ⅰ中,Fe2+催化过程可表示为:i:2Fe2++ PbO2+4H++SO42−=2Fe3++PbSO4+2H2O ii: ……① 写出ii的离子方程式:________________。
2Fe3++Pb+SO42—==PbSO4+2Fe2+
【考点演练】3.某化学兴趣小组通过查阅文献,设计了从某厂阳极泥(成分为Cu、Ag2Se、Au、Pt)中回收贵重金属的工艺,其流程如图所示。回答下列问题:
① 写出“焙烧”时,生成SeO2的化学反应方程式 ②“酸溶”时Pt、Au分别转化为[PtCl6]2-和[AuCl4]-,写出Au溶解的离子方程式:。
2Ag2Se + 3O2 ==2SeO2 + 2Ag2O
2Au + 3Cl2 + 2Cl-==2[AuCl4]-
【考点演练】4.亚氯酸钠(NaClO2)是一种重要的杀菌消毒剂,也常用来漂白织物等。以下是生NaClO2·3H2O粗产品的工艺流程图:
(1)反应①发生反应的化学方程式是 。(2)反应③发生反应的化学方程式是 。
2NaClO3+SO2=Na2SO4+2ClO2
2ClO2 + H2O2 + 2NaOH == 2NaClO2 + 2H2O + O2
题型二:非氧化还原类方程式的书写
“读”取题目中的有效信息(证据),写出反应物和生成物的符号(推理+表征),再依据质量守恒、电荷守恒(基本规律),即可轻松写出规范的方程式。
【高考实例】1、【2022·山东卷】工业上以氟磷灰石[Ca5F(PO4)3,含SiO2等杂质]为原料生产磷酸和石膏,工艺流程如下:
酸解时有HF产生。氢氟酸与SiO2反应生成二元强酸H2SiF6,离子方程式为:。
6HF + SiO2==2H+ + SiF62-+ 2H2O
【高考实例】2、(2021·全国乙卷)磁选后的炼铁高钛炉渣,主要成分有TiO2 、SiO2 、Al2O3 、MgO 、CaO 以及少量的Fe2O3 。为节约和充分利用资源,通过如下工艺流程回收钛、铝、镁等。(1)“焙烧”中,TiO2、SiO2 几乎不发生反应,Al2O3 、MgO、 CaO、Fe2O3转化为相应的硫酸盐,写出Al2O3转化NH4Al(SO4)2为化学方程式__________________________________________________________。
Al2O3 + 4(NH4)2SO4==2NH4Al(SO4)2 + 6NH3↑+ 3H2O
【高考实例】2、【2021·全国乙卷】磁选后的炼铁高钛炉渣,主要成分有TiO2 、SiO2 、Al2O3 、MgO 、CaO 以及少量的Fe2O3 。为节约和充分利用资源,通过如下工艺流程回收钛、铝、镁等。(5) “酸溶”后,将溶液适当稀释并加热,TiO2+ 水解析出沉淀,该反应的离子方程式是_______________________________________________。
TiO2+ +(x+1)H2O ⇌ TiO2·xH2O↓+2H+
【考点演练】1、CdS又称镉黄,可用作黄色颜料,也用于制备荧光粉等。以镉铁矿(成分为CdO2、Fe2O3、FeO及少量的Al2O3和SiO2)为原料制备CdS的工艺流程如图,回答下列问题:
①“还原镉”时,产生能使澄清石灰水变浑浊的气体,发生反应的离子方程式为。② 通入H2S也可以“沉镉”,发生反应的离子方程式为。③ CdS不溶于稀盐酸,可溶于浓盐酸,并生成H2[CdCl4],反应的化学方程式为:。
① 3Cd4+ + CH3OH + H2O==3Cd2+ + CO2↑+ 6H+
Cd2++H2S===CdS↓+ 2H+
CdS + 4HCl(浓)==H2[CdCl4] + H2S↑
2024届高三化学 一轮复习 陌生方程式书写 《非氧化还原方程式》书写课件: 这是一份2024届高三化学 一轮复习 陌生方程式书写 《非氧化还原方程式》书写课件,共3页。PPT课件主要包含了盐的水解,环节一等内容,欢迎下载使用。
2024届高三化学第二轮复习: 陌生方程式的书写课件: 这是一份2024届高三化学第二轮复习: 陌生方程式的书写课件,共27页。PPT课件主要包含了高考考查题型及知识点,考察题型以及知识点,主要考查类型,基本解题思路等内容,欢迎下载使用。
新高考版高考化学二轮复习(新高考版) 第1部分 专题突破 专题5 题型专攻1 “陌生情景下”方程式的书写课件PPT: 这是一份新高考版高考化学二轮复习(新高考版) 第1部分 专题突破 专题5 题型专攻1 “陌生情景下”方程式的书写课件PPT,共30页。PPT课件主要包含了高考化学二轮复习策略,专题5,高考必备,书写方法,真题演练,CO2+8H2O,Na2CO3,考向预测,+2H2O,S↓+2H+等内容,欢迎下载使用。












