





2024届高三化学高考备考一轮复习:滴定曲线和中和滴定的拓展应用课件
展开1.理解滴定曲线的含义及各点的粒子浓度大小分析。 2.了解中和滴定的拓展应用——氧化还原滴定、沉淀滴定等。
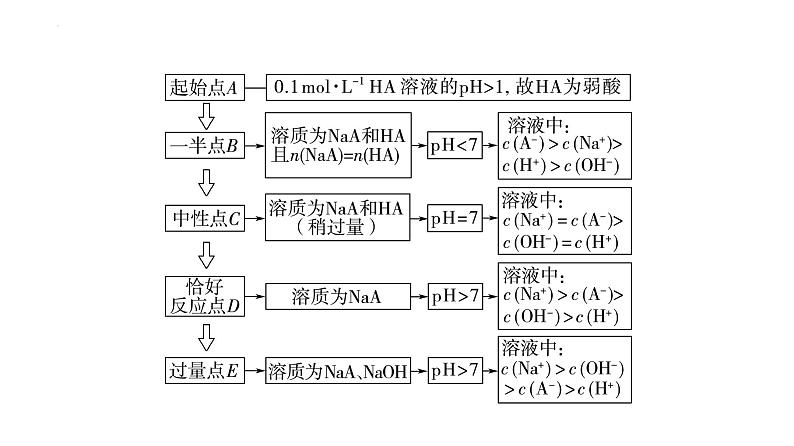
1.中和滴定曲线“5点”分析法
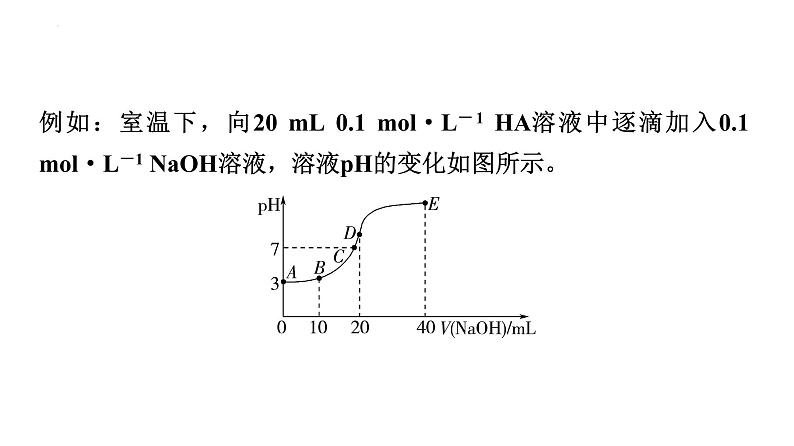
例如:室温下,向20 mL 0.1 ml·L-1 HA溶液中逐滴加入0.1 ml·L-1 NaOH溶液,溶液pH的变化如图所示。
2.沉淀滴定曲线分析某温度下,向10 mL 0.01 ml·L-1 PbCl2溶液中滴加0.01 ml·L-1的Na2S溶液,滴加过程中-lg c(Pb2+)与Na2S溶液体积的关系如图所示。
中和滴定曲线分析1. (2022·广州模拟)常温下,向20.00 mL 0.100 ml·L-1的Na2CO3溶液中逐滴滴加0.100 ml·L-1的盐酸,溶液的pH与所加盐酸的体积关系如图所示。下列有关叙述错误的是( )
2.室温下用0.1 ml·L-1 NaOH溶液分别滴定20.00 mL浓度均为0.1 ml·L-1的HA、HB两种酸的溶液,滴定过程中溶液的pH随滴入的NaOH溶液体积的变化如图所示(溶液体积变化忽略不计)。下列说法不正确的是( )
A.导电能力:a点溶液>b点溶液B.b点溶液中c(HB)
A.a点c(Ag+)为0.1 ml·L-1B.Ag2S的Ksp=c2(Ag+)·c(S2-)C.滴定NaCl溶液的是曲线①D.该方法可用于溶液中卤素离子浓度的测定
4.某温度下,分别向10 mL浓度均为0.1 ml·L-1的CuCl2和ZnCl2溶液中滴加0.1 ml·L-1的Na2S溶液,滴加过程中溶液中-lg c(Cu2+)和-lg c(Zn2+)与Na2S溶液体积(V)的关系如图所示。[已知:Ksp(ZnS)>Ksp(CuS),lg 3≈0.5],下列说法错误的是( )
A.溶液pH:a
(4)示例:Na2S2O3溶液滴定碘液
2.沉淀滴定(1)概念:沉淀滴定是利用沉淀反应进行滴定、测量分析的方法,生成沉淀的反应很多,但符合条件的却很少,实际上应用最多的是银量法,即利用Ag+与卤素离子的反应来测定Cl-、Br-、I-的浓度。
氧化还原反应滴定1.(2022·青岛模拟)目前,利用氧化还原滴定原理测定高铁酸钾纯度最为常见的方法是亚铬酸盐法:
准确称取a g高铁酸钾粗品配成V1 mL溶液,取V2 mL该待测液于锥形瓶中,加入浓碱性溶液和过量的三价铬盐。再加稀硫酸和指示剂二苯胺磺酸钠,用c ml·L-1硫酸亚铁铵标准液滴定至溶液颜色由紫色变成浅绿色,即为终点,共消耗标准液V3 mL(假设杂质不参与反应)。(1)标准液应注入________(填“酸式”或“碱式”)滴定管。(2)滴定时发生反应的离子方程式为__________________________ _______________________________________________________。
(3)该粗品中高铁酸钾的质量分数为______(用含字母的代数式表示)。(4)若硫酸亚铁铵标准液放在空气中时间过长,则测得粗品中高铁酸钾质量分数________(填“偏大”“偏小”或“不变”)。
2.用标准KMnO4溶液滴定待测H2O2水溶液中H2O2含量时,终点现象为_______________________________________________,滴定结束读数时俯视读数,测定H2O2的含量________(填“偏大”或“偏小”)。[答案] 当滴加最后半滴KMnO4溶液时,溶液由无色变为浅红色,且半分钟不褪色 偏小
沉淀滴定3.莫尔法是一种沉淀滴定法,以K2CrO4为指示剂,用标准硝酸银溶液滴定待测液,进行测定溶液中Cl-的浓度。已知:
(1)滴定终点的现象是____________________________________。(2)若用AgNO3溶液滴定NaSCN溶液,可选为滴定指示剂的是________(填字母)。A.NaCl B.BaBr2 C.Na2CrO4(3)根据表中数据,Ksp(AgCl)=____________ ml2·L-2(保留2位有效数字)。
2024届高三化学一轮复习课件:酸碱中和滴定及拓展应用: 这是一份2024届高三化学一轮复习课件:酸碱中和滴定及拓展应用,共3页。PPT课件主要包含了滴定终点,⑦使用方法,是否漏水,3mL,“0”刻度,粉红色,甲基橙,浅红色,半分钟,标准液等内容,欢迎下载使用。
高考化学一轮复习课件第8章第3讲 酸碱中和滴定及拓展应用(含解析): 这是一份高考化学一轮复习课件第8章第3讲 酸碱中和滴定及拓展应用(含解析),共50页。PPT课件主要包含了考向1,甲基橙,锥形瓶,待装液,不恢复,考向2,训练四十等内容,欢迎下载使用。
高考化学一轮复习微专题强化提升课中和滴定的拓展应用课件新人教版: 这是一份高考化学一轮复习微专题强化提升课中和滴定的拓展应用课件新人教版,共41页。












