
- 3.4沉淀溶解平衡课件PPT 课件 1 次下载
- 4.1 原电池课件PPT 课件 1 次下载
- 4.2原电池2课件PPT 课件 1 次下载
- 4.4金属的腐蚀与防护课件PPT 课件 1 次下载
- 化学选修一总复习课件PPT 课件 2 次下载
高中化学人教版 (2019)选择性必修1第二节 电解池备课课件ppt
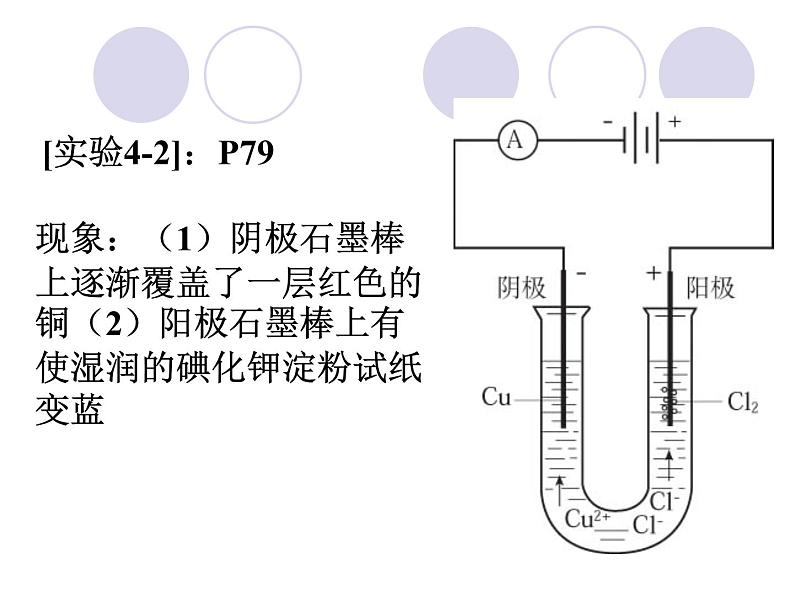
展开[实验4-2]:P79
现象:(1)阴极石墨棒上逐渐覆盖了一层红色的铜(2)阳极石墨棒上有使湿润的碘化钾淀粉试纸变蓝
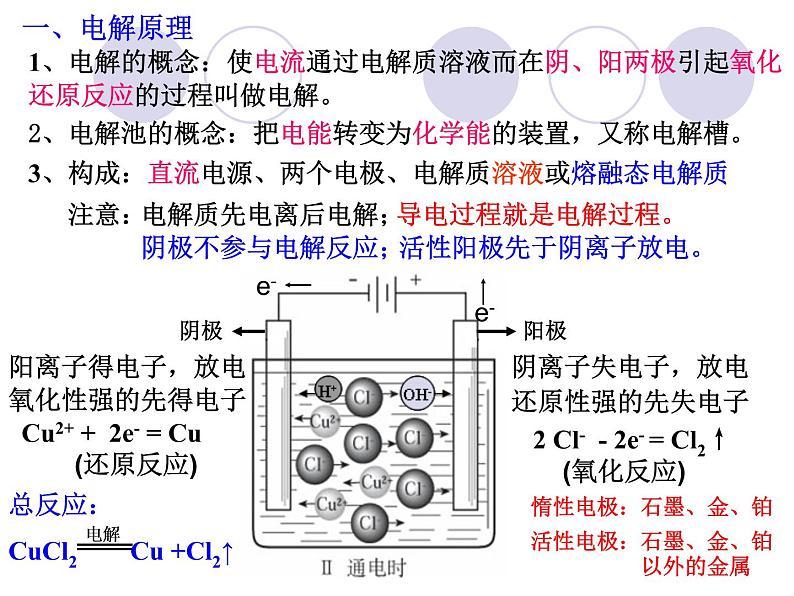
1、电解的概念:使电流通过电解质溶液而在阴、阳两极引起氧化还原反应的过程叫做电解。
2、电解池的概念:把电能转变为化学能的装置,又称电解槽。
3、构成:直流电源、两个电极、电解质溶液或熔融态电解质
导电过程就是电解过程。
2 Cl- - 2e- = Cl2↑ (氧化反应)
Cu2+ + 2e- = Cu (还原反应)
活性阳极先于阴离子放电。
惰性电极:石墨、金、铂
活性电极:石墨、金、铂 以外的金属
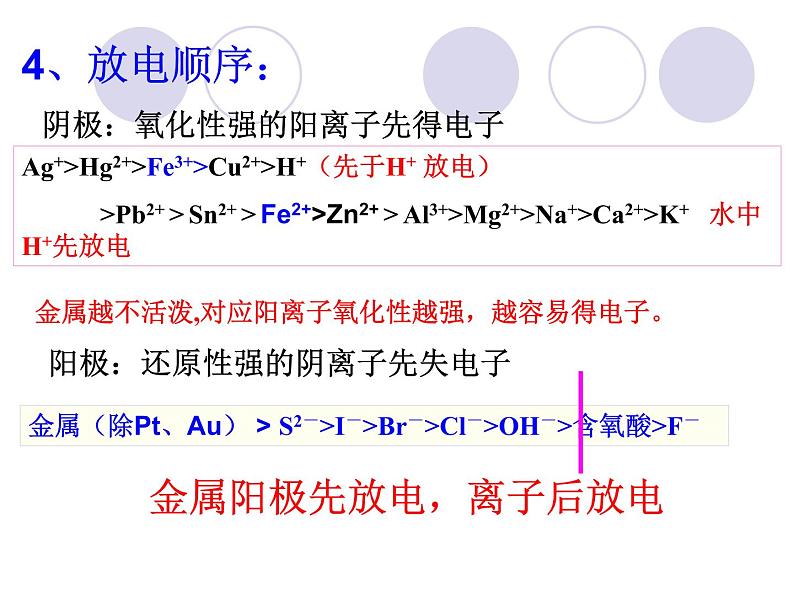
阴极:氧化性强的阳离子先得电子
金属越不活泼,对应阳离子氧化性越强,越容易得电子。
阳极:还原性强的阴离子先失电子
Ag+>Hg2+>Fe3+>Cu2+>H+(先于H+ 放电) >Pb2+ > Sn2+ > Fe2+>Zn2+ > Al3+>Mg2+>Na+>Ca2+>K+ 水中H+先放电
金属阳极先放电,离子后放电
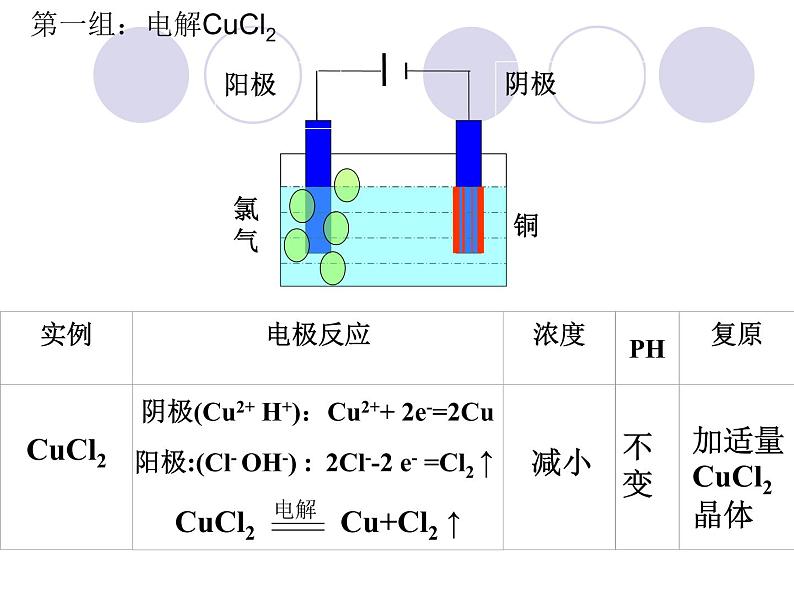
CuCl2 Cu+Cl2 ↑
阳极:(Cl- OH-) : 2Cl--2 e- =Cl2 ↑
阴极(Cu2+ H+):Cu2++ 2e-=2Cu
第一组:电解CuCl2
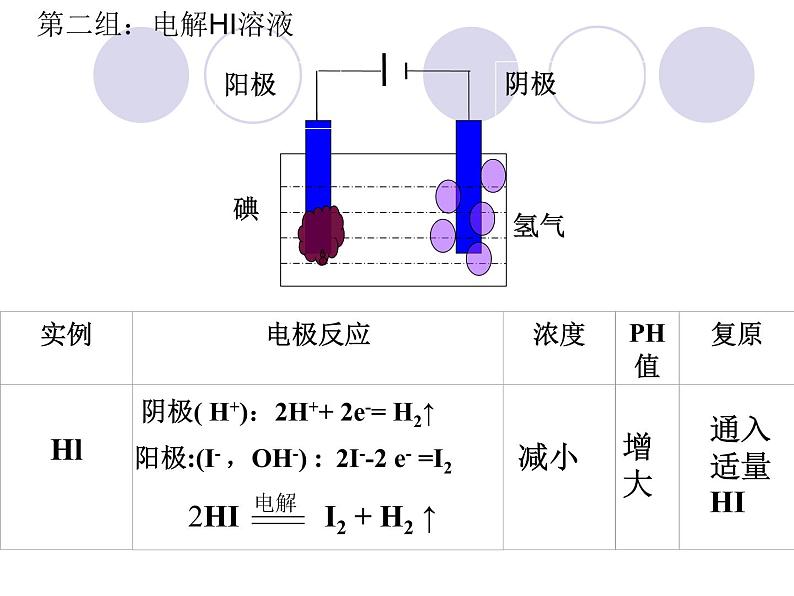
2HI I2 + H2 ↑
阳极:(I- ,OH-) : 2I--2 e- =I2
阴极( H+):2H++ 2e-= H2↑
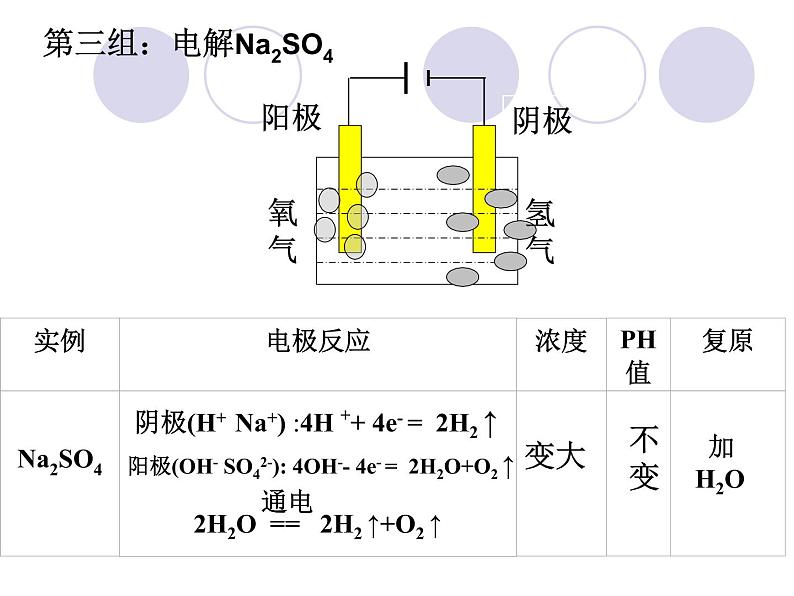
阳极(OH- SO42-): 4OH-- 4e- = 2H2O+O2 ↑
阴极(H+ Na+) :4H ++ 4e- = 2H2 ↑
2H2O == 2H2 ↑+O2 ↑
第三组:电解Na2SO4
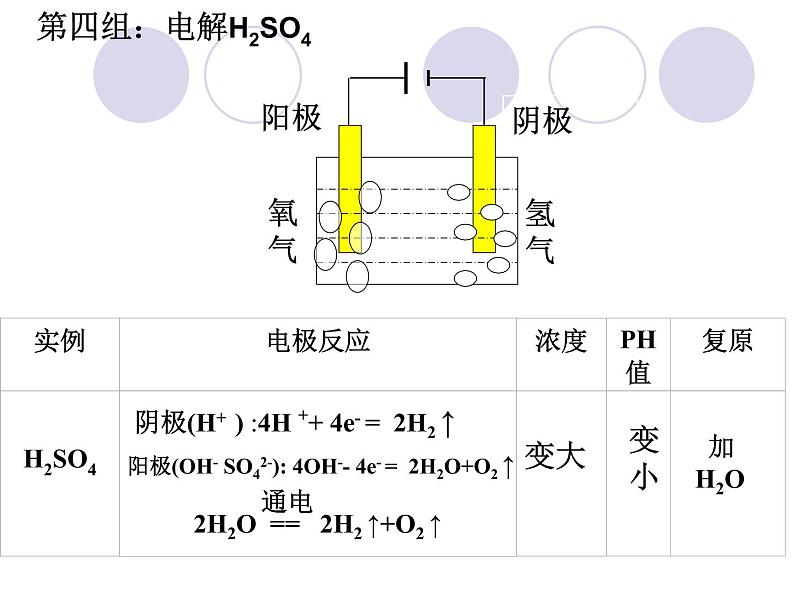
阴极(H+ ) :4H ++ 4e- = 2H2 ↑
第四组:电解H2SO4
阳极(OH- ): 4OH-- 4e- = 2H2O+O2↑
阳极(Cl- OH-): 2Cl-- 2e- = Cl 2 ↑
阴极(Na+ H+):2H ++ 2e- = H2 ↑
2NaCl+2H2O 2NaOH+H2 ↑+Cl2 ↑
2CuSO4+2H2O 2Cu +O2↑+2H2SO4
阴极(Cu2+ H+): 2Cu2++ 4e-=2Cu
第七组:电解CuSO4
阳极(SO42- OH-) :4OH-- 4e- = 2H2O+O2 ↑
二、电解质溶液电解规律(惰性电极)
阳极:金属>S2- > I- > Br- > Cl- > OH- > 含氧酸根 > F-
Ⅰ与Ⅲ区:电解本身型 如CuCl2Ⅰ与Ⅳ区:放氢生碱型 如NaClⅡ与Ⅲ区:放氧生酸型 如CuSO4、AgNO3Ⅱ与Ⅳ区:电解水型 如Na2SO4、 H2SO4 、NaOH
阴极:Ag+>Fe3+>Cu2+>H+>Fe2+>Zn2+>H+>Al3+>Mg2+>Na+
1、以Fe为阴极 ,Cu为阳极,电解CuSO4,画出电解池,标出电极名称,写出电极反应。
2、以Cu为阴极,Ag为阳极,电解AgNO3,画出电解池,标出电极,写出电极反应。
1、氯碱工业(电解饱和食盐水以制造烧碱、氯气和氢气的工业)
2Cl - -2e- == Cl2↑
2H+ + 2e- == H2 ↑
Na+ 、Cl- 、H+ 、OH-
离子放电顺序:阳离子 H+ > Na+ 阴离子 Cl- > OH-
电极反应:阳极 氧化反应 阴极 还原反应
2、电镀(在某些金属表面镀上一薄层其他金属或合金的方法)
阳极:镀层金属阴极:待镀金属制品电镀液:含有镀层金 属的电解质
阳极:镀层金属(纯铜板)阴极:待镀金属制品电镀液:含有镀层金 属的电解质(硫酸铜溶液)
电镀应用于铜的电解精练
电极反应式阴极(纯铜): Cu2+ + 2e- = Cu (还原反应)阳极(粗铜): Cu - 2e- = Cu2+ (氧化反应)
杂质:Zn - 2e- = Zn2+ Ni-2e- = Ni2+
阳极泥: 相对不活泼的金属以单质的形式沉积在 电解槽底,形成阳极泥
3、电冶金(使用电解法冶炼像钠、钙、镁、铝等活泼金属的 方法)
电解熔融状态的氯化钠。
2Na+ + 2e- == 2Na
电解熔融状态的氧化铝。
6O 2- -12e- == 3O2↑
4Al 3+ + 12e- == 4Al
1、电源、电极、电极反应关系
2、电解原理的应用:氯碱工业、电镀、电冶金
分析下图,哪个是原电池,哪个是电解池。
高中第二节 电解池多媒体教学ppt课件: 这是一份高中第二节 电解池多媒体教学ppt课件,共24页。PPT课件主要包含了三构成条件,一电解的定义,注阳极分为两种,电解质溶液,外接电源,还原反应,氧化反应,CuCl2,Cu+Cl2↑,有红色物质产生等内容,欢迎下载使用。
高中化学人教版 (新课标)选修4 化学反应原理第三节 电解池备课课件ppt: 这是一份高中化学人教版 (新课标)选修4 化学反应原理第三节 电解池备课课件ppt,共21页。PPT课件主要包含了有关电解,☆分析,实验分析,牢记放电顺序,巩固练习等内容,欢迎下载使用。
化学选修4 化学反应原理第三节 电解池说课课件ppt: 这是一份化学选修4 化学反应原理第三节 电解池说课课件ppt,共60页。PPT课件主要包含了有关电解,巩固练习,第四章电化学基础,电解原理的应用,精制食盐水,铜的电解精炼,电化学专题3\4,拓展练习,金属的电化学腐蚀,吸氧腐蚀等内容,欢迎下载使用。













