云南省昆明市2022-2023学年高三下学期省一测模拟化学试卷(含解析)
展开昆明市2022-2023学年高三下学期省一测模拟
化学
考试时间:60分钟
注意事项:
1.答题前填写好自己的姓名、班级、考号等信息
2.请将答案正确填写在答题卡上
第I卷(选择题)
一、单选题(每小题6分,共42分)
1.物质世界充满了变化。下列变化过程中,不涉及化学变化的是
A.天然气燃烧 | B.光合作用 | C.冰块融化 | D.钢铁生锈 |
A.A B.B C.C D.D
2.下列实验操作可以达到实验目的的是
| 实验目的 | 实验操作 |
A | 验证乙烯能与酸性高锰酸钾溶液反应 | 将乙醇与浓硫酸在170℃反应生成的气体,通入酸性高锰酸钾溶液,观察溶液是否褪色 |
B | 检验CH2=CHCHO中的碳碳双键 | 向该有机物中滴加几滴溴水,观察溴水是否褪色 |
C | 验证蔗糖能水解生成葡萄糖 | 向20%蔗糖溶液中加入少量稀H2SO4,加热,加入银氨溶液,观察是否出现银镜 |
D | 提纯含有少量氯化钠杂质的苯甲酸 | 用适量热水溶解后,冷却结晶,过滤 |
A.A B.B C.C D.D
3.根据实验操作和现象,不能得出相应结论的是
A.等体积、的两种酸和,分别与足量的反应,酸放出的氢气多,则酸性:
B.将样品溶于稀硫酸,滴加溶液,溶液变红,则样品溶于稀硫酸前已氧化变质
C.将充满的密闭玻璃球没泡在热水中,气体红棕色加深,则,
D.向含有酚酞的溶液中加入少量固体,有白色沉淀生成,溶液红色变浅,则纯碱溶液呈碱性是由水解引起的
4.下列判断正确的是
A.硬度:金刚石<碳化硅<晶体硅 B.沸点:
C.键的极性: D.热稳定性:
5.己二酸是一种重要的化工原料,科学家在现有合成路线基础上提出了一条“绿色”合成路线,如图所示。下列说法错误的是
A.环己醇可以通过先发生消去反应,再跟酸性高锰酸钾溶液反应得到己二酸
B.环己烷分子通过加成反应得到正己烷
C.苯可与水发生加成反应生成环己醇
D.“绿色”合成路线的碳原子的利用率为100%
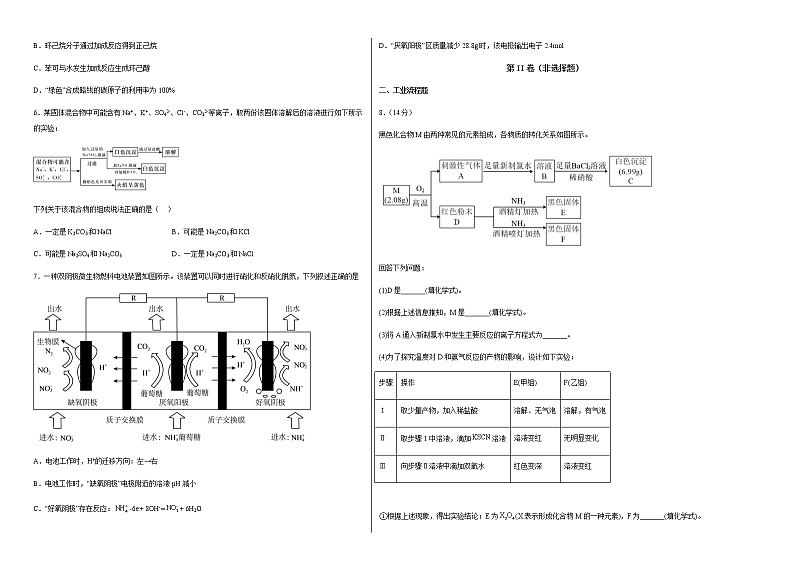
6.某固体混合物中可能含有Na+、K+、SO42-、Cl-、CO32-等离子,取两份该固体溶解后的溶液进行如下所示的实验:
下列关于该混合物的组成说法正确的是( )
A.一定是K2CO3和NaCl B.可能是Na2CO3和KCl
C.可能是Na2SO4和Na2CO3 D.一定是Na2CO3和NaCl
7.一种双阴极微生物燃料电池装置如图所示。该装置可以同时进行硝化和反硝化脱氮,下列叙述正确的是
A.电池工作时,H+的迁移方向:左→右
B.电池工作时,“缺氧阴极”电极附近的溶液pH减小
C.“好氧阴极”存在反应:-6e-+ 8OH-=+ 6H2O
D.“厌氧阳极”区质量减少28.8g时,该电极输出电子2.4mol
第II卷(非选择题)
二、工业流程题
8.(14分)
黑色化合物M由两种常见的元素组成,各物质的转化关系如图所示。
回答下列问题:
(1)D是_______(填化学式)。
(2)根据上述信息推知,M是_______(填化学式)。
(3)将A通入新制氯水中发生主要反应的离子方程式为_______。
(4)为了探究温度对D和氨气反应的产物的影响,设计如下实验:
步骤 | 操作 | E(甲组) | F(乙组) |
Ⅰ | 取少量产物,加入稀盐酸 | 溶解、无气泡 | 溶解,有气泡 |
Ⅱ | 取步骤Ⅰ中溶液,滴加溶液 | 溶液变红 | 无明显变化 |
Ⅲ | 向步骤Ⅱ溶液中滴加双氧水 | 红色变深 | 溶液变红 |
①根据上述现象,得出实验结论:E为(X表示形成化合物M的一种元素),F为_______(填化学式)。
②乙组实验中,步骤Ⅲ中溶液由无色变红的原因是_______(用离子方程式表示)。
③通过交流、讨论,有人认为E中除外还可能含_______(填化学式),判断的理由是_______。
三、实验题
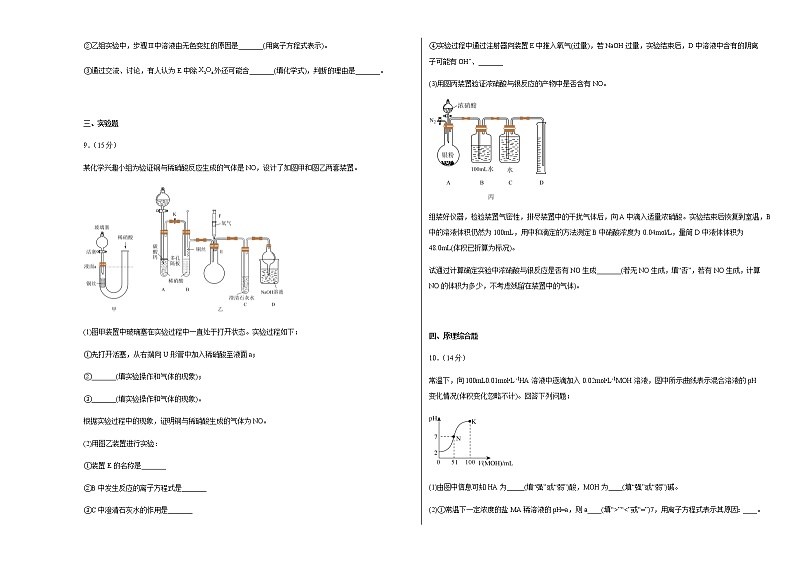
9.(15分)
某化学兴趣小组为验证铜与稀硝酸反应生成的气体是NO,设计了如图甲和图乙两套装置。
(1)图甲装置中玻璃塞在实验过程中一直处于打开状态。实验过程如下:
①先打开活塞,从右端向U形管中加入稀硝酸至液面a;
②_______(填实验操作和气体的现象);
③_______(填实验操作和气体的现象)。
根据实验过程中的现象,证明铜与稀硝酸生成的气体为NO。
(2)用图乙装置进行实验:
①装置E的名称是_______
②B中发生反应的离子方程式是_______
③C中澄清石灰水的作用是_______
④实验过程中通过注射器向装置E中推入氧气(过量),若NaOH过量,实验结束后,D中溶液中含有的阴离子可能有OH−、_______
(3)用图丙装置验证浓硝酸与银反应的产物中是否含有NO。
组装好仪器,检验装置气密性,排尽装置中的干扰气体后,向A中滴入适量浓硝酸。实验结束后恢复到室温,B中的溶液体积仍然为100mL,用中和滴定的方法测定B中硝酸浓度为0.04mol/L,量筒D中液体体积为48.0mL(体积已折算为标况)。
试通过计算确定实验中浓硝酸与银反应是否有NO生成_______(若无NO生成,填“否”,若有NO生成,计算NO的体积为多少,不考虑残留在装置中的气体)。
四、原理综合题
10.(14分)
常温下,向100mL0.01mol•L-1HA溶液中逐滴加入0.02mol•L-1MOH溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计)。回答下列问题:
(1)由图中信息可知HA为_____(填“强”或“弱”)酸,MOH为____(填“强”或“弱”)碱。
(2)①常温下一定浓度的盐MA稀溶液的pH=a,则a____(填“>”“<”或“=”)7,用离子方程式表示其原因:____。
②此时,溶液中由水电离出的c(OH-)____(填“>”“<”或“=”)1×10-7mol•L-1,用含a的式子表示由水电离出的c(OH-)=____mol•L-1。
(3)滴加51mLMOH溶液时,N点所对应的溶液c(M+)____(填“>”“<”或“=”)c(A-),此时,c(M+)=_____mol•L-1(用分数表示)。
(4)关于K点所对应的溶液中的关系可能正确的是_____(填选项字母)。
A.c(M+)>c(A-)>c(OH-)>c(H+) B.c(M+)<c(MOH)
C.c(M+)+c(MOH)=2c(A-) D.2c(M+)+c(H+)=2c(A-)+c(OH-)
五、有机推断题
11.(15分)
三氟哌啶醇是一种神经系统用药,用于精神分裂症的治疗。其合成路线如下所示:
(1)A的名称为___________;B的含氧官能团名称为___________。
(2)写出D→E反应的化学方程式___________。F→G的反应类型为___________。
(3)三氟哌啶醇的分子式为___________ 。
(4)根据以上信息,请写出以溴乙烷和丙酮为原料制取2-甲基-2-丁醇合成路线___________(其他试剂自选)。
参考答案:
1.C
【详解】A.天然气燃烧涉及甲烷燃烧生成CO2、H2O,有新物质生成,为化学变化,故A不选;
B.光合作用涉及CO2、H2O在光合作用下生成葡萄糖和氧气,有新物质生成,为化学变化,故B不选;
C.冰块融化涉及水由固态变为液态,不存在化学变化,故C选;
D.钢铁生锈涉及铁转化为铁的氧化物过程,有新物质生成,为化学变化,故D不选;
故选:C。
2.D
【详解】A.乙醇易被酸性高锰酸钾溶液氧化,且乙醇具有挥发性,所以生成的乙烯中含有乙醇而干扰实验,应该用溴水检验,故A不选;
B.碳碳双键、-CHO均与溴水反应,则将丙烯醛溶液滴入溴水中,溴水褪色,不能说明碳碳双键反应,故B不选;
C.银镜反应应在碱性条件下进行,题中没有加入碱调节溶液pH,故C不选;
D.适量热水溶解后,再冷却结晶,则苯甲酸先溶解后结晶、氯化钠可进入溶液而被过滤除去,故D选;
故选D。
3.B
【详解】A.等体积、的两种酸和,分别与足量的反应,酸放出的氢气多,则HA的浓度比HB大,所以相同浓度下HB酸性强于HA,故A正确;
B.亚铁离子与硝酸根离子在氢离子存在条件下发生氧化反应:,亚铁离子被氧化成铁离子,并不是硝酸亚铁变质,故B错误;
C.在密闭容器中存在反应,放入热水中温度升高,颜色加深,说明平衡逆向移动,该反应为放热反应,即,故C正确;
D.碳酸钠水解呈碱性,再碳酸钠溶液中加入酚酞后呈红色,当加入少量氯化钡溶液,有白色沉淀生成,发生反应:,碳酸根离子浓度降低,溶液颜色变浅,说明纯碱溶液呈碱性是由碳酸根离子引起的,故D正确;
故选B。
4.C
【详解】A.由于原子半径C<Si,所以键长C-C<C-Si<Si-Si,键长越短,共价键越强,硬度越大,因此硬度:金刚石>碳化硅>晶体硅,A错误;
B.相对分子质量越大,分子晶体的沸点越高,因此沸点由高到低:,B错误;
C.电负性:Cl>Br,则共价键极性:,C正确;
D.非金属性越强,氢化物的稳定性越强,非金属性:F>Cl>Br,热稳定性:,故D错误;
故选C。
5.C
【详解】A.环己醇发生消去反应生成环己烯,环己烯和酸性高锰酸钾溶液反应得到己二酸,故A正确;
B.环己烷分子中只含有C-C键和C-H键,是饱和烃,但在一定条件下可以和氢气加成生成正己烷,故B正确;
C.苯和水不能发生加成反应,所以不能由苯跟水发生加成反应生成环己醇,故C错误;
D.“绿色”合成路线中环己烷生成己二酸,碳原子数不变,其碳原子的利用率为100%,故D正确;
答案选C。
6.B
【分析】由流程图可知,加入Ba(NO3)2生成的白色沉淀易溶于盐酸,则其一定为BaCO3,原溶液中一定含CO32-,一定不含SO42-;加入AgNO3生成白色沉淀,则一定含有Cl-;焰色反应呈黄色,则一定含有Na+,可能含有K+。
【详解】A. 由以上分析可知,溶液中可能含有K+,所以不一定含K2CO3,A不正确;
B. 原溶液中一定含CO32-、Cl-、Na+、可能含K+,则可能是Na2CO3和KCl,B正确;
C. 原溶液中一定不含SO42-,所以不可能含Na2SO4,C不正确;
D. 原溶液中可能含K+,则“一定是Na2CO3和NaCl”的说法不正确,D不正确。
故选B。
7.D
【分析】如图所示,“厌氧阳极”上,C6H12O6失去电子生成CO2和H+,电极反应式为C6H12O6+6H2O-24e-=6CO2↑+24H+;“缺氧阴极”上,得到电子生成NO2,NO2再转化为N2,电极反应式分别为:+e-+2H+=NO2↑+H2O,2NO2+8e-+8H+=N2↑+4H2O;“好氧阴极”上,O2得到电子生成H2O,电极反应式为O2+4H++4e-=2H2O,同时O2还能氧化生成,还可以被O2氧化为,反应方程式分别为2+3O2=2+2H2O+4H+,2+O2=2。
【详解】A.由分析可知,电池工作时,“厌氧阳极”失去的电子沿外电路流向“缺氧阴极”和“好氧阴极”,则“厌氧阳极”产生的H+通过质子交换膜向“缺氧阴极”和“好氧阴极”迁移,故H+的迁移方向既有左(“厌氧阳极”)→右(“好氧阴极”),又有右(“厌氧阳极”)→左(“缺氧阴极”),A错误;
B.由分析可知,电池工作时,“缺氧阴极”上消耗H+,其附近的溶液pH增大,B错误;
C.由分析可知,“好氧阴极”上的反应有O2+4H++4e-=2H2O,2+3O2=2+2H2O+4H+,2+O2=2,C错误;
D.“厌氧阳极”的电极反应式为C6H12O6+6H2O-24e-=6CO2↑+24H+,每1mol C6H12O6反应,消耗6mol H2O,转移24mol电子,“厌氧阳极”区质量减少288g,故“厌氧阳极”区质量减少28.8g时,该电极输出电子2.4mol,D正确;
故选D。
8.(1)
(2)
(3)
(4) 、 溶于稀盐酸后,优先被氧化
【分析】由题干转化图信息可知,白色沉淀C为BaSO4,其物质的量为:n(BaSO4)===0.03mol,B为H2SO4,A为SO2,A转化为B的反应方程式为:SO2+Cl2+2H2O=H2SO4+2HCl,若另一种元素为铜,则M为硫化铜或硫化亚铜,D为氧化亚铜,氨气还原氧化亚铜得到红色铜,与题意相悖,故M中含铁、硫,D为氧化铁,即M中含有Fe和S元素,根据S原子守恒可知,n(S)=n(BaSO4)=0.03mol,则n(Fe)==0.02mol,故M的化学式为:Fe2S3,据此分析解题。
(1)
由分析可知,C为硫酸钡,说明M中含硫元素。若另一种元素为铜,则M为硫化铜或硫化亚铜,D为氧化亚铜,氨气还原氧化亚铜得到红色铜,与题意相悖,故M中含铁、硫,D为氧化铁,故答案为:Fe2O3;
(2)
由分析可知,n(S)=,M中铁的物质的量:,M的化学式为Fe2S3,故答案为:Fe2S3;
(3)
由分析可知,新制氯水的主要成分是氯气,氯气氧化二氧化硫:,故答案为:;
(4)
酒精灯加热时温度在500℃左右,酒精喷灯加热时温度可达到1000℃。温度越高,反应越充分。
①根据乙组实验现象,可知F中含有铁粉,故黑色固体F的成分为Fe、FeO或者只有Fe,故答案为:Fe、FeO(或者Fe);
②加入双氧水氧化亚铁离子,在酸性条件下发生的反应为,故答案为:;
③E中还可能有Fe,如果E为四氧化三铁和铁的混合物,四氧化三铁溶于盐酸生成氯化铁、氯化亚铁,氯化铁的氧化性比盐酸的强,氯化铁与铁反应生成氯化亚铁。有关反应如下:、,故步骤I加入盐酸,无气泡,故答案为:Fe;Fe3O4溶于稀盐酸后,Fe优先被Fe3+氧化。
9.(1) 关闭活塞,U形管左端有无色气体生成 打开活塞,在分液漏斗内(或上口)处观察到无色气体变红棕色气体
(2) 圆底烧瓶 3Cu+8H++2=3Cu2++2NO↑+4H2O 判断E中的空气是否被排尽 、()
(3)3.2mL
【分析】铜片与稀硝酸反应生成硝酸铜、一氧化氮和水;一氧化氮与氧气易发生反应生成红棕色气体二氧化氮、可据此检验NO的生成,为防止反应前存在的空气对NO检验的干扰,铜与硝酸反应前应赶净装置内的空气,尾气会污染环境,需进行尾气处理。
(1)
①先打开活塞,从右端向U形管中加入稀硝酸至液面a,这样装置内就没有空气;
②关闭活塞,U形管左端铜片与稀硝酸反应生成硝酸铜、一氧化氮和水, NO排不出去,U形管中左管可观察到的现象为:铜丝的表面有无色气体生成,左边液面下降,右边液面上升;
③打开活塞, U形管左管气压下降、液面上升,NO进入分液漏斗内,与O2反应生成红棕色的NO2,故在分液漏斗内(或上口)处观察到无色气体变红棕色气体。
(2)
乙装置:可先将A装置中滴加硝酸、碳酸钙和硝酸反应生成二氧化碳气体,可将B中的空气排出,防止氧化生成的NO,C中石灰水变浑浊时表明E装置内空气被赶净,在E烧瓶中收集到NO;将F气球中的空气压入E中,有红棕色气体生成;装置D中盛有氢氧化钠溶液,可用于吸收一氧化氮和二氧化氮气体,以防止其污染空气。
①装置E的名称是圆底烧瓶;
②B中铜片与稀硝酸反应生成硝酸铜、一氧化氮和水,发生反应的离子方程式是3Cu+8H++2=3Cu2++2NO↑+4H2O;
③该反应是C中澄清石灰水的作用是判断E中的空气是否被排尽;
④实验过程中通过注射器向装置E中推入氧气(过量),若NaOH过量,实验结束后,由于二氧化碳被过量氢氧化钠吸收可生成碳酸根离子,氮氧化物被过量氢氧化钠吸收可生成(),则D中溶液中含有的阴离子可能有OH−、、()。
(3)
若浓硝酸与银反应只生成NO2 、不生成NO,则B中反应为、生成硝酸为0.100L×0.04mol/L=0.004mol,则二氧化氮被水吸收生成的NO应为0.002mol、标准状况下NO体积为44.8mL,NO不溶于水、则量筒D中液体体积应为44.8mL,而实际上量筒D中液体体积48.0mL,则可确定实验中浓硝酸与银反应有NO生成,答案为“是”,NO的体积为48.0mL-44.8mL=3.2mL。
10.(1) 强 弱
(2) < M++H2OMOH+H+ > 1×10-a(或10-a)
(3) =
(4)AC
【详解】(1)由图中信息可知,0.01mol/L的HA的pH=2,即c(H+)=0.01mol/L,说明HA为强酸,滴定终点消耗0.02mol/L的MOH的体积不是50mL而是51mL,故说明MOH为弱碱,故答案为:强;弱;
(2)①由(1)小问分析可知,MA为强酸弱碱盐,故常温下MA稀溶液由于M+发生水解而呈酸性,水解离子方程式为:M++H2OMOH+H+,即一定浓度的盐MA稀溶液的pH=a,则a<7,故答案为:<;M++H2OMOH+H+;
②然后溶液中水电离出的c(H+)和水电离出的c(OH-)永远相等,但由于MA中M+结合水电离出的OH-而发生水解使溶液呈酸性,故此时,溶液中由水电离出的c(OH-)=水电离出的c(H+)=溶液中的c(H+)=10-amol/L>1×10-7mol•L-1,则由水电离出的c(OH-)=10-a mol•L-1,故答案为:>;10-a;
(3)根据电荷守恒可知,c(H+)+c(M+)=c(OH-)+c(A-)由题干图示信息可知,滴加51mLMOH溶液时,溶液pH=7,即呈中性,c(H+)=c(OH-), N点所对应的溶液c(M+) =c(A-),此时,c(M+)= c(A-)==mol•L-1,故答案为:=;;
(4)由题干图示信息可知,K点加入了100mLMOH,且此时溶液显碱性,根据物料守恒有:c(M+)+c(MOH)=2c(A-),且c(M+)>c(A-),据此分析解题:
A.由上述分析可知,K点溶液中有: c(M+)>c(A-)>c(OH-)>c(H+),A正确;
B. 由上述分析可知,c(M+)+c(MOH)=2c(A-),且c(M+)>c(A-),则c(M+)>c(MOH),B错误;
C. 由上述分析可知,根据物料守恒有 c(M+)+c(MOH)=2c(A-),C正确;
D. 根据电荷守恒可知,c(M+)+c(H+)=c(A-)+c(OH-),c(M+)≠c(A-),故2c(M+)+c(H+)≠2c(A-)+c(OH-),D错误;
故答案为:AC。
11.(1) 氟苯 羰基、羧基
(2) +Br2+HBr 加成反应
(3)C22H23NO2F4
(4)
【分析】由有机物的转化关系可知,在氯化铝作用下 与发生取代反应生成,与SOCl2发生取代反应生成 ;在氯化铝作用下与溴发生取代反应生成,在乙醚作用下与镁反应生成 ,与发生加成反应生成 , 酸性条件下水解生成,在碱作用下 与发生取代反应生成。
(1)
A的结构简式为 ,名称为氟苯;B的结构简式为,含氧官能团为羰基、羧基,故答案为:氟苯;羰基、羧基;
(2)
D→E的反应为在氯化铝作用下 与溴发生取代反应生成和溴化氢,反应的化学方程式为+Br2 +HBr,F→G的反应为与发生加成反应生成,故答案为:+Br2 +HBr;加成反应;
(3)
根据题中所给的三氟哌啶醇的结构简式,三氟哌啶醇的分子式为C22H23NO2F4,故答案为:C22H23NO2F4;
(4)
根据以上信息,结合原料及目标产物的结构特点分析,由溴乙烷和丙酮合成2-甲基-2-丁醇的路线为:。
2022-2023学年云南省昆明市高二(下)期末化学试卷(含详细答案解析): 这是一份2022-2023学年云南省昆明市高二(下)期末化学试卷(含详细答案解析),共24页。试卷主要包含了单选题,流程题,实验题,简答题,推断题等内容,欢迎下载使用。
2022-2023学年云南省昆明市高二(下)期末化学试卷(含解析): 这是一份2022-2023学年云南省昆明市高二(下)期末化学试卷(含解析),共24页。试卷主要包含了选择题,非选择题等内容,欢迎下载使用。
2022-2023学年云南省昆明市一中高三下学期第二次测试化学试卷含解析: 这是一份2022-2023学年云南省昆明市一中高三下学期第二次测试化学试卷含解析,共15页。试卷主要包含了请将答案正确填写在答题卡上,下列物质互为同位素的是等内容,欢迎下载使用。












