





- 1.1《原子结构》(第2课时)课件 课件 6 次下载
- 1.1《原子结构》(第3课时)课件 课件 8 次下载
- 1.2《原子结构与元素的性质》(第1课时)课件 课件 5 次下载
- 1.2《原子结构与元素的性质》(第2课时)课件 课件 5 次下载
- 2.1《共价键》课件 课件 4 次下载
人教版 (2019)选择性必修2第一节 原子结构优质课ppt课件
展开通过认识原子结构和电子排布理解能层和能级的关系。
通过核外电子能量不同分析、理解基态与激发态的含义。
3. 能辨识光谱与电子跃迁之间的关系。
1920年,丹麦科学家玻尔在氢原子模型基础上,提出 ,开启了用原子结构解释 的篇章。1925年以后,玻尔的“壳层”落实为“能层”与“能级”,厘清了核外电子的可能状态,复杂的原子光谱得以诠释。1936年,德国科学家马德隆发表了以 事实为依据的完整的 。
一、影响化学反应速率的因素
E(K)<E(L)<E(M)<
E(N)<E(O)<E(P)<E(Q)
3s 3p 3d
4s 4p 4d 4f
5s 5p 5d 5f 5g
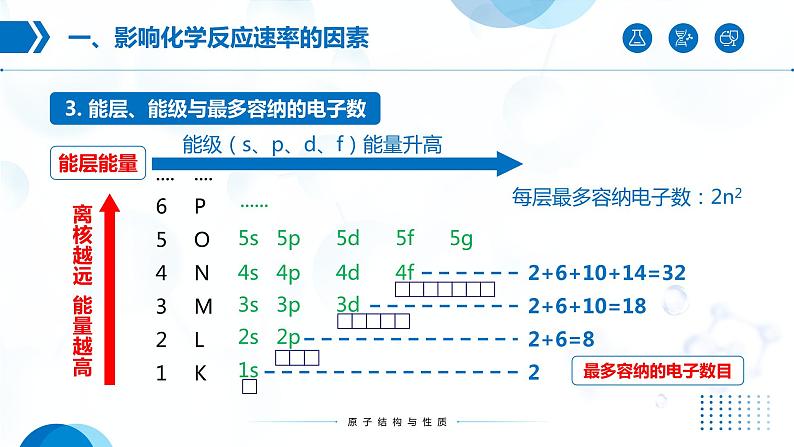
能级(s、p、d、f)能量升高
2+6+10+14=32
每层最多容纳电子数:2n2
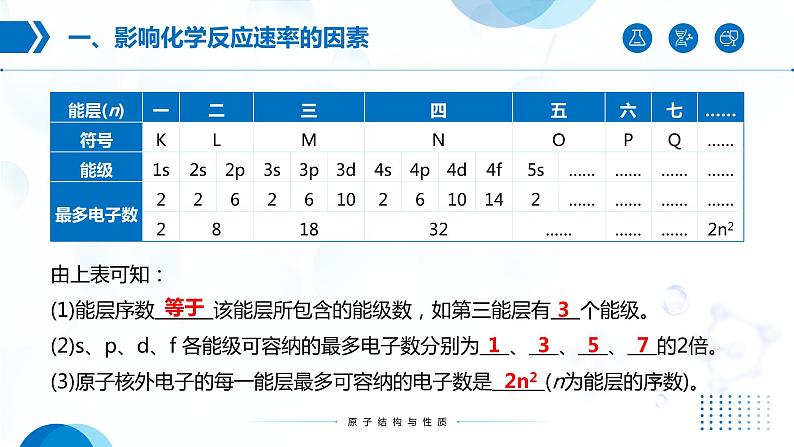
由上表可知:(1)能层序数 该能层所包含的能级数,如第三能层有 个能级。(2)s、p、d、f 各能级可容纳的最多电子数分别为 、 、 、 的2倍。(3)原子核外电子的每一能层最多可容纳的电子数是 (n为能层的序数)。
1. 什么是能层,有什么规律?
2. 什么是能级?能级的符号和所能容纳的电子数?
核外电子按能量不同分成能层,能层越高,电子能量越高。
在多电子原子中,同一能层的电子,还被分成不同能级。
一个能层的能级与能层序数(n)间存在什么关系?一个能层最多可容纳的电子数与能层序数(n)间存在什么关系?
2. 以s、p、d、f、为符号的能级分别最多可容纳多少电子?3d、4d、5d能级所 能容纳的最多电子数是否相同?
3. 第五能层最多可容纳多少电子?它们分别容纳在几个能级中?各能级最多容纳 多少个电子?(注:高于f的能级不用符号表示。)
一个能层的能级序数与能层序数(n)相等。一个能层最多可容纳的电子数=2n2
s能级最多容纳2电子,p能级最多可容纳6个电子,d能级最多可容纳10个电子,f能级最多可容纳14个电子。3d、4d、5d能级所能容纳的最多电子数相同
第五能层最多可容纳50个电子,它们分别容纳在5个能级中,5s能级最多容纳2个电子,5p能级最多容纳6个电子,5d能级最多容纳10个电子,5f能级最多容纳14个电子,还有一个能级最多容纳18个电子。
二、基态与激发态 原子光谱
1. 基态原子与激发态原子(1) 基态原子:处于 状态的原子。(2) 激发态原子:基态原子 能量,它的电子会跃迁到 能级, 变成激发态原子。
1. 基态原子与激发态原子
(1) 光谱的成因及分类
(2) 原子光谱与光谱分析
① 原子光谱: 不同元素的原子, 电子发生跃迁时会吸收或释放不同的光, 可以用光 谱仪摄取各种元素原子的 吸收 光谱或 发射 光谱,总称原子光谱。② 光谱分析: 现代化学中, 常利用原子光谱上的 特征谱线 来鉴定元素, 称为光谱 分析。
提示: 激发态原子中的电子跃迁到低能级时, 多余的能量以光的形式释放出来。
金属的焰色试验中, 一些金属元素呈现不同焰色的原因是什么?
3. 基态原子、激发态原子与原子光谱的关系
同一原子发射光谱中的亮线和吸收光谱中的暗线的位置对应相同。
光谱分析:每一种元素都有自己的特征谱线,就像“指纹”一样可用于辨别形成光谱的元素。
1. 什么是基态原子?什么是激发态原子?
处于最低能量状态的原子叫基态原子。
基态原子吸收能量,它的电子跃迁到较高能级,变为激发态原子。
不同元素原子的电子发生跃迁时会吸收或释放不同的光,可以用光谱仪摄取各种元素原子的吸收光谱,总称原子光谱。
2. 日常生活中,与原子核核外电子跃迁释放能量有关的例子?
3. 原子光谱的形成?
1. 下列叙述正确的是( )A. 能级就是电子层B. 每个能层最多可容纳的电子数是2n2C. 同一能层中的不同能级的能量高低相同D. 不同能层中的s能级的能量高低相同
能层是电子层,对于同一能层里能量不同的电子,又将其分为不同的能级,故A错误;
不同能层中的s能级的能量不同,能层越大,s能级的能量越高,例如:E(1s)
同一能层里不同能级,能量按照s、p、d、f的顺序升高,故C错误;
2. 某元素原子的核外有三个能层,最外能层有4个电子,该原子核内 的质子数为( ) A.14 B.15 C.16 D.17
3. 以下现象与核外电子的跃迁有关的是①霓虹灯发出有色光 ②棱镜分光 ③激光器产生激光 ④石油蒸馏 ⑤凸透镜聚光 ⑥燃放的焰火,在夜空中呈现五彩缤纷的礼花 ⑦日光灯通电发光 ⑧冷却结晶 ( )A.①③⑥⑦ B.②④⑤⑧C.①③⑤⑥⑦ D.①②③⑤⑥⑦
CLASS SUMMARY
人教版 (2019)选择性必修2第一节 原子结构精品课件ppt: 这是一份人教版 (2019)选择性必修2第一节 原子结构精品课件ppt,共22页。PPT课件主要包含了核心素养,资料卡片-电子自旋,钠原子光谱实验,斯特恩-盖拉赫实验,泡利原理,电子自旋,练一练,能量相同的原子轨道,洪特规则,洪特规则特例等内容,欢迎下载使用。
化学选择性必修2第一章 原子结构与性质第一节 原子结构优质ppt课件: 这是一份化学选择性必修2第一章 原子结构与性质第一节 原子结构优质ppt课件,共36页。PPT课件主要包含了核心素养,光谱学,理论依据构造原理,Al原子电子排布式,s22s22p4,特别提醒,源于光谱学事实,半充满,全充满,思考与讨论等内容,欢迎下载使用。
鲁科版选修3 物质结构与性质第1节 原子结构模型多媒体教学课件ppt: 这是一份鲁科版选修3 物质结构与性质第1节 原子结构模型多媒体教学课件ppt,共28页。PPT课件主要包含了学习目标定位等内容,欢迎下载使用。













