

宁夏银川市西夏区2022-2023年高二下学期开学考试化学试卷
展开银川市西夏区2022-2023年高二下学期开学考试
化学 试卷
(试卷满分:100分)
可能用到的相对原子质量:H-1 N-14 O-16 F-19 P-31 Cl-35.5 Na-23 Fe-56 Zn-65
一、单选题(本题共18小题,每小题3分,共计54分)
1.神舟十五号3名航天员顺利进驻中国空间站,两个航天员乘组首次实现“太空会师”。发射火箭的燃料
常用联氨(N2H4)、液氢(H2),氧化剂有液氧(O2)、液态N2O4等。
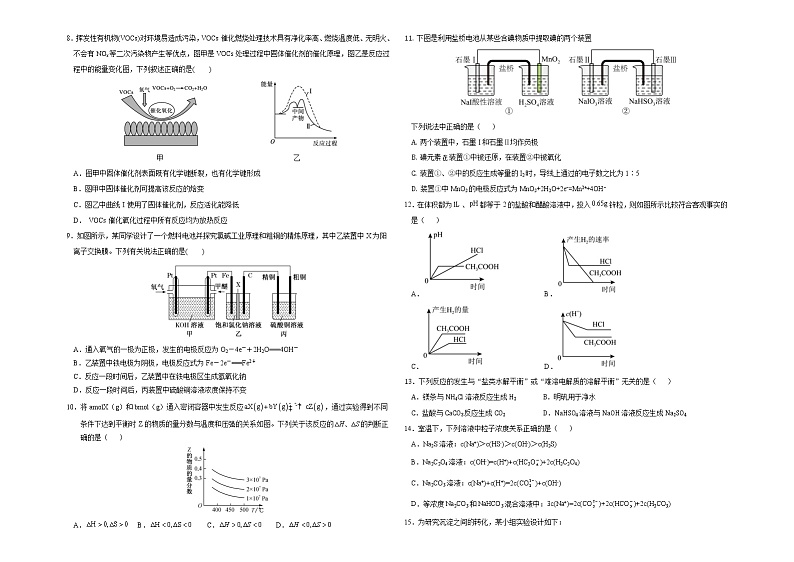
下列叙述错误的是( )
A.液氢和液氧燃烧放出大量热量,产物对环境友好
B.发射场因液态N2O4产生大量NO2而呈红棕色
C.液氢和液氧在气化过程中发生了吸热反应
D.N2H4和N2O4反应中产物总能量小于反应物总能量
2.下列热化学方程式正确的是( )
A.已知2H2(g)+O2(g)===2H2O(g) ΔH=-483.6 kJ·mol-1,则氢气的燃烧热为241.8 kJ·mol-1
B.1 mol SO2、0.5 mol O2混合反应后,放出热量akJ,2SO2(g)+O2(g)2SO3(g) △H=﹣2a kJ•mol﹣1
C.H+(aq)+OH﹣(aq)=H2O(l) △H=﹣57.3 kJ•mol﹣1,
H2SO4(aq)+Ba(OH)2(aq)=BaSO4(s)+2H2O(l) △H=﹣114.6 kJ•mol﹣1
D.31 g白磷比31 g红磷能量多b kJ ,P4(s)=4P(s) △H=﹣4b kJ•mol﹣1
3. 下列有关化学反应速率的说法正确的是( )
A. 用铁片和稀硫酸反应制取氢气时,改用98%的浓硫酸可以加快产生氢气的速率
B. 100mL2mol·L-1的盐酸跟锌片反应时,加入适量的硫酸铜溶液,反应速率不变
C. SO2的催化氧化是一个放热反应,所以升高温度,反应速率减慢
D. 汽车尾气中的NO和CO反应转化为无害的N2和CO2,减小压强,使单位体积内活化分子数减少,反
应速率减慢
4.下列事实,不能用勒夏特列原理解释的是( )
A.气体在热水中比在冷水中颜色深 | B.制备氢氧化铁胶体 | C.加压后气体颜色变深 | D.用浓氨水和NaOH固体制取氨气 |
5. 气体A、B分别为0.6 mol和0.5 mol,在0.4 L密闭容器中发生反应:3A+B⇌aC+2D,经5 min后,此时
C为0.2mol,又知在此反应时间内,D的平均反应速率为0.1 mol·(L·min)-1,下列结论正确的是( )
A. A的平均反应速率为0.1 mol·(L·min)-1 B. a值为2
C. B的转化率为50% D. 此时,反应混合物总的物质的量为1 mol
6.在密闭容器中进行反应:X(g)+3Y(g) = 2Z(g),下列根据图像所作出的描述中,错误的是( )。
A.依据图甲可判断正反应为放热反应
B.在图乙中,虚线可表示使用了催化剂
C.若正反应的ΔH<0,图丙可表示升高温度使平衡向逆反应方向移动
D.由图丁中气体平均相对分子质量随温度的变化情况,可推知正反应的ΔH>0
7.一定温度下,在恒容密闭容器中,将10 mol CO和一定量的H2S混合加热可得下列平衡:。已知平衡后CO物质的量为8 mol且。下列说法错误的是( )
A.CO的平衡转化率为20% B.反应前H2S物质的量为7 mol
C.通入CO后,正反应速率逐渐增大 D.升高温度,H2S浓度增加,表明该反应是放热反应
8.挥发性有机物(VOCs)对环境易造成污染,VOCs催化燃烧处理技术具有净化率高、燃烧温度低、无明火、不会有NOx等二次污染物产生等优点,图甲是VOCs处理过程中固体催化剂的催化原理,图乙是反应过程中的能量变化图,下列叙述正确的是( )
甲 乙
A.图甲中固体催化剂表面既有化学键断裂,也有化学键形成
B.图甲中固体催化剂可提高该反应的焓变
C.图乙中曲线Ⅰ使用了固体催化剂,反应活化能降低
D. VOCs催化氧化过程中所有反应均为放热反应
9.如图所示,某同学设计了一个燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜。下列有关说法正确的是( )
A.通入氧气的一极为正极,发生的电极反应为O2-4e-+2H2O===4OH-
B.乙装置中铁电极为阴极,电极反应式为Fe-2e-===Fe2+
C.反应一段时间后,乙装置中在铁电极区生成氢氧化钠
D.反应一段时间后,丙装置中硫酸铜溶液浓度保持不变
10.将amolX(g)和bmol(g)通入密闭容器中发生反应,通过实验得到不同条件下达到平衡时Z的物质的量分数与温度和压强的关系如图。下列关于该反应的的判断正确的是( )
A. B. C. D.
11. 下图是利用盐桥电池从某些含碘物质中提取碘的两个装置
下列说法中正确的是( )
A. 两个装置中,石墨I和石墨Ⅱ均作负极
B. 碘元素装置①中被还原,在装置②中被氧化
C. 装置①、②中的反应生成等量的I2时,导线上通过的电子数之比为1∶5
D. 装置①中MnO2的电极反应式为MnO2+2H2O+2e-=Mn2++4OH-
12.在体积都为、都等于2的盐酸和醋酸溶液中,投入锌粒,则如图所示比较符合客观事实的是( )
A. B.
C. D.
13.下列反应的发生与“盐类水解平衡”或“难溶电解质的溶解平衡”无关的是( )
A.镁条与NH4Cl溶液反应生成H2 B.明矾用于净水
C.盐酸与CaCO3反应生成CO2 D.NaHSO4溶液与NaOH溶液反应生成Na2SO4
14.室温下,下列溶液中粒子浓度关系正确的是( )
A.Na2S溶液:c(Na+)>c(HS-)>c(OH-)>c(H2S)
B.Na2C2O4溶液:c(OH-)=c(H+)+c(HC2O)+2c(H2C2O4)
C.Na2CO3溶液:c(Na+)+c(H+)=2c(CO)+c(OH-)
D.等浓度Na2CO3和NaHCO3混合溶液中:3c(Na+)=2c(CO)+2c(HCO)+2c(H2CO3)
15.为研究沉淀之间的转化,某小组实验设计如下:
下列分析正确的是( )
A.实验①无明显现象,说明浊液a中不存在自由移动的Ag+
B.实验②说明浊液b中存在AgCl(s)Ag+(aq)+Cl-(aq)
C.黄色浊液d中不含AgCl
D.浊液c和浊液d中的c(Ag+):c<d
16.用标准盐酸滴定未知浓度的NaOH溶液,下列操作不会引起实验误差的是( )。
A.用蒸馏水洗净酸式滴定管后,装入标准盐酸进行滴定
B.用蒸馏水洗净锥形瓶后,再用NaOH溶液润洗,然后装入NaOH溶液进行滴定
C.用碱式滴定管取10.00 mL NaOH溶液放入用蒸馏水洗净的锥形瓶中,加入少量的蒸馏水再进行滴定
D.用酚酞作指示剂滴至红色刚变无色时即停止滴加盐酸
17. 据最近报道,中国生产的首艘国产航母已经下水。为保护航母、延长服役寿命可采用两种电化学方法。方法1:舰体镶嵌一些金属块;方法2:航母舰体与电源相连。下列有关说法正确的是( )
A. 方法1叫外加电流的保护法 B. 方法2叫牺牲阳极的保护法
C. 方法1中金属块可能是锌、锡和铜 D. 方法2中舰体连接电源的负极
18.下列实验中,操作、现象及推论都正确的是( )
选项 | 实验 | 现象 | 推论 |
A | 往盛有1mL0.1mol/LMgCl2溶液的试管中加入4mL0.1mol/LNaOH溶液,再滴加2滴0.1mol/LFeCl3溶液 | 先有白色沉淀生成,后有红褐色沉淀 | Ksp[Fe(OH)3]<Ksp[Mg(OH)2] |
B | 室温下用pH试纸测定同浓度的NaClO溶液和CH3COONa溶液pH | CH3COONa溶液pH小 | 次氯酸比醋酸的酸性弱 |
C | 将等浓度的KI溶液和FeCl3溶液混合,充分反应后滴入KSCN溶液 | 溶液变红 | Fe3+与I-的反应是可逆反应 |
D | 往烧杯中加入约20g研细的Ba(OH)2·8H2O晶体和10gNH4Cl晶体,并将烧杯放在滴有水的玻璃片上,用玻璃棒迅速搅拌 | 有刺激性气味气体生成,烧杯底部结冰,与玻璃片粘在一起 | 吸热反应不一定要加热才能进行 |
二、非选择题(本大题共4小题,共46分)
19.(14分)按要求回答下列问题:
(1)下列变化中属于吸热反应的是 。
①铝片与稀盐酸的反应 ②将胆矾加热变为白色粉末 ③干冰汽化
④氯酸钾分解制氧气 ⑤甲烷在氧气中的燃烧反应 ⑥C与H2O(g)高温条件生成水煤气
(2)反应C(s)+H2O(g)CO(g)+H2(g)在一个容积可变的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是 。
①增加C的量 ②将容器的体积缩小一半 ③保持体积不变,充入N2使体系压强增大
④保持压强不变,充入N2使容器体积变大
(3)在体积为1L的密闭容器中,充入1molCO2和3molH2,一定条件下反应:CO2(g)+3H2(g)CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如图:
从3min到9min,v(CO2)= (结果保留两位有效数字);a点时v(正)__v(逆)(填﹥、﹤或=,下同);
第9分钟时v逆(CH3OH)___第3分钟时v正(CH3OH)。
(4)微生物燃料电池是指在微生物作用下将化学能转化为电能的装置。某微生物燃料电池工作原理如图所示。
①该微生物燃料电池,负极为 (填“a”或“b”)。
②该电池正极电极反应式为 。
③当电路中有0.5mol电子发生转移,则有 mol的H+通过质子交换膜。
(5)我国某科研团队设计了一种电解装置,将CO2和NaCl高效转化为CO和NaClO,原理如图2所示:
通入CO2气体的一极为_________(填“阴极”、“阳极”、“正极”或“负极”),写出该极的电极反应式: ,若电解时电路中转移0.4mol电子,则理论上生成NaClO的物质的量为_________mol。
20. (10分)二氧化锰是化学工业中常用的氧化剂和催化剂。我国主要以贫菱锰矿(有效成分为MnCO3)为原料,通过热解法进行生产。
(1)碳酸锰热解制二氧化锰分两步进行:
i.MnCO3(s) ⇌MnO(s)+CO2(g) △H1=+a kJ∙mol−1
ii.2MnO(s)+O2(g) ⇌2MnO2(s) △H2=+b kJ∙mol−1
①反应i的化学平衡常数表达式K= ;
②焙烧MnCO3制取MnO2的热化学方程式是 ;
(2)焙烧(装置如图1)时持续通入空气,并不断抽气的目的是 ;
(3)在其他条件不变时,某科研团队对影响转化率的生产条件进行了研究,结果如图2、图3所示。
①常压下,要提高MnCO3的转化率,应选择的生产条件是 、 焙烧68h。
②图3中,焙烧8h时,MnCO3的转化率:干空气<湿空气,原因是 。
21.(10分)维生素C化学式是,是一种水溶性维生素(其水溶液呈酸性),具有很强的还原性,可以被空气中的氧气氧化。某兴趣小组测定某橙汁中维生素C的含量。已知测定原理为:。回答下列问题:
(1)用浓度为的I2标准溶液进行滴定,量取标准溶液时用 (填“酸式滴定管”或“碱式滴定管”);指示剂为______________。
(2)实验过程
①洗涤仪器,检查滴定管是否漏液,润洗后装好标准碘溶液待用。
②用滴定管向锥形瓶中移入20.00mL待测橙汁,滴入2滴指示剂。
③用左手控制滴定管的活塞,右手摇动锥形瓶,眼睛注视__________________,直到滴定终点。滴定至终点时的现象是 。
④经数据处理,滴定中消耗标准碘溶液的体积是15.00mL,则此橙汁中维生素C的含__________(保留两位有效数字)
(3)滴定时不能剧烈摇动锥形瓶,除了防止液体溅出,原因还有: 。
(4)会引起所测橙汁浓度偏大的操作为____________。
A.滴定前有气泡,滴定后无气泡 B.滴定后读数时俯视滴定管
C.滴定管水洗后直接装入标准液 D.摇动锥形瓶时锥形瓶中有液体溅出
22.(12分)I、常温下,向的MOH溶液中逐滴加入溶液,滴定曲线如图所
示。请回答下列问题:
(1)常温下,该碱的电离平衡常数______。
(2)滴定到C点时,溶液中各离子浓度由大到小的顺序是________________________。
(3)图中A、B、C三点溶液中水的电离程度最大的是__________________。
II、已知Na2A溶液中存在的粒子为Na+、HA-、A2-、H+、OH-、H2O,回答下列问题:
(4)NaHA溶液显______(填“酸性”或“碱性”或“中性”),原因是___________(用离子方程式表示)
(5)NaHA溶液中有关粒子的浓度关系正确的是
A. B.
C. D.
III、(6)化工生产中常用MnS作沉淀剂除去工业废水中:。
该反应的平衡常数K为__________(保留两位有效数字,CuS和MnS的分别为、)。
宁夏回族自治区银川市西夏区2023-2024学年高一上学期1月期末考试化学试题(含答案): 这是一份宁夏回族自治区银川市西夏区2023-2024学年高一上学期1月期末考试化学试题(含答案),文件包含高一化学期末原卷docx、答案docx等2份试卷配套教学资源,其中试卷共6页, 欢迎下载使用。
宁夏回族自治区银川市西夏区2023-2024学年高二上学期1月期末考试化学试题(含答案): 这是一份宁夏回族自治区银川市西夏区2023-2024学年高二上学期1月期末考试化学试题(含答案),文件包含2023-2024学年度第一学期高二化学期末考试卷docx、参考答案docx等2份试卷配套教学资源,其中试卷共5页, 欢迎下载使用。
宁夏银川市兴庆区2022-2023学年高二下学期期末考试化学试卷(Word版含答案): 这是一份宁夏银川市兴庆区2022-2023学年高二下学期期末考试化学试卷(Word版含答案),文件包含宁夏银川市兴庆区2022-2023学年高二下学期期末考试化学试卷docx、宁夏银川市兴庆区2022-2023学年高二下学期期末考试化学试卷答案docx等2份试卷配套教学资源,其中试卷共9页, 欢迎下载使用。













