
2023年高考第一次模拟考试卷:化学(江苏A卷)(考试版)
展开2023年高考化学第一次模拟考试卷(江苏A卷)
化学
本卷满分100分,考试时间75分钟。
注意事项:
1.答卷前,考生务必将自己的姓名、考生号等填写在答题卡和试卷指定位置上。
2.回答选择题时,选出每小题答案后,用铅笔把答题卡上对应题目的答案标号涂黑。如需改动,用橡皮擦干净后,再选涂其他答案标号。回答非选择题时,将答案写在答题卡上。写在本试卷上无效。
3.考试结束后,将本试卷和答题卡一并交回。
可能用到的相对原子质量:
H 1 C 12 N 14 O 16 S 32 Cr 52 Fe 56 Cu 64 Zn 65 Pb 207
第Ⅰ卷
一、选择题:本题共13小题,每小题3分,共39分。在每小题给出的四个选项中,只有一项符合题目要求.
1. 我国为人类科技发展作出巨大贡献。下列成果研究的物质属于硅酸盐的是
A. 陶瓷烧制 B. 黑火药 C. 造纸术 D. 合成结晶牛胰岛素
2. 实验室制备乙炔的反应为CaC2+2H2O=Ca(OH)2+C2H2↑。下列说法正确的是
A. CaC2的电子式为 B. H2O是非极性分子
C. Ca(OH)2中仅含有离子键 D. C2H2的空间结枃为直线形
3. X、Y、Z、M为原子序数依次增大的四种短周期主族元素,X和Z基态原子L层上均有2个未成对电子,Z与M同主族;W位于第四周期,其基态原子失去3个电子后3d轨道半充满。下列说法正确的是
A. X简单氢化物的沸点高于同主族其它元素
B. Y基态原子核外有5种空间运动状态的轨道
C. 键角:MZ> MZ
D. W位于元素周期表的ds区
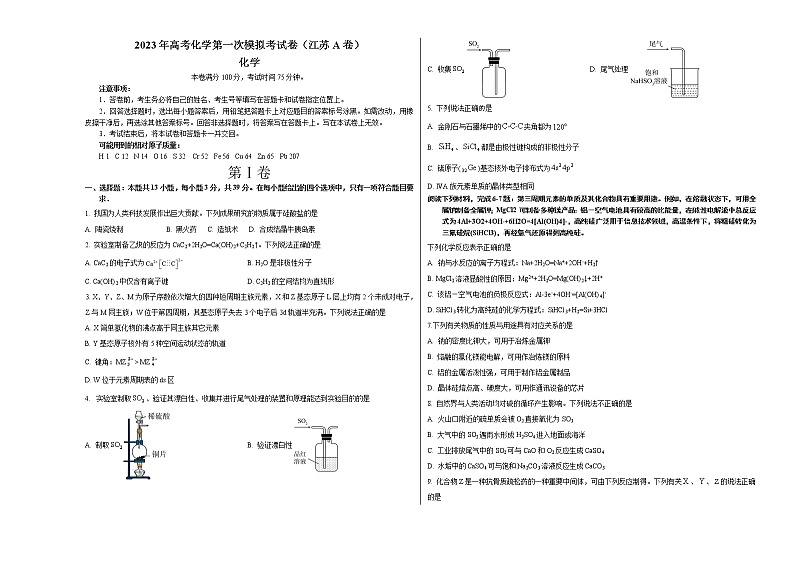
4. 实验室制取、验证其漂白性、收集并进行尾气处理的装置和原理能达到实验目的的是
A. 制取 B. 验证漂白性
C. 收集 D. 尾气处理
5. 下列说法正确是
A. 金刚石与石墨烯中的夹角都为
B. 、都是由极性键构成的非极性分子
C. 锗原子()基态核外电子排布式为
D. ⅣA族元素单质的晶体类型相同
阅读下列材料,完成6-7题:第三周期元素的单质及其化合物具有重要用途。例如,在熔融状态下,可用全属钠制备全属钾;MgCl2可制备多种镁产品:铝-空气电池具有较高的比能量,在碱性电解液中总反应式为4Al+3O2+4OH-+6H2O=4[Al(OH)4]-,高纯硅广泛用于信息技术领域,高温条件下,将粗硅转化为三氟硅烷(SiHCl3),再经氢气还原得到高纯硅。
下列化学反应表示正确的是
A. 钠与水反应的离子方程式:Na+2H2O=Na++2OH-+H2↑
B. MgCl2溶液显酸性的原因:Mg2++2H2O=Mg(OH)2↓+2H+
C. 该铝-空气电池的负极反应式:Al-3e-+4OH-=[Al(OH)4]-
D. SiHCl3转化为高纯硅的化学方程式:SiHCl3+H2=Si+3HCl
7.下列有关物质的性质与用途具有对应关系的是
A. 钠的密度比钾大,可用于冶炼金属钾
B. 熔融的氯化镁能电解,可用作冶炼镁的原料
C. 铝的金属活泼性强,可用于制作铝金属制品
D. 晶体硅熔点高、硬度大,可用作通讯设备的芯片
8. 自然界与人类活动均对硫的循环产生影响。下列说法不正确的是
A. 火山口附近的硫单质会被O2直接氧化为SO3
B. 大气中的SO2遇雨水形成H2SO4进入地面或海洋
C. 工业排放尾气中的SO2可与CaO和O2反应生成CaSO4
D. 水垢中的CaSO4可与饱和Na2CO3溶液反应生成CaCO3
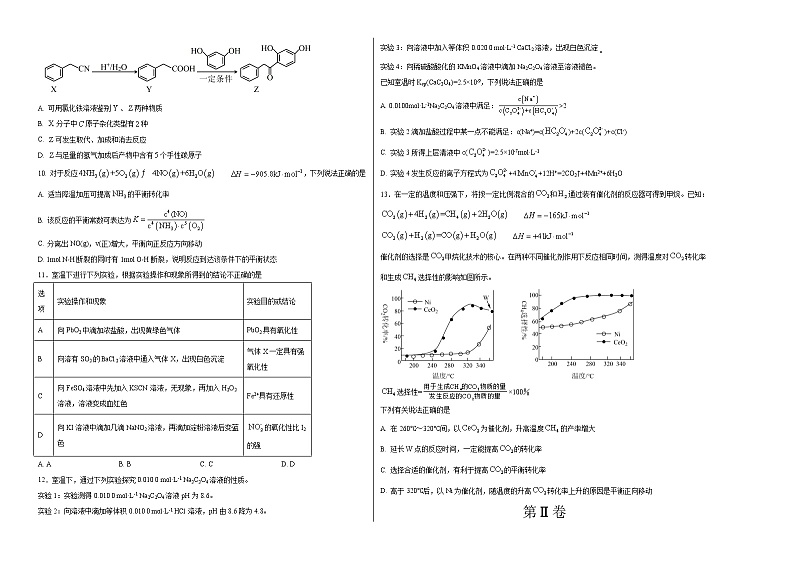
9. 化合物是一种抗骨质疏松药的一种重要中间体,可由下列反应制得。下列有关、、的说法正确的是
A. 可用氯化铁溶液鉴别、两种物质
B. 分子中原子杂化类型有种
C. 可发生取代、加成和消去反应
D. 与足量的氢气加成后产物中含有个手性碳原子
10. 对于反应 ,下列说法正确的是
A. 适当降温加压可提高的平衡转化率
B. 该反应的平衡常数可表达为
C. 分离出NO(g),v(正)增大,平衡向正反应方向移动
D. 1mol N-H断裂的同时有1mol O-H断裂,说明反应到达该条件下的平衡状态
11.室温下进行下列实验,根据实验操作和现象所得到的结论不正确的是
选项 | 实验操作和现象 | 实验目的或结论 |
A | 向PbO2中滴加浓盐酸,出现黄绿色气体 | PbO2具有氧化性 |
B | 向溶有SO2的BaCl2溶液中通入气体X,出现白色沉淀 | 气体X一定具有强氧化性 |
C | 向FeSO4溶液中先加入KSCN溶液,无现象,再加入H2O2溶液,溶液变成血红色 | Fe2+具有还原性 |
D | 向KI溶液中滴加几滴NaNO2溶液,再滴加淀粉溶液后变蓝色 | 的氧化性比I2的强 |
A. A B. B C. C D. D
12.室温下,通过下列实验探究0.010 0 mol·L-1 Na2C2O4溶液的性质。
实验1:实验测得0.010 0 mol·L-1 Na2C2O4溶液pH为8.6。
实验2:向溶液中滴加等体积0.010 0 mol·L-1 HCl溶液,pH由8.6降为4.8。
实验3:向溶液中加入等体积0.020 0 mol·L-1 CaCl2溶液,出现白色沉淀
实验4:向稀硫酸酸化的KMnO4溶液中滴加Na2C2O4溶液至溶液褪色。
已知室温时Ksp(CaC2O4)=2.5×10-9,下列说法正确的是
A. 0.0100mol·L-1Na2C2O4溶液中满足:>2
B. 实验2滴加盐酸过程中某一点不能满足:c(Na+)=c()+2c()+c(Cl-)
C. 实验3所得上层清液中c()=2.5×10-7mol·L-1
D. 实验4发生反应的离子方程式为+4+12H+=2CO2↑+4Mn2++6H2O
13.在一定的温度和压强下,将按一定比例混合的和通过装有催化剂的反应器可得到甲烷。已知:
催化剂的选择是甲烷化技术的核心。在两种不同催化剂作用下反应相同时间,测得温度对转化率和生成选择性的影响如图所示。
选择性=×100%
下列有关说法正确的是
A. 在260℃~320℃间,以为催化剂,升高温度的产率增大
B. 延长W点的反应时间,一定能提高的转化率
C. 选择合适的催化剂,有利于提高的平衡转化率
D. 高于320℃后,以Ni为催化剂,随温度的升高转化率上升的原因是平衡正向移动
第Ⅱ卷
二、非选择题:共4题,共61分。
14.(14分)钴的氧化物常用于制取催化剂和颜料等。以钴矿[主要成分是CoO、Co2O3、Co(OH)3,还含SiO2及少量Al2O3、Fe2O3、CuO及MnO2等]为原料可制取钴的氧化物。
(1)一种钴氧化物晶胞如图1所示,该氧化物中钴离子价电子排布式为_______。
(2)利用钴矿制取钴的氧化物的主要步骤如下:
①浸取:用盐酸和Na2SO3溶液浸取钴矿,浸取液中含有Al3+、Fe2+、Co2+、Cu2+、Mn2+、Cl-、等离子。写出Co2O3发生反应的离子方程式:_______。
②除杂:向浸取液中先加入足量NaClO3氧化Fe2+,再加入NaOH调节pH除去Al3+、Fe3+、Cu2+。有关沉淀数据如下表(“完全沉淀”时金属离子浓度≤1.0×10-5mol·L-1):
沉淀 | Al(OH)3 | Fe(OH)3 | Co(OH)2 | Cu(OH)2 | Mn(OH)2 |
恰好完全沉淀时的pH | 5.2 | 2.8 | 9.4 | 6.7 | 10.1 |
若浸取液中c(Co2+)=0.1 mol·L-1,则须调节溶液pH的范围是_______(加入NaClO3和NaOH时,溶液的体积变化忽略)。
③萃取、反萃取:向除杂后的溶液中,加入某有机酸萃取剂(HA)2,发生反应:Co2++n(HA)2⇌CoA2·(n-1)(HA)2+2H+。实验测得:当溶液pH处于4.5~6.5范围内,Co2+萃取率随溶液pH的增大而增大(如图2所示),其原因是_______。向萃取所得有机相中加入H2SO4,反萃取得到水相。
④沉钴、热分解:向反萃取后得到的水相中加入(NH4)2C2O4溶液,过滤、洗涤、干燥,得到CoC2O4·2H2O晶体。称取14.64 g该晶体,在空气中加热一段时间后,得到CoO和Co3O4的混合物。称量该混合物,质量为6.32 g,通过计算确定该混合物中CoO和Co3O4的质量之比_______(写出计算过程)。
15.(15分)药物萘普生具有较强的抗炎、抗风湿和解热镇痛作用,其合成路线如下:
(1)CH3CH2COCl中碳原子的轨道杂化类型为_______。
(2)E→F的反应类型为 ______。
(3)若省略步骤①和④,则A与CH3CH2COCl反应可生成多种产物,除生成G()外,最可能生成的产物(与G互为同分异构体)的结构简式为________。
(4)C的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式 _______。
①分子中含有萘环();
②分子中含有2个取代基,且取代基在同一个苯环;
③能在NaOH溶液中发生水解,产物中含萘环的分子有5种不同化学环境的氢原子。
(5)已知:RCOOHRCOCl(R为烃基)。根据已有知识并结合相关信息,设计以对二甲苯和HOCH2CH2CH2OH为原料制备的合成路线____(无机试剂和有机溶剂任用,合成路线例见本题题干)。
16.(15分) 以盐湖锂精矿(主要成分为Li2CO3,还含有少量的CaCO3)和盐湖卤水(含一定浓度LiCl和MgCl2)为原料均能制备高纯Li2CO3。
(1)以锂精矿为原料制取碳酸锂的流程如图,其中“碳化溶解”的装置如图所示。
已知:I.20℃时LiOH的溶解度为12.8g。
II.Li2CO3在不同温度下的溶解度:0℃1.54g,20℃1.33g,80℃0.85g。
①装置C中主要反应的化学方程式为____。
②装置C中的反应需在常温下进行,温度越高锂精矿转化速率越小的原因可能是____。保持温度、反应时间、反应物和溶剂的量不变,实验中提高锂精矿转化率的操作有____。
③热解、过滤获得Li2CO3的表面有少量Li2C2O4,未经洗涤也不会影响最终Li2CO3产品的纯度,其原因是____。
(2)设计由盐湖卤水制取高纯Li2CO3的实验方案:向浓缩后的盐湖卤水____。
已知:pH=10时Mg(OH)2完全沉淀。
实验中必须用的试剂:NaOH溶液、Na2CO3溶液、HNO3-AgNO3溶液
17. (17分)含碳化合物资源化综合利用,不仅可减少温室气体的排放,还可重新获得重要工业产品。
(1)工业上可通过甲醇洗基化法制取甲酸甲酯,反应为:
①科研人员对该反应进行了研究,在一定压强时,温度对反应速率的影响如图所示。实际工业生产中采用的温度是,其理由是___________。
②反应过程发生副反应:。该反应的机理分二步完成,可以用如图所示,写出第二步的反应方程式___________。
(2)华盛顿大学的研究人员研究出一种方法,可实现零排放,其基本原理如图所示:反应温度控制在时,电解质为熔融碳酸钠。电解过程中碳元素转化的过程可描述为___________。
(3) 气氛下乙苯催化脱氢制苯乙烯的反应为:+CO2(g) +CO(g)+H2O(g);原料在催化剂面充分吸附进行反应。现保持原料中乙苯浓度不变,增加浓度,乙苯平衡转化率与浓度的关系如图所示,请解释乙苯平衡转化率随着浓度变化的原因___________。
.
2023年高考第一次模拟考试卷:化学(江苏B卷)(参考答案): 这是一份2023年高考第一次模拟考试卷:化学(江苏B卷)(参考答案),共3页。试卷主要包含了选择题等内容,欢迎下载使用。
2023年高考第一次模拟考试卷:化学(江苏B卷)(考试版): 这是一份2023年高考第一次模拟考试卷:化学(江苏B卷)(考试版),共6页。
2023年高考第一次模拟考试卷:化学(江苏A卷)(参考答案): 这是一份2023年高考第一次模拟考试卷:化学(江苏A卷)(参考答案),共3页。试卷主要包含了选择题等内容,欢迎下载使用。












