




2023天津市一中高三上学期第二次月考化学试题含解析
展开天津市第一中学2022-2023学年高上学期第二次月考
化学试题
本试卷分为第I卷(选择题)、第II卷(非选择题)两部分,共100分,考试用时60分钟。考生务必将答案涂写在规定的位置上,答在试卷上的无效。
祝各位考生考试顺利!
相对原子质量:
第I卷
一、选择题(单选,共12题,每题3分,共36分)
1. 下列有关说法正确的是
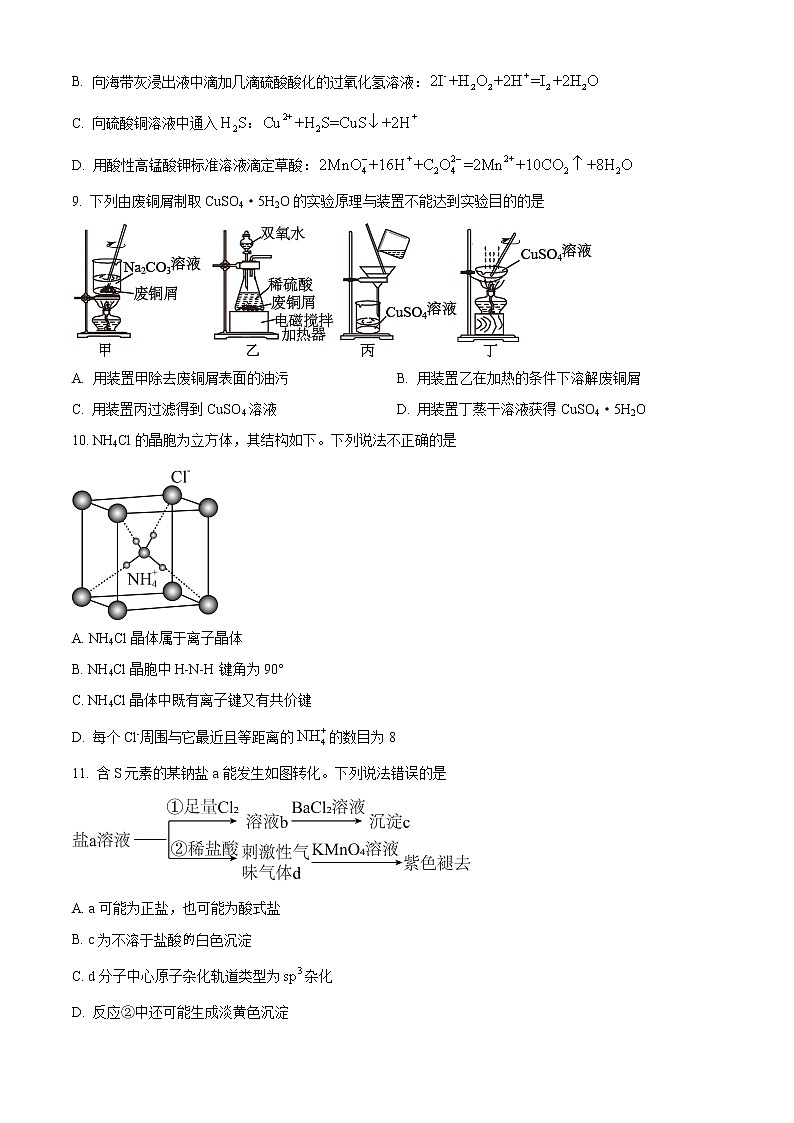
A. 的结构式为
B. 中子数为8的氮原子可表示为
C. 的模型:
D. 的电子式为
【答案】A
【解析】
【详解】A.N2H4分子中两个N原子共用一对电子,每个电子和两个H原子分别共用一对电子,结构式正确,A正确;
B.根据在原子表示中,元素符号左下角为质子数,左上角为质量数,可知该原子可表示为N,B错误;
C.三氧化硫分子中δ键数是3,孤电子对数是0,所以价层电子对数是 3+0=3,空间构型:平面三角型,C错误;
D.NaCl为离子化合物,电子式,D错误;
故答案为:A。
2. “碳中和有利于全球气候改善。下列有关的说法错误的是
A. 是直线形的非极性分子 B. 可被催化氧化为甲酸
C. 晶体可用于人工增雨 D. 是侯氏制碱法的原料之一
【答案】B
【解析】
【详解】A.CO2的中心原子C杂化轨道类型为sp杂化,分子构型为直线形,且正负电荷中心重合,为非极性分子,A正确;
B.CO2中C的化合价为+4价,HCOOH中C的化合价为+2价,CO2催化生成HCOOH是还原反应,不是氧化反应,B错误;
C.CO2晶体(干冰)升华时吸收大量热,可使空气中水蒸气凝结为水珠,能用于人工降雨,C正确;
D.候氏制碱法以饱和氯化钠溶液、氨气、二氧化碳为原料制得碳酸氢钠,反应式为,再热分解碳酸氢钠可制得碳酸钠(纯碱),反应式为,D正确;
故选B。
3. 与在碱性溶液中可以发生反应:下列有关说法错误的是
A. 与均可用作杀菌剂、漂白剂
B. 与晶体中阴阳离子个数比值不同
C. 、、离子半径:
D. 反应中有离子键的断裂与形成
【答案】C
【解析】
详解】A.与均具有强氧化性,均可用作杀菌剂、漂白剂,A正确;
B.中阴阳离子个数比为1:2,而中阴阳离子个数比为1:1,B正确;
C.先看电子层,氯离子的电子层最多,氯离子半径最大,钠离子和氧离子电子层数相同,看原子序数,原子序数越小离子半径越大,所以,氧离子的半径大于钠离子的,C错误;
D.反应中过氧化钠中离子键断裂,生成物中形成了中的离子键,反应中有离子键的断裂与形成,D正确;
故本题选C。
4. W、X、Y、Z为原子序数依次增大的短周期主族元素,Y的原子序数等于W与X的原子序数之和,Z是地壳中含量最丰富的金属元素,W与X可形成原子个数比2∶1的分子,下列说法正确的是
A. X与Z能形成耐高温的无机材料
B. 简单离子半径Z>X>Y
C. 由W、X、Y三种元素所组成的化合物的水溶液均显酸性
D. 非金属性:X>Y>W
【答案】A
【解析】
【分析】W、X、Y、Z为原子序数依次增大的短周期主族元素,Z是地壳中含量最丰富的金属元素,Z是Al元素;W与X可形成原子个数比为2∶1的18e-分子,则形成的化合物为N2H4,W是H元素、X是N元素;Y的原子序数等于W与X的原子序数之和,Y是O元素,据此分析解答。
【详解】A.X是N元素,Z是Al元素,可形成AlN,可作耐高温的无机材料,A正确;
B.电子层数相同,核电荷数越大,离子半径越小,核电荷数Al>O>N,则离子半径:r(N3-)>r(O2-)>r(Al3+),B错误;
C.H、N、O组成的化合物NH3·H2O的水溶液呈碱性,C错误;
D.X是N元素,Y是O元素,W是H元素,非金属性:O>N>H,D错误;
答案选A。
5. 下列说法正确的是
A. 石墨中的碳原子呈杂化,是混合型晶体
B. 4.6g乙醇分子中含有共价键数为(为阿伏加德罗常数)
C. 和结构相似,但硫化氢晶体中,一个周围有12个紧邻的分子,而冰中一个周围只有4个紧邻的分子
D. 臭氧分子是由非极性键形成的非极性分子
【答案】C
【解析】
【详解】A.石墨单层原子为平面形结构,C原子为sp2杂化,A错误;
B.4.6g乙醇的物质的量为=0.1mol,每个乙醇分子中含8条共价键,因此共价键数目为0.8NA,B错误;
C.H2S分子间为范德华力,晶体堆积为最密堆积,每个H2S周围有12个紧邻的分子,而冰中水分子间有氢键,每个H2O周围只有4个紧邻的分子,C正确;
D.O3分子中O与O之间为非极性键,但由于正负电荷中心不重合,为极性分子,D错误;
故选C。
6. 在特定碱性条件下,过量可将完全氧化成,其反应为(未配平),下列有关说法错误的是
A. W为
B. 上述反应中氧化剂和还原剂的物质的量之比为
C. 参加反应时,转移电子的物质的量为2mol
D. 在酸性条件下可以转化为
【答案】D
【解析】
【分析】H2O2中氧元素化合价由-1降低为-2,中Cr元素化合价由+3升高为+6,根据得失电子守恒、电荷守恒,反应的离子方程式为。
【详解】A.据得失电子守恒、电荷守恒,反应的离子方程式为,W为,故A正确;
B.H2O2中氧元素化合价由-1降低为-2,H2O2是氧化剂,中Cr元素化合价由+3升高为+6,是还原剂,根据得失电子守恒,氧化剂和还原剂的物质的量之比为,故B正确;
C.H2O2中氧元素化合价由-1降低为-2,参加反应时,转移电子的物质的量为2mol,故C正确;
D.有可逆反应:+H2O2+2H+,加碱,平衡正向移动,所以在碱性条件下可以转化为,故D错误;
选D。
7. 下表为某短周期元素R的各级电离能数据(用I1、I2、I3……表示,单位)。下列关于元素R的判断正确的是
元素
……
R
738
1451
7733
10540
13630
……
A. R元素同周期相邻元素的第一电离能均小于
B. R元素位于元素周期表的ⅢA族
C. R元素位于元素周期表的p区
D. R元素基态原子的轨道表示式:
【答案】A
【解析】
【分析】短周期元素R的第一电离能和第二电离能较小,第三电离能远大于第二电离能,说明该原子最外层有2个电子,处于IIA族,该原子存在第五电离能,说明核外电子数数目
大于4,故R为Mg元素,位于第三周期第IIA族。
【详解】A.同周期元素的第一电离能:IIA族>IIIA族>IA族,故R元素同周期相邻元素的第一电离能均小于738kJ·mol-1,故A正确;
B.Mg元素处于IIA族,B错误;
C.Mg元素处于IIA族,为s区,C错误;
D.Mg元素基态原子的轨道表示式为,D错误;
故答案选A。
8. 下列实验所涉及反应的离子方程式错误的是
A. 过氧化钠与水反应:
B. 向海带灰浸出液中滴加几滴硫酸酸化的过氧化氢溶液:
C. 向硫酸铜溶液中通入
D. 用酸性高锰酸钾标准溶液滴定草酸:
【答案】D
【解析】
【详解】A.过氧化钠与水反应生成强氧化钠和氧气,A正确;
B.碘离子与过氧化氢发生氧化还原,B正确;
C.硫酸铜溶液中通入 H2S,发生复分解反应,C正确;
D.草酸为弱酸,不能拆,,D错误;
故答案为:D。
9. 下列由废铜屑制取CuSO4·5H2O的实验原理与装置不能达到实验目的的是
A. 用装置甲除去废铜屑表面的油污 B. 用装置乙在加热的条件下溶解废铜屑
C. 用装置丙过滤得到CuSO4溶液 D. 用装置丁蒸干溶液获得CuSO4·5H2O
【答案】D
【解析】
【分析】
【详解】A.碳酸钠溶液显碱性,在加热的条件下可以除去铜屑表面的油污,A正确;
B.在酸性条件下,铜与双氧水发生氧化反应得到硫酸铜,B正确;
C.装置丙为过滤装置,过滤可以除去难溶杂质,得到硫酸铜溶液,C正确;
D.用装置丁蒸干溶液得到硫酸铜固体,而不是CuSO4·5H2O,D错误;
答案选D。
10. NH4Cl的晶胞为立方体,其结构如下。下列说法不正确的是
A. NH4Cl晶体属于离子晶体
B. NH4Cl晶胞中H-N-H键角为90°
C. NH4Cl晶体中既有离子键又有共价键
D. 每个Cl-周围与它最近且等距离的的数目为8
【答案】B
【解析】
【详解】A.氯化铵由铵根离子和氯离子构成,为离子晶体,A正确;
B.铵根离子中N原子杂化方式为sp3杂化,键角为109。28',B错误;
C.NH4Cl晶体中铵根和氯离子之间为离子键,氮原子和氢原子之间为共价键,C正确;
D.根据晶胞结构可知每个Cl-周围与它最近且等距离的铵根离子的数目为8,在周围八个立方体体心位置,D正确;
故选B
11. 含S元素的某钠盐a能发生如图转化。下列说法错误的是
A. a可能为正盐,也可能为酸式盐
B. c为不溶于盐酸的白色沉淀
C. d分子中心原子杂化轨道类型为杂化
D. 反应②中还可能生成淡黄色沉淀
【答案】C
【解析】
【分析】由框图可知该钠盐有还原性,可被氯气氧化生成硫酸钠,硫酸钠与氯化钡反应生成硫酸钡沉淀,且该盐溶液与稀盐酸反应生成有还原性的刺激性气味气体,该气体为二氧化硫,综上可推得该盐可能为亚硫酸钠、亚硫酸氢钠或者硫代硫酸钠。
【详解】A.由框图可知a中含S的酸根有还原性,且能被氯气氧化生成硫酸根,则a可以为正盐,如亚硫酸盐,也可以为酸式盐,如亚硫酸氢钠,A正确;
B.a溶液与氯气反应生成的溶液b为酸性,溶液b与氯化钡反应生成不溶于酸的沉淀,则沉淀应为硫酸钡,B正确;
C.由框图中信息可得气体d为二氧化硫,分子构型为V形,其中心原子S的杂化轨道类型为sp2杂化,C错误;
D.若a为硫代硫酸钠,则与盐酸的反应为,出二氧化硫外还生成淡黄色的硫单质,D正确;
故选C。
12. 向盛有硫酸铜溶液的试管里加入氨水,首先形成难溶物,继续添加氨水,难溶物溶解得到深蓝色的透明溶液。下列对此现象的说法中,正确的是
A. 反应后溶液中没有沉淀,所以反应前后Cu2+的浓度不变
B. 沉淀溶解后,将生成深蓝色的配离子为
C. 在中,Cu2+给出孤对电子,NH3提供空轨道
D. 向反应后的溶液加入乙醇,溶液没有发生任何变化,因为不与乙醇发生反应
【答案】B
【解析】
【分析】向硫酸铜溶液中加入氨水,氨水先和硫酸铜反应生成氢氧化铜蓝色沉淀,离子方程式为Cu2++2NH3•H2O═Cu(OH)2↓+2NH,继续添加氨水,氨水和氢氧化铜反应生成深蓝色的配离子[Cu(NH3)4]2+,离子方程式为Cu(OH)2+4NH3═[Cu(NH3)4]2++2OH-,在[Cu(NH3)4]2+离子中,Cu2+提供空轨道,NH3给出孤对电子,以此分析解答。
【详解】A.铜离子和氨水先生成氢氧化铜沉淀,氢氧化铜再和氨水能反应生成配合离子[Cu(NH3)4]2+,所以反应后Cu2+的浓度减小,故A错误;
B.氢氧化铜沉淀溶解的离子反应为Cu(OH)2+4NH3═[Cu(NH3)4]2++2OH-,则生成深蓝色的配离子为[Cu(NH3)4]2+,故B正确;
C.在[Cu(NH3)4]2+离子中,Cu2+提供空轨道,NH3给出孤对电子,故C错误;
D.[Cu(NH3)4]SO4在乙醇中的溶解度小于在水中的溶解度,所以向溶液中加入乙醇后因为溶解度减小,析出蓝色晶体[Cu(NH3)4]SO4,故D错误;
故选B
第II卷 (共64分)
二、简答题
13. 请回答下列问题
(1)钴及其化合物有重要的用途,探究其结构有重要意义。
①按照核外电子排布,可把元素周期表划分为5个区,Co在元素周期表中属于_______区。
②下列状态的钴中,电离最外层一个电子所需能量最大的是_______(填标号)
A. B. C. D.
(2)是的一种重要配合物。
①该配合物的一种配体是,的空间结构呈_______形,是_______(填“极性”或“非极性)分子。
②的价层电子轨道表示式是_______。该配合物中参与杂化的6个能量相近的空轨道分别是2个3d轨道、1个4s轨道和3个_______轨道。
③设计实验证实该配合物溶于水时,离子键发生断裂,配位键没有断裂。实验如下:称取2.505g该配合物,先加水溶解,再加足量溶液,_______(补全实验操作和数据)。相对分子质量
(3)第VA族元素及其化合物的结构和性质如下
①N基态原子核外电子排布式为_______。
②的沸点由高到低的顺序为_______(填化学式,下同),键角由大到小的顺序为_______。
③某一种氮化硼晶体的立方晶胞结构如下图:
氮化硼(BN)属于_______晶体。该种氮化硼(BN)的熔点_______SiC。(填>、<、=)
【答案】(1) ①. d ②. A
(2) ①. 三角锥 ②. 极性 ③. ④. 4p ⑤. 过滤,沉淀称重2.87g
(3) ①. 1s22s22p3 ②. NH3、AsH3、PH3 ③. NH3、PH3、AsH3 ④. 共价 ⑤. >
【解析】
【小问1详解】
①Co元素位于第四周期第Ⅷ族,根据元素周期表的分区在d区;②基态Co原子的电子排布为,和状态的Co电子能量均高于基态原子的,故电离最外层的1个电子所需的能量也小于基态Co的第一电离能I1,而状态的Co,其4s轨道为半满结构,能量更低,所需电离能也更大,故选A;
【小问2详解】
①NH3的中心原子N为sp3杂化,NH3分子构型为三角锥形,其正负电荷中心不重叠,为极性分子;②基态Co的价电子排布为3d74s2,失去3个电子后有3d能级的轨道有6个电子,价电子电子排布图为。4p能级有3个轨道,参与杂化形成sp3d2杂化轨道;③2.505g该配合物的物质的量为,配合物溶于水只有离子键断裂,则溶液中氯离子的物质的量为0.02mol,加入硝酸银生成的氯化银沉淀为0.02mol,氯化银的质量为,故后续操作与数据为过滤沉淀,称重,沉淀质量为2.87g;
【小问3详解】
①N为第二周期第ⅤA族元素,电子排布式为1s22s22p3;②三者均为分子晶体,熔沸点高低主要由范德华力影响,相对分子质量越大,范德华力越大,熔沸点越高,而NH3分子之间会生成氢键,沸点高于PH3和AsH3,故沸点大小为NH3>AsH3>PH3。三种化合物中心原子均为sp3杂化,分子为三角锥性,且中心原子电负性N>P>As,电负性越大,成键电子对偏向中心原子,电子对之间的排斥力越大,键角越大,故键角大小为:NH3>PH3>AsH3;③BN晶体与SiC晶体均为为共价晶体,共价晶体熔沸点由共价键键能决定,键长越短键能越大,B、C、N均为第二周期的元素 ,其原子半径小于位于第三周期的Si原子,故B—N键键长小于Si—C键键长,则BN晶体熔点高于SiC熔点。
14. 青蒿素()是治疗疟疾的有效药物,白色针状晶体,溶于乙醇和乙醚,对热不稳定。青蒿素晶胞(长方体,含4个青蒿素分子)及分子结构如下图所示。
(1)提取青蒿素
在浸取、蒸馏过程中,发现用沸点比乙醇低的乙醚()提取,效果更好。乙醇的沸点高于乙醚,原因是_______。
(2)确定结构
①图中晶胞的棱长分别为,晶体的密度为_______。(用表示阿伏加德罗常数,青蒿素的相对分子质量为282)
②能确定晶体中哪些原子间存在化学键、并能确定键长和键角,从而得出分子空间结构的一种方法是_______。
a.质谱法 b.X射线衍射 c.核磁共振氢谱 d.红外光谱
(3)修饰结构,提高疗效
一定条件下,用将青蒿素选择性还原生成双氢青蒿素。
(双氢青蒿素)
①双氢青蒿素分子中碳原子的杂化轨道类型为_______。
②的空间结构为_______。
双氢青蒿素比青蒿素水溶性更好,治疗疟疾的效果更好。
【答案】(1)乙醇分子间能形成氢键
(2) ①. ②. b
(3) ①. sp3 ②. 正四面体
【解析】
【小问1详解】
乙醇分子中含有O-H键,乙醇分子间能形成氢键,所以乙醇的沸点高于乙醚。
【小问2详解】
①图中晶胞的棱长分别为,则晶胞的体积为,晶体的密度为。
②X射线衍射能测定原子的空间位置,所以X射线衍射能确定晶体中哪些原子间存在化学键、并能确定键长和键角,从而得出分子空间结构,选b。
【小问3详解】
①根据双氢青蒿素分子的结构简式,可知碳原子全是单键碳,C原子形成4个σ键,有个杂化轨道,杂化轨道类型为sp3。
②中B原子的价电子对数为,无孤电子对,空间结构为正四面体。
15. 某废旧金属材料中主要含和可燃性有机物,为节约和充分利用资源,通过如下工艺流程回收、绿矾等。回答下列问题:
(1)“焙烧”的目的主要是将金属单质转化为氧化物,并除去_______。
(2)“碱浸时发生反应的化学方程式为_______。
(3)操作I、Ⅱ中使用的仪器除烧杯、玻璃棒外还需要的玻璃仪器是_______。
(4)试剂a为_______(填化学式),加入试剂a后发生的化学反应中有一个属于化合反应,其离子方程式为_______。
(5)滤液Ⅱ制取绿矾晶体需先加入少量稀硫酸再经过_______、冷却结晶、过滤、洗涤、干燥得到绿矾晶体。
(6)绿矾在空气中容易被部分氧化为硫酸铁,现取被部分氧化为硫酸铁晶体8.22g溶于稀盐酸后,加入足量的溶液,过滤得沉淀9.32g;再通入112mL (标准状况)氯气恰好将其中的完全氧化。
①为确定绿矾未被全部氧化,可选择的最佳试剂是_______(填标号)。
A. B.溶液 C.溶液 D.溶液
②推测晶体中_______。
【答案】(1)可燃性有机物
(2)
(3)漏斗 (4) ①. Fe ②.
(5)蒸发浓缩 (6) ①. D ②. 1:2
【解析】
【分析】废旧金属材料中主要含Fe、Cu、Al、FeO、FeO、A12O3、CuO和可燃性有机物,焙烧,可除去有机物,同时将金属单质转化为氧化物,加入氢氧化钠溶液“碱浸”,可得到偏铝酸钠溶液,滤液I为偏铝酸钠,可用于提取铝,滤渣I含有铁的氧化物和铜的氧化物,加入硫酸“酸浸”,可生成硫酸亚铁、硫酸铁、硫酸铜,试剂a为铁,可用于除去硫酸铜,并与硫酸铁反应生成硫酸亚铁,得到滤液Ⅱ为硫酸亚铁,滤渣Ⅱ为Fe、Cu,加入硫酸酸浸,Cu不与硫酸反应,过滤得到铜,滤液Ⅱ蒸发浓缩、冷却结晶得到绿矾。
【小问1详解】
“焙烧”的目的主要是将金属单质转化为氧化物,并将可燃有机物在氧气中燃烧而除去。答案:可燃有机物;
【小问2详解】
焙烧后成分为铁的和铝的氧化物,碱浸时氧化铝溶于氢氧化钠,反应的化学方程式为,答案:。
【小问3详解】
操作Ⅰ、Ⅱ均为过滤,使用的仪器除烧杯、玻璃棒外还需要的玻璃仪器是漏斗,答案为:漏斗;
【小问4详解】
为了保证最后得到的晶体为纯净的硫酸亚铁,在滤液Ⅰ中需要加入的试剂a为铁粉,可能发生反应的离子方程式为Fe+2Fe3+=3Fe2+、Fe+2H+ = Fe2+ +H2↑、
Fe+Cu2+=Fe2++Cu,属于化合反应的是Fe+2Fe3+=3Fe2+。答案为:Fe;Fe+2Fe3+=3Fe2+;
小问5详解】
滤液Ⅱ蒸发浓缩、冷却结晶得到绿矾,过滤、洗涤、干燥得到绿矾晶体,故答案为:蒸发浓缩;
【小问6详解】
为确定绿矾未被全部氧化,可以检验是否有残余的亚铁离子,检验时要注意排除Fe3+对Fe2+检验单干扰,取少量被氧化的绿矾溶于水,再加入溶液,若有蓝色沉淀生成,则证明绿矾没有被完全氧化。由题意可知:晶体中 的物质的量为,消耗氯气的物质的量,根据,晶体中含,根据 ,代入数据,解得,,则1∶2。
16. 次氯酸(HClO)的浓溶液呈黄色,是极强氧化剂,常用作消毒剂及除甲醛(HCHO)的试剂。某学习小组设计下列装置制备HClO并验证其氧化性(夹持仪器及降温装置已省略)。已知:为棕黄色气体,极易溶于水并迅速反应生成HClO。
回答下列问题:
(1)HClO的结构式为_______,仪器a的名称为_______。
(2)制备HClO时要打开活塞,关闭,待装置A中反应结束时再通入一段时间。
①仪器C中制备时,发生反应为,仪器B、D中的试剂分别为_______(填字母)。
a.浓 b.饱和食盐水、 c.饱和食盐水、浓
②反应结束后再通入一段时间的目的是_______。
(3)验证HClO的氧化性时要向F中加入过量HClO并充分搅拌,待溶液变澄清时停止搅拌。反应结束时,F的溶液中含有的离子主要有,该反应的离子方程式为_______。
(4)HClO可用于除去HCHO,生成一种常见强酸和两种常见无污染的氧化物。
①该反应的化学方程式为_______。
②若除去15gHCHO,则转移电子的个数为_______(表示阿伏加德罗常数)。
【答案】(1) ①. H-O-Cl ②. 三颈烧瓶
(2) ①. b ②. 使体系中的Cl2及Cl2O被充分吸收,防止干扰后续实验
(3)2FeS2+15HClO+H2O=2Fe3++15Cl-+4SO+17H+
(4) ①. HCHO+2HClO=2HCl+CO2+H2O ②. 2
【解析】
【分析】通过氮气将装置中空气排尽, A 中浓盐酸和酸性高锰酸钾溶液反应生成Cl2,浓盐酸具有挥发性,得到的Cl2中含有 HCl,HCl 能和碳酸钠反应,所以 B 装置用于除去 HCl,C 装置制备Cl2O, D 装置用于除去多余的Cl2, E 中Cl2O和水反应生成 HClO ,HClO 具有强氧化性,反应结束时, F 的溶液中含有的离子主要有,说明 HClO 和FeS2反应生成,据此分析。
【小问1详解】
HClO 中 H 、 Cl原子各形成1个共价键,O原子形成2个共价键则 HClO 的结构式为: H-O-Cl,仪器 a 的名称为三颈烧瓶;
故答案为: H -O-Cl;三颈烧瓶;
【小问2详解】
仪器 C 中制备Cl2O时,根仪器 B 的作用是除去 HCl ,用饱和的食盐水;仪器 D 的作用是除去Cl2,氯气易溶于有机溶剂四氯化碳,所以 B 、 D 中药品分别是饱和食盐水、CCl4,
故答案为: b ;
Cl2 、Cl2O都具有强氧化性,而干扰HClO 和FeS2的反应,所以反应结束后再通入一段时间 N2 的目的是使体系中的Cl2 、Cl2O 被充分吸收,防止干扰后续实验;
故答案为:使体系中的Cl2 、Cl2O被充分吸收,防止干扰后续实验;
【小问3详解】
HClO 具有强氧化性,反应结束时, F 的溶液中含有的离子主要有,说明 HClO 和FeS2反应生成 ,该反应的离子方程式为:2FeS2+15HClO+H2O=2Fe3++15Cl-+4SO+17H+
故答案为:2FeS2+15HClO+H2O=2Fe3++15Cl-+4SO+17H+
【小问4详解】
①次氯酸具有强氧化性,能氧化甲醛,结合已知生成一种常见强酸和两种常见无污染的氧化物,产物为二氧化碳、盐酸、水,故该反应的化学方程式为:HCHO+2HClO=2HCl+CO2+H2O
故本题的答案为:HCHO+2HClO=2HCl+CO2+H2O
②根据上述反应方程式,除去1molHCHO的质量为30g,转移的电子数为4NA,15gHCHO转移的电子数为2NA,故答案为:2NA。
2024六安一中高三上学期第二次月考化学试题含解析: 这是一份2024六安一中高三上学期第二次月考化学试题含解析,文件包含安徽省六安第一中学2023-2024学年高三上学期第二次月考化学试题含解析docx、安徽省六安第一中学2023-2024学年高三上学期第二次月考化学试题无答案docx等2份试卷配套教学资源,其中试卷共28页, 欢迎下载使用。
2022-2023学年天津市第一中学高三上学期第一次月考化学试题含解析: 这是一份2022-2023学年天津市第一中学高三上学期第一次月考化学试题含解析,共24页。试卷主要包含了1ml/L醋酸溶液中,8gNa2O2中含有0, 已知氧化性Br2>Fe3+等内容,欢迎下载使用。
2022-2023学年天津市第一中学高三上学期第一次月考化学试题含解析: 这是一份2022-2023学年天津市第一中学高三上学期第一次月考化学试题含解析,共24页。试卷主要包含了1ml/L醋酸溶液中,8gNa2O2中含有0, 已知氧化性Br2>Fe3+等内容,欢迎下载使用。













