

初中化学中考复习 专题四工业流程图题-2020九年级中考化学复习讲义
展开专题四 工业流程图
一、技巧方法
1.解题策略和步骤
(1)阅读题头和题尾,明确初始原料是什么,需要制备的产品是什么,搞清楚流程的目的。
(2)粗看题干流程,找出关键词,思考转化关系。
①关注加入的试剂用量、发生的反应、产生的物质,搞清楚每一步流程的目的。
②关注产物的特征(如是否形成溶液等),确定提纯或分离的方法。
③了解常用的提纯或分离方法(如溶解、过滤、蒸发结晶、降温结晶等)的适用范围。
(3)纵观全局,整合信息,抓住重点,分析解答,精准答题。
2.解题规律[来源:学§科§网]
(1)关注箭头:进入的箭头(①)是投料(即反应物),出去的箭头(②)是生成物(包括主产物和副产物)。往回的箭头(③)表示物质可循环利用。
(2)关注成分:对流程中各物质的成分分析,要考虑生物的物质以及过量的投料(即反应物),过量的反应物通常需要除去。
(3)关注流程方案的设计及评价:若涉及多种方案的评价,一般从流程有无污染、原料利用率高低、成本高低、流程的繁简、操作的难易程度等方面综合考虑。
二、常考类型
类型一 除杂、提纯类
【真题回顾】
1.(2017长沙中考)为了将混有硫酸钾、氯化钙、碳酸氢铵(不稳定,受热易分解生成氨气、二氧化碳和水)的氯化钾提纯,并制得纯净的氯化钾溶液,某同学设计的实验流程如下:
请根据以上流程图中的信息,回答下列问题:
(1)步骤①中除去碳酸氢铵的方法是___________________________。
(2)步骤④中加过量碳酸钾溶液的目的是_______________________________________。
(3)此设计方案是否严谨?并说明理由________________________________________________。
2.(2016长沙中考)海水晒盐工业流程中,得到的粗盐常含有MgCl2、CaCl2等杂质,工业提纯粗盐的流程如图所示:
(1)步骤④操作a中需要用到玻璃棒,玻璃棒的作用是 ;
(2)步骤⑥中操作b的名称是: ;
(3)如果将步骤②和步骤③的顺序颠倒,则所制得的精盐水中还含有 。
【精选习题】
1.某粗盐样品中除含有泥沙等不溶性固体杂质外,还含有少量MgCl2、CaCl2、Na2SO4三种可溶性杂质,我校初三化学兴趣小组的同学在实验室完成的对粗盐提纯的实验,流程如下:
(1)操作A的名称是________________;
(2)步骤⑧蒸发结晶时,玻璃棒的作用是______________________________;
(3)若将步骤④和步骤⑤交换,所得的精盐中可能混有的杂质为____________(填化学式)。
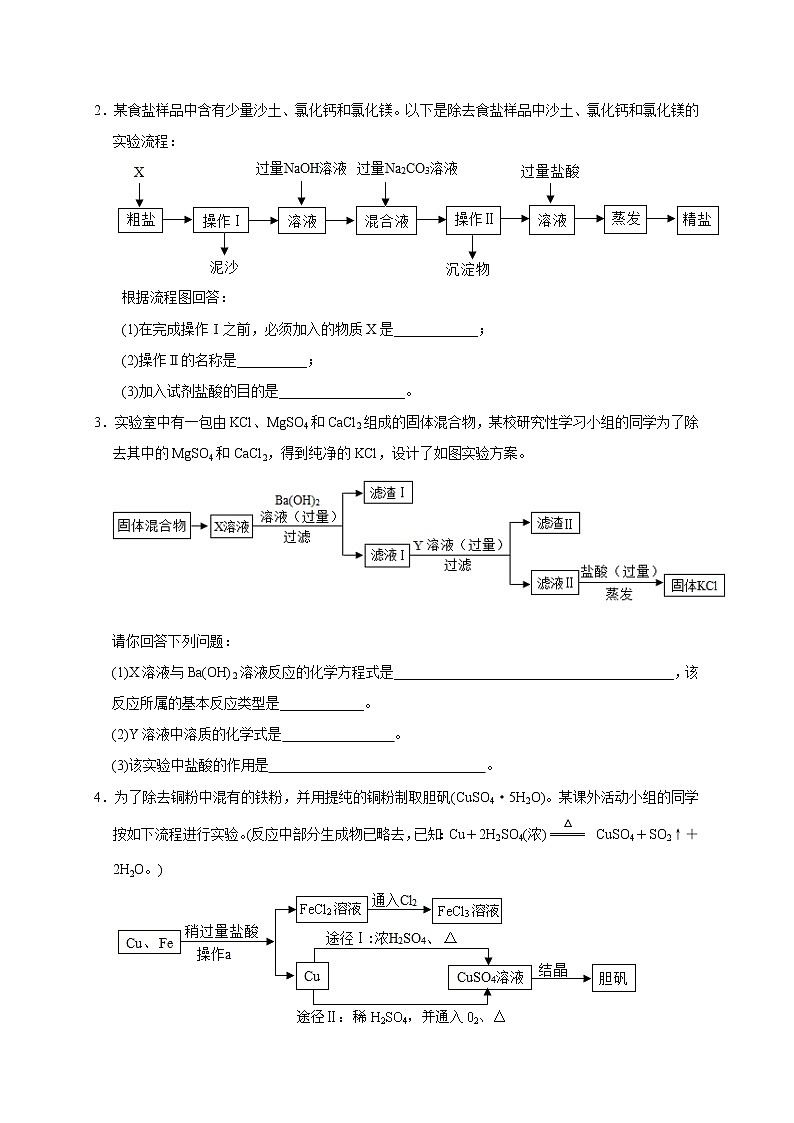
2.某食盐样品中含有少量沙土、氯化钙和氯化镁。以下是除去食盐样品中沙土、氯化钙和氯化镁的实验流程:
根据流程图回答:
(1)在完成操作Ⅰ之前,必须加入的物质X是____________;
(2)操作Ⅱ的名称是__________;
(3)加入试剂盐酸的目的是__________________。
3.实验室中有一包由KCl、MgSO4和CaCl2组成的固体混合物,某校研究性学习小组的同学为了除去其中的MgSO4和CaCl2,得到纯净的KCl,设计了如图实验方案。
请你回答下列问题:
(1)X溶液与Ba(OH)2溶液反应的化学方程式是________________________________________,该反应所属的基本反应类型是____________。
(2)Y溶液中溶质的化学式是 。
(3)该实验中盐酸的作用是 。
4.为了除去铜粉中混有的铁粉,并用提纯的铜粉制取胆矾(CuSO4·5H2O)。某课外活动小组的同学按如下流程进行实验。(反应中部分生成物已略去,已知:Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O。)
回答下列有关问题:
(1)操作a的名称是__________;除去铜粉中的铁粉,最简便的实验方法是________________。
(2)由Cu制CuSO4 溶液的途径Ⅱ中,若不通入O2,反应将不会发生,原因是
。
(3)途径Ⅱ与途径Ⅰ相比较,其显著的优点是____________________________(回答一点即可)。
5.化工生产中需要对原料提纯,以利于提高产品质量。经测定某氯化钠样品中混有硫酸钠,为了除去杂质并制得纯净的氯化钠固体,某学生设计方案如下:
回答下列问题:
(1)操作⑤的名称是 。
(2)操作③的目的是 。
(3)此设计方案是否严密,说明理由 。
6.氯化钠是日常生活中的必需品,某氯化的样品中除含氯化钠外,还含有少量的CaCl2和MgCl2以及不溶性杂质。以下是提纯该样品的操作流程图。请回答下列问题:[来源:Zxxk.Com]
(1)操作X的名称是 ;
(2)Y溶液中溶质的化学式是 ;
(3)加入过量NaOH、Na2CO3的目的是 。
类型二 混合物成分确定类
【真题回顾】
1.(2019长沙中考)垃圾回收、分类的关键:确定垃圾的成分,是对垃圾进行分类的的前提。某校化学实验室收集到一包固体废弃物,可能是由碳、镁、氧化镁、氧化铜中的一种或几种组成。为了确定其成分,在老师的指导下,同学们取样进行了如下实验:
(1)气体A是 。
(2)由固体B得到气体C的反应属于 (填基本反应类型)。
(3)原样品中一定含有的物质是 。
2.(2018长沙中考)我市教育主管部门为了让同学们过好传统佳节——端午节,特意将中考提前一天。化学兴趣小组的同学们为庆祝端午节,决定自己动手制作传统食品——皮蛋。制作皮蛋料泥的原料主要有:生石灰、纯碱、草木灰(含K2CO3)等。将它们按一定比例混合加入适量水得到皮蛋料泥。料泥的主要成分是什么呢?同学们进行了如图所示的探究:
(1)步骤②的操作所需的玻璃仪器有:烧杯、玻璃棒、 ;
(2)步骤③的现象说明滤渣中一定含有的物质为: ;
(3)由上述实验现象推断,滤液中的溶质一定含有: 。
【精选习题】
1.有一包白色固体,可能含氯化钠、碳酸钠、硫酸钠、氢氧化钠、氢氧化钡中的一种或几种。某兴趣小组为探究其成分做了以下实验:
实验一:探究固体的组成
(1)向固体样品中加入过量稀硝酸,产生的气体是 。
(2)原固体中一定不含有的物质是 。
实验二:进一步探究固体中是否含氯化钠
得出结论:原固体中一定含NaCl。
(3)试剂X是 溶液。
(4)滤液C中除含Fe(NO3)3外,一定还含有的溶质是 。
2.实验室有一包粉末状物质。可能是氯化钠、硫酸钠、碳酸钠、氯化铁中的一种或几种组成,为了确定原粉末的成分,某校化学兴趣小组的同学,按图所示进行实验:
(1)操作Ⅰ的名称是 。
(2)该粉末中一定不含 ,
(3)为了不干扰对第③步实验现象的判断,试剂B最好选择 ,加入试剂B要过量的原因是:
。
类型三 新物质制取类
【精选习题】
1.碳酸亚铁(FeCO3)可用于制作补铁药物,以下是用硫铁矿烧渣(主要成分为Fe2O3、SiO2等)为原料制备碳酸亚铁的生产流程示意图:
【资料】40 ℃以上时,(NH4)2CO3易分解。
(1)操作Ⅰ的名称为________。
(2)写出向固体A中加入稀硫酸后发生反应的化学方程式:______________________________。
(3)加入(NH4)2CO3后,该反应必须控制的条件是:________________。
(4)从溶液C中可回收一种化工产品,请写出它的一种用途______________。
2.保险粉(化学式Na2S2O4)在工农业生产中有广泛的用途,Na2S2O4在碱性溶液中稳定,在中性和酸性溶液中极不稳定;在NaCl存在的条件下,Na2S2O4在水中的溶解度显著下降。Na2S2O4制备流程如图所示:
(1)反应Ⅰ的原理为Zn+2SO2=== ZnS2O4,该反应类型为____________;
(2)操作a的名称为________;
(3)滤液中含有Na2S2O4,往溶液中加入NaCl和少量的NaOH的原因是
。
3.现有工厂丢弃的废铜屑(铜屑表面呈绿色,其中混有少量生锈铁屑)。课外活动小组同学欲利用其制取胆矾,他们设计了下面两种制取流程。已知Cu+Fe2(SO4)3=== 2FeSO4+CuSO4。请回答:
(1)操作①所用到的玻璃仪器有:烧杯、玻璃棒和 。
(2)溶液A的溶质除了过量硫酸外还有 两种。
(3)两种方法比较,符合绿色化学要求的是________________。
4.侯德榜是我国著名的化学家,为纯碱和氮肥工业技术的发展做出了杰出的贡献。他发明的侯氏制碱法大大提高了原料的利用率,其工艺流程大致如图所示:
(1)上述流程中,用到的原料有空气、焦炭、水、二氧化碳、________等;
(2)反应②的化学方程式为 ;
(3)上述流程中,“一种氮肥”的化学式是______________________________。
5.氯化亚铜(CuCl)广泛应用于冶金、电渡、医药等行业。已知CuCl难溶于水和乙醇,在潮湿空气中易变质。CuCl的制备流程如下:
(1)“滤液”1中除了Na+、SO外。还存在较多的离子是______、______。(写离子符号)
(2)“反应”中发生的化学反应是2CuCl2+Na2SO3=== 2CuCl↓+2NaCl+SO3。产生的SO3迅速与水化合生成一种酸,该反应的化学方程式为____________________________。
(3)“操作a”的名称是________。本流程中可循环利用的物质(水除外)是________。(写化学式)
(4)可用“水洗”的原因是 。
“醇洗”的目的是 。
6.2019年5月1日晚,橘子洲景区燃放《沁园春•夏之恋》主题焰火,吸引超30万游客市民现场观看。欣赏绚丽的烟花同时,我们也关注到燃放烟花会产生SO2,某石膏板企业用“碱-石灰-石膏(CaSO4•2H2O)”
的方法可吸二氧化硫将其转化为石膏,其流程如图:
(1)二氧化硫直接排放到空气中易形成 ,会污染、破坏环境;
(2)在实验室中进行操作a用到的玻璃仪器有漏斗、烧杯和 ;
(3)生产流程中生成的 可循环利用,节约成本。
7.工业上常利用石灰浆[主要成分为Ca(OH)2]制备化工原料KClO3和超细CaCO3。制备KClO3的流程如图所示:
已知:①反应1为6Cl2+6Ca(OH)2=Ca(ClO3)2+5CaCl2+6H2O。
②有关物质在常温下的溶解度如下表所示:
物质
Ca(ClO3)2
CaCl2
KClO3
KCl
溶解度/g
209.0
74.5
7.3
34.2
(1)操作a的名称是___________。
(2)若反应2为复分解反应,则溶液A中一定含有的溶质为CaCl2和_________(填化学式)。
(3)洗涤KClO3晶体时,最好选用下列的_________(填字母代号)作洗涤剂。
A.KCl饱和溶液 B.水 C.饱和KClO3溶液
8.碳酸钡是一种重要的化工产品,某厂用含二氧化硅杂质的碳酸钡原料生产碳酸钡产品,采用以下的工艺流程:
(1)流程中加入过量的盐酸,其目的是 。
(2)溶液A的溶质中,一定存在的物质是 。
(3)操作3包括的两个操作是___________________________。
9.电石是一种重要的化工原料,极易与水反应:CaC2+2H2O=Ca(OH)2+C2H2↑。
将电石长期露置于空气中,会发生变化:电石(CaC2)灰浆残渣。
(1)残渣的主要成分是Ca(OH)2和 (填化学式)。
(2)工业上利用电石制备某化工原料的流程如下图所示(注:加入NH4Cl溶液的目的是溶解残渣中的难溶性盐):
[来源:Zxxk.Com]
①流程中溶液A可循环使用,溶液A中的主要成分的化学式是 。
②检验沉淀是否洗涤干净:取最后一次洗涤液少量于试管中,加入适量的 溶液,若无沉淀产生,则证明已洗涤干净。
10.工业制硫酸得到的废渣的主要化学成分为SiO2、Fe2O3、Al2O3。用该废渣制取药用辅料——氧化铁(Fe2O3)的工艺流程如下图(部分操作和条件略):
【查阅资料】①SiO2和C加热时很难反应,SiO2不与稀硫酸反应;
②碳在高温下很难还原氧化铝;
③有关金属离子形成氢氧化物沉淀时的pH如下表:
离子
开始沉淀时的pH
完全沉淀的pH
Fe3+
1.5
3.7
Al3+
3.4
5.2
Fe2+
6.5
9.7
(1)上述流程中步骤①焙烧过程有可能产生两种有毒气体,它们是 (填化学式);
(2)上述流程中步骤③的目的是 ;
(3)上述流程中步骤④的操作名称是 。
11.中国首款完全自主知识产权民用客机C919飞机的钛合金用量达9.3% 。工业上利用钛白粉制备海绵钛的工艺流程如下:
(1)钛白粉主要成分为TiO2,TiO2中钛元素的化合价为 。
(2)反应Ⅲ属于基本反应类型中的 反应。
(3)反应Ⅱ需在氩气环境中进行,理由是 。
类型四 金属和金属矿物资源的利用
【精选习题】
1.钛和钛合金被认为是21世纪的重要金属材料,被广泛用于火箭、导弹、航天飞机、船舶等,如图为某化工企业生产钛流程示意图:
请回答下列问题:
(1)FeTiO3中钛元素的化合价为________;
(2)②中CO和H2以化学计量数1∶2恰好完全反应,则该反应的基本反应类型是______________;
(3)③中氩气的作用是________,该反应的化学方程式是______________________________。
2.BaCl2是一种可溶性有毒重金属盐,广泛应用于化工领域。用毒重石(主要成分为BaCO3,杂质不溶于水且不与盐酸反应)制备氯化钡晶体的工艺流程如下:
(1)气体X的化学式是__________;
(2)下列有关此工艺流程的判断中,不正确的是________(填字母);
A.毒重石加盐酸前先粉碎的目的是增大接触面积,加快反应速率
B.操作Y的名称是过滤
C.洗涤氯化钡晶体的洗涤剂选择,水比饱和BaCl2溶液更好
(3)滤渣水洗液及滤液2循环利用的目的是________________________________。
3.为了从含铜、银、锰三种金属的混合粉末中分离出贵金属,并获得一种盐晶体,现将三种金属随意编号为:A、B、C,并设计了如下流程:
(1)请写出上述流程中无色气体的一种用途 。
(2)操作 a 的名称是 。
(3)A、B、C 三种金属的活动性由强到弱的顺序为 (用元素符号填空)。
4.某化工厂排出的废液中主要含 Zn(NO3)2和AgNO3等物质,为了从中回收金属银和硝酸锌,博才中学
化学课外活动小组,设计了以下的实验步骤:
(1)操作1的名称是: ;
(2)加入过量的X物质是 ;(写化学式)
(3)滤液C中溶质的成分是 。
5.黄铜渣中约含Zn 7%、ZnO 31%、Cu 50%、CuO 5%,其余为杂质。处理黄铜渣可得到铜和硫酸锌,其主要流程如下(杂质不溶于水、不参与反应):
已知:⑴2Zn + O2 2ZnO ⑵ZnO + H2SO4 = ZnSO4 + H2O
(1)操作Y要用到的玻璃仪器有烧杯、玻璃棒和 。
(2)加入过量X的目的是 ;
(3)溶液G的溶质为 (写化学式)。
6.如图是氧化沉淀法生产复印用高档Fe3O4粉的工艺流程简图,根据要求回答问题。
(1)操作A的名称______________,副产品P是________。
(2)通空气时的化学方程式:4Fe(OH)2+2H2O+O2=== 4Fe(OH)3,由沉淀M获得Fe3O4过程中发生的反应为Fe(OH)2+2Fe(OH)3==Fe3O4+4H2O。控制“一定量空气”的目的是
。
7.我国每年报废的手机超过1亿部。废旧手机的电路板中含有铝、铁、铜、银、金等多种金属,随意丢弃既会造成资源浪费,也会污染土壤和水体。化学兴趣小组为回收其中的铜,设计并进行了如下实验。
已知:Cu+H2O2+H2SO4=== CuSO4+2H2O;不考虑金、银发生类似反应。
(1)将电路板粉碎成粉末的目的是 。
(2)步骤①所得滤液中的溶质除硫酸外,还有 。
(3)步骤②中的实验现象是:固体部分溶解, 。
(4)步骤④中反应的化学方程式是 。
8.铝和铝合金是一类重要的金属材料、工业上用铝土矿(含有Al2O3和SiO2,不考虑其他杂质)制取金属铝的基本流程如下图所示(已知:①SiO2是一种难溶于水,也不与盐酸、硫酸反应的物质;②铝盐与氨水反应,生成氢氧化铝沉淀和铵盐。)请回答下列问题:
(1)实际操作中先将铝土矿研成粉末,目的是 ;
(2)操作Ⅱ的名称是 ;
(3)滤液Ⅱ中溶质的用途之一是 。
类型五 海水综合利用类
【精选习题】
1.海水是巨大的资源宝库。如图是某工厂对海水资源综合利用的示意图:
(1)分离粗盐和母液的操作名称为________;母液中一定含有的金属元素为________;
(2)下表为氯化钠在不同温度时的溶解度。请结合表中数据回答问题:
温度/℃
30
50
70
100
溶解度/g
36.3
37.0
37.8
39.8
从海水中获取粗盐,宜选用________(选填“蒸发结晶”或“降温结晶”)。
2.海水晒盐得到粗盐,剩余的母液称为苦卤,粗盐和苦卤用途广泛。
(1)为了除去粗盐溶液中的Ca2+、Mg2+、SO2- 4,可按照下列实验步骤进行:①加过量BaCl2溶液 ②加过量NaOH溶液 ③加过量Na2CO3溶液 ④过滤 ⑤加入适量盐酸
其中步骤③加过量Na2CO3溶液的目的是_________________________________________________。
(2)利用苦卤制取镁,主要流程如图:
步骤Ⅱ中的试剂a的名称是___________,步骤Ⅲ是一个分解反应,则该反应的化学方程式是__________
_________________________________。
3.钓鱼岛及其附属海域是我国固有领土,蕴藏着丰富的海洋资源。从海水中制备纯碱和金属镁的流程如图所示,回答下列问题:
(1)由氧化钙得到石灰乳的基本反应类型为 ;
(2)步骤V中所加试剂是 ;
(3)粗盐水中主要含有CaCl2、MgSO4等可溶性杂质,可加入下列物质,利用过滤等操作进行除杂。则加入下列三种物质的先后顺序为 (填序号)。
①适量稀盐酸 ②过量的碳酸钠溶液 ③过量的氢氧化钡溶液
4.海水中有着丰富的化学资源,人们可以从海水中提取出很多的物质,如:氯化钠、镁等。如图就是利用海水提取氯化钠的大致过程:
(1)图中①是________(填“蒸发池”或“冷却池”);
(2)析出晶体后的母液是氯化钠的________(填“饱和溶液”或“不饱和溶液”);
(3)实验室除去粗盐中难溶性杂质的主要实验步骤有:Ⅰ.溶解、Ⅱ.________(填操作名称)、Ⅲ.蒸发[来源:学,科,网Z,X,X,K]
上述三个步骤中,用到的同一种玻璃仪器的名称是________,该玻璃仪器在步骤Ⅱ中的作用是________;
(4)提取粗盐后的母液中含有较多氯化镁,从母液中提取金属镁的过程大致如下:
该过程中反应Ⅰ的基本反应类型是__________________;
写出反应Ⅱ的化学方程式为_____________________________________。
5.从海水中可制备纯碱和金属镁,其流程如图所示。
(1)粗盐提纯时,每步操作都会用到的一种玻璃仪器是 。(填仪器名称)
(2)粗盐水中主要含有CaCl2、MgSO4等可溶性杂质,可加入下列物质:a.适量的盐酸;b.稍过量的Na2CO3溶液;c.稍过量的Ba(OH)2溶液,利用过滤等操作进行除杂,则加入这三种物质的先后顺序为 。(填字母序号)
(3)向饱和的氯化钠溶液中通入氨气和二氧化碳,经过一系列变化,最终可制得纯碱。请写出第Ⅲ步反应的化学方程式 。
(4)第Ⅴ步Mg(OH)2与盐酸的反应________中和反应。(选填“是”或“不是”)
6.海水中含有丰富的镁元素,目前世界上生产的镁60%来自海水。海水晒盐后的母液分离出食盐的海水称作苦卤水,其中含有丰富的MgCl2和NaCl(其它成份在本工艺中不做考虑)。工业上以苦卤水为原料制取金属镁的流程如图:
⑴沉淀槽中发生了两个化学反应,它们的基本反应类型为化合反应和________________。
⑵Y与Z反应的产物溶于水可得X溶液,从而实现了Y的再利用,则Z的化学式为 。
⑶蒸发、烘干后得到的MgCl2固体中可能含有的杂质是 (填化学式)。
[来源:学科网ZXXK]
专题四 工业流程图
参考答案
类型一 除杂、提纯类
【真题回顾】
1.(1)加热
(2)除去氯化钙和过量的氯化钡
(3)不严谨;因为过量的碳酸钾没有除去(或煮沸后的溶液中仍含有碳酸钾)
2.(1)引流 (2)蒸发 (3)CaCl2
【精选习题】
1.(1)过滤 (2)搅拌使受热均匀,防止液体飞溅 (3)BaCl2
2.(1)水 (2)过滤 (3)除去过量的NaOH和Na2CO3
3.(1)MgSO4+Ba(OH)2=== BaSO4↓+ Mg(OH)2↓ 复分解反应
(2) K2CO3 (3) 除去滤液Ⅱ中的氢氧化钾和碳酸钾
4.(1)过滤 用磁铁吸引 (2)铜在金属活动性顺序表中排在氢的后面,不能和硫酸发生置换反应
(3)不产生污染物SO2
5.(1)蒸发结晶 (2)除去过量的BaCl2溶液 (3)不严谨;因为还有Na2CO3未除去
6.(1)过滤 (2)HCl (3)将NaCl中的CaCl2和MgCl2全部除去
类型二 混合物成分确定类
【真题回顾】
1.(1)H2 (2)化合反应 (3)碳、镁、氧化铜(或C、Mg、CuO)
2.(1)漏斗 (2) CaCO3 (3)NaOH 、 KOH 、Ca(OH)2
【精选习题】
1.(1)CO2 (2)Na2SO4 (3)Ba(NO3)2 (4)HNO3、NaNO3、Mg(NO3)2、Ba(NO3)2
2.(1)过滤 (2)氯化铁 (3)稀硝酸;使碳酸钠全部反应,防止对第③步的检验造成干扰。
类型三 新物质制取类
【精选习题】
1.(1)过滤 (2)Fe+H2SO4= FeSO4+H2↑ (3)温度在40 ℃以下 (4)用作氮肥(合理即可)
2.(1)化合反应 (2)过滤 (3)加入少量氢氧化钠是为了使Na2S2O4在碱性溶液中可以稳定存在,加入NaCl是为了使Na2S2O4在水中的溶解度显著下降,便于结晶析出Na2S2O4
3.(1)漏斗 (2)FeSO4和CuSO4 (3)方法Ⅱ
4. (1)氯化钠饱和溶液 (2)N2+3H2 2NH3 (3)NH4Cl
5.(1)Cl- Cu2+ (2)SO3+H2O=== H2SO4 (3)过滤 NaCl (4)CuCl难溶于水,水洗能除去可溶性杂质,保留CuCl;快速除去CuCl表面的水分,防止其在潮湿的空气中变质
6.(1)酸雨 (2)玻璃棒 (3)NaOH
7.(1)过滤 (2)KClO3 (3)C
8.(1)将原料中含有的碳酸钡全部溶解形成氯化钡溶液 (2)KCl、KOH (3)洗涤、干燥
9.(1)CaCO3 (2)NH4Cl (3)AgNO3
10.(1)CO、SO2 (2)将滤液中的Al3+、Fe3+全部沉淀 (3)过滤
11.(1)+4 (2)分解反应
(3)防止Mg与空气中的氧气等物质发生反应(或氩气化学性质稳定,用作保护气)
类型四 金属和金属矿物资源的利用
【精选习题】
1. (1)+4 (2)化合反应 (3)做保护气 2Mg +TiCl4 Ti+ 2MgCl2
2. (1)CO2 (2)C (3)提高产率(或提高原料的利用率)
3.(1)做燃料(冶炼金属等) (2)蒸发结晶 (3)A>B>C
4.(1)过滤 (2)锌 (3)硫酸锌
5.(1)漏斗 (2)将铜从溶液A中置换出来 (3) ZnSO4
6.(1)过滤 硫酸钠(或Na2SO4) (2)控制氢氧化亚铁的转化量[或防上Fe(OH)2全部转化为Fe(OH)3]
7.(1)增大反应物间的接触面积,使反应更充分,加快反应速率
(2)FeSO4和Al2(SO4)3(或硫酸亚铁和硫酸铝)
(3)溶液由无色变为蓝色
(4)Fe+H2SO4=== FeSO4+H2↑
8.(1)增大反应物的接触面积使反应更充分 (2)过滤 (3)作氮肥
类型五 海水综合利用类
【精选习题】
1.(1)过滤 镁(或Mg) (2)蒸发结晶
2.(1)除去Ca2+和过量的BaCl2 (2)稀盐酸 MgCl2 Mg+Cl2↑
3.(1)化合反应 (2)稀盐酸 (3)③②①
4.(1)蒸发池 (2)饱和溶液 (3)过滤 玻璃棒 引流(4)复分解反应 Mg(OH)2+2HCl=== MgCl2+2H2O
5.(1)玻璃棒 (2)c、b、a (3)2NaHCO3 Na2CO3+CO2↑+H2O
6.(1)复分解反应 (2)H2 (3)CaCl2
初中化学中考复习 专题五物质的推断-2020九年级中考化学复习讲义: 这是一份初中化学中考复习 专题五物质的推断-2020九年级中考化学复习讲义,共24页。试卷主要包含了解题思路指导,真题回顾,常考题型分类,以物质中的元素质量比为突破口,以化学反应的特殊现象为突破口,以元素或物质之最为突破口,以典型的基本反应类型为突破口,以典型转化关系为突破口等内容,欢迎下载使用。
初中化学中考复习 专题七化学实验基础-2020九年级中考化学复习讲义: 这是一份初中化学中考复习 专题七化学实验基础-2020九年级中考化学复习讲义,共14页。试卷主要包含了考点分析,真题回顾,常考题型突破等内容,欢迎下载使用。
初中化学中考复习 专题八化学计算-2020九年级中考化学复习讲义: 这是一份初中化学中考复习 专题八化学计算-2020九年级中考化学复习讲义,共7页。试卷主要包含了有关化学式的简单计算,有关溶液的计算,根据化学方程式的简单计算等内容,欢迎下载使用。












