

河北省保定市2020届-2022届高考化学三年模拟(一模)试题汇编-综合、推断、流程题
展开河北省保定市2020届-2022届高考化学三年模拟(一模)试题汇编-综合、推断、流程题
一、工业流程题
1.(2020·河北保定·统考一模)随着电动自行车市场保有量的不断增加,废弃的铅酸蓄电池已变成不容忽视的一种环境污染源,处理不当会加大对大气、水和土壤的污染。用新方案和新工艺处理废旧铅酸蓄电池,可以达到节能减排、防治污染和资源循环利用的目的。一种处理废旧铅酸蓄电池的流程如下:
已知:Ksp(PbSO4)=1.6×10-8和Ksp(PbCO3)=7.4×10-14
回答下列问题:
(1)废旧电池预处理时需要将电池放电完全,这样做的目的是____。
(2)写出铅膏脱硫时的离子方程式____。
(3)传统的铅蓄电池的处理工艺是将电池破碎后,洗涤,干燥,直接送入回转炉熔炼。而该工艺使用纯碱脱硫的显著优点是____。
(4)某同学查阅资料发现:儿童从空气中吸入的铅量是成人吸入量的1.6~1.7倍。为了探讨这个现象,展开了相关探究,他通过取样分析,得到了以下实验数据:
离地面高度
0.8
1.0
1.2
1.4
1.6
1.8
2.0
铅的浓度(μg/cm3)
1.10
0.98
0.91
0.72
0.66
0.54
0.50
①该同学探究的课题名称为____。
②分析以上实验数据,可以得出的结论是___。
③造成此结果的原因可能是____。
(5)在走访调查中,小明同学收集了某铅酸蓄电池处理厂排出的废水样品,为了判断废水中含铅的浓度是否符合排放标准,他设计了如下方案并进行了实验:
上述实验中如果缺少操作M,所测得结果会 ___(填“偏大”、“偏小”、或“无影响”)。
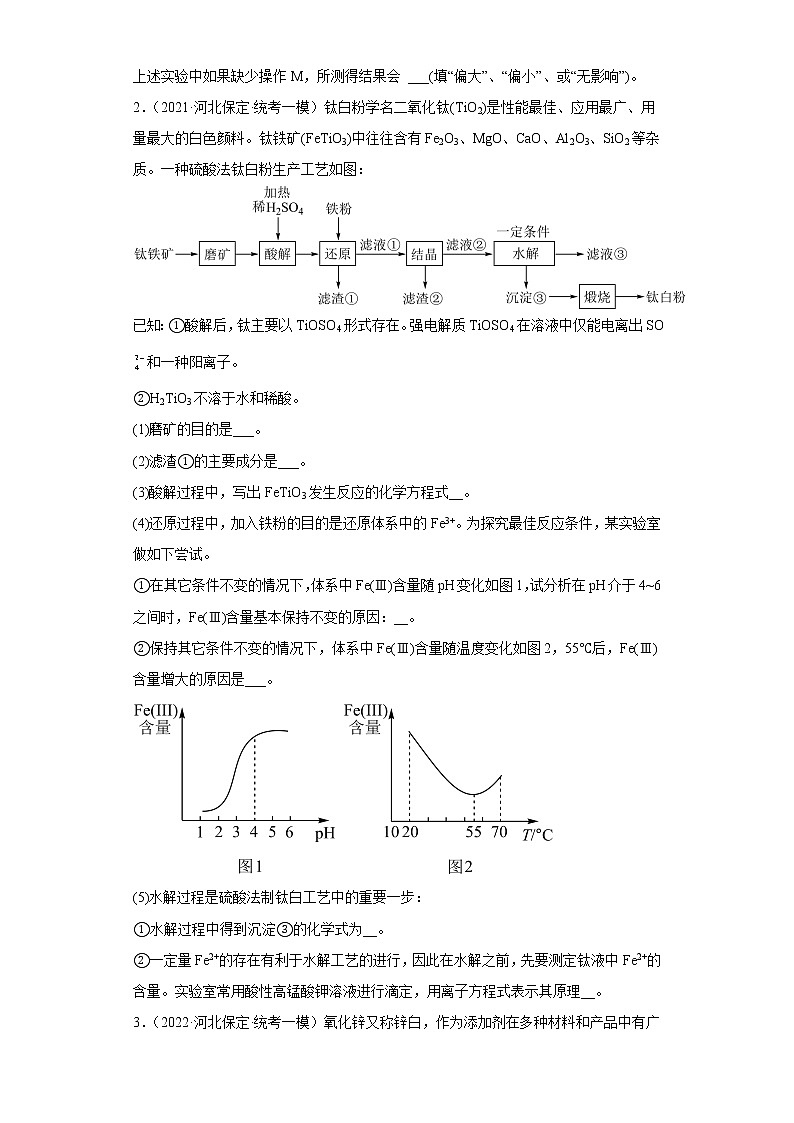
2.(2021·河北保定·统考一模)钛白粉学名二氧化钛(TiO2)是性能最佳、应用最广、用量最大的白色颜料。钛铁矿(FeTiO3)中往往含有Fe2O3、MgO、CaO、Al2O3、SiO2等杂质。一种硫酸法钛白粉生产工艺如图:
已知:①酸解后,钛主要以TiOSO4形式存在。强电解质TiOSO4在溶液中仅能电离出SO和一种阳离子。
②H2TiO3不溶于水和稀酸。
(1)磨矿的目的是___。
(2)滤渣①的主要成分是___。
(3)酸解过程中,写出FeTiO3发生反应的化学方程式__。
(4)还原过程中,加入铁粉的目的是还原体系中的Fe3+。为探究最佳反应条件,某实验室做如下尝试。
①在其它条件不变的情况下,体系中Fe(Ⅲ)含量随pH变化如图1,试分析在pH介于4~6之间时,Fe(Ⅲ)含量基本保持不变的原因:__。
②保持其它条件不变的情况下,体系中Fe(Ⅲ)含量随温度变化如图2,55℃后,Fe(Ⅲ)含量增大的原因是___。
(5)水解过程是硫酸法制钛白工艺中的重要一步:
①水解过程中得到沉淀③的化学式为__。
②一定量Fe2+的存在有利于水解工艺的进行,因此在水解之前,先要测定钛液中Fe2+的含量。实验室常用酸性高锰酸钾溶液进行滴定,用离子方程式表示其原理__。
3.(2022·河北保定·统考一模)氧化锌又称锌白,作为添加剂在多种材料和产品中有广泛应用。一种以锌精矿(主要成分是,还有、,等杂质)为原料制备锌白的工艺流程如下:
已知:25℃时相关物质的如下表:
物质
回答下列问题:
(1)滤渣I的主要成分除过量外,还有S和_______(填化学式)。“浸出”时,氧化的离子方程式为_______。
(2)“沉铁”时,滴加氨水需要调节最低为_______(通常认为残留在溶液中离子浓度时,沉淀完全)。
(3)“萃取,反萃取”时发生的反应是(有机萃取剂),有机萃取剂能分离和,能分离出的原因是_______。为了提高反萃取效率,反萃取剂应该呈_______(填“酸”“碱”或“中”)性。
(4)“深度净化”中加的目的是_______。
(5)①“沉锌”时,充分反应,过滤,洗涤得到碱式碳酸锌[],其反应的离子方程式为_______,检验沉淀洗涤干净的方法是_______。
②为测定碱式碳酸锌[]的组成,称取一定量的碱式碳酸锌,充分加热分解,产生的气体依次通过足量浓硫酸和碱石灰,分别增重0.72g和0.88g,则该碱式碳酸锌的化学式为_______。
二、原理综合题
4.(2020·河北保定·统考一模)CO和H2是工业上最常用的合成气,该合成气的制备方法很多,它们也能合成许多重要的有机物。回答下列问题:
(1)制备该合成气的一种方法是以CH4和H2O为原料,有关反应的能量变化如图所示。
CH4 (g)与H2O(g)反应生成CO(g)和H2 (g)的热化学方程式为____。
(2)工业乙醇也可用CO和H2合成,常含一定量甲醇,各国严禁使用成本低廉的工业酒精勾兑食用酒,但一般定性的方法很难检测出食用酒中的甲醇。有人就用硫酸酸化的橙色K2Cr2O7溶液定量测定混合物中甲醇的含量,甲醇与酸性K2Cr2O7溶液反应生成CO2、Cr2(SO4)3等物质,写出其化学方程式 ___________。
(3)为了检验由CO和H2合成气合成的某有机物M的组成,进行了如下测定:将1.84gM在氧气中充分燃烧,将生成的气体混合物通过足量的碱石灰,碱石灰 增重4. 08 g,又知生成CO2和H2O的物质的量之比为3:4。则M中碳、氢、氧原子个数之比为____。
(4) CO2和H2合成甲醇涉及以下反应:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) ∆H=-49.58kJ/mol。在反应过程中可以在恒压的密闭容器中,充入一定量的CO2和H2,测得不同温度下,体系中CO2的平衡转化率与压强的关系曲线如图所示:
①反应过程中,表明反应达到平衡状态的标志是______;
A.生成3mol O-H键,同时断裂3mol H-H键 B.容器中气体的压强不再变化
C.容器中气体的平均摩尔质量不变 D.CH3OH的浓度不再改变
②比较T1与T2的大小关系:T1 ___T2 (填“<”、“=”或“>”)。
③在T1和P2的条件下,向密闭容器中充入1mol CO2和3mol H2,该反应在第5 min时达到平衡,此时容器的容积为2.4 L,则该反应在此温度下的平衡常数为____,保持T1和此时容器的容积不变,再充入1mol CO2和3mol H2,设达到平衡时CO2的总转化率为a,写出一个能够解出a的方程或式子 ___(不必化简,可以不带单位)。
5.(2021·河北保定·统考一模)SO2具有抗氧化、保鲜、防腐、脱色等功用,合理利用二氧化硫可服务于人们更好的生活。但空气中过量的二氧化硫会形成酸雨、易引起呼吸道疾病等问题,因此,二氧化硫的污染治理是化学研究的重要课题。
(1)“钙基固硫”的原理是燃煤时加入CaCO3或CaO以减少二氧化硫的排放,涉及的反应有:
①CaCO3(s)=CaO(s)+CO2(g)△H1=+178.2kJ·mol-1
②CaO(s)+SO2(g)=CaSO3(s)△H2=-402.0kJ·mol-1
③2CaSO3(s)+O2(g)=2CaSO4(s)△H3=-2314.8kJ·mol-1
则2CaCO3(s)+2SO2(g)+O2(g)=2CaSO4(s)+2CO2(g)△H=___。
(2)石灰石—石膏法是一种常见的“钙基固硫”方法。其中,石灰石的溶解率与脱硫效果有着密切的关系。根据双模理论,可将催化条件下CaCO3吸收SO2宏观反应分为三步:
i.本征反应,即在催化剂作用下,溶解的SO2和Ca2+发生化学反应,且反应在液相中进行,反应速率为RA;
ii.CaCO3由固相溶解进入液相,溶解速率为RB;
iii.SO2由气相扩散进入液相,扩散速率为RC。
温度变化对总反应速率的影响如图,温度在25~45℃时,总反应速率受____(填“RA”、“RB”或“RC”)控制。45~55℃曲线呈下降趋势的原因:一是CaCO3溶解度随温度的升高而降低;二是___。
(3)硝化法既能生产硫酸,也能处理二氧化硫,主要反应为:NO2(g)+SO2(g)SO3(g)+NO(g)△H<0。t℃时,向恒容密闭容器中加入等物质的量的NO2和SO2,达到平衡时NO和NO2的浓度之比为3:1。
①t℃时,该反应的化学平衡常数为___。
②t℃时,向某容器中同时充入NO2、SO2、SO3、NO各1mol,v正___v逆(填“”、“”或“”)
(4)某实验室尝试变废为宝,模仿工业制硫酸工艺利用SO2,方程式为2SO2(g)+O2(g)2SO3(g),在一容积固定为10L的密闭容器中进行该反应,测得如下数据:
实验组
温度(℃)
起始量/mol
平衡量/mol
达到平衡所需时间/h
SO2
O2
SO2
1
250
4
2
0.4
48
2
260
2
1
0.4
16
3
260
a
b
c
t
①通过分析第1组和第2组实验数据,比较两组实验中SO2的化学反应速率,可得到影响该反应速率因素的相关结论为___。
②在第3组的实验中一开始加入了0.5mol的SO3,反应达平衡时c仍为0.4mol,则a=___,b=__。
6.(2022·河北保定·统考一模)氨氧化物是一种主要的大气污染物,甲烷由于廉价易得使其选择还原受到研究工作者的关注。回答下列问题:
(1)利用甲烷催化还原时,发生的反应如下:
当时,甲烷直接将还原为的热化学方程式为,则____。
(2)向总压为100kPa的恒容密闭容器中充入一定量的和,发生反应。在下的平衡转化率随的变化曲线及当时的平衡转化率随(温度的倒数)的变化曲线如图所示。
①表示下,的平衡转化率随的变化曲线为曲线_______(填“Ⅰ”或“Ⅱ”),判断理由是_______。
②T1_______T2(填“>”或“<”);x=_______。
③T3K下,时,平衡时的体积分数为_______;已知:该温度下,反应的标准平衡常数,其中为标准压强,,、、、和为各组分的平衡分压,则该温度下该反应的标准平衡常数_______(物质的量分数)。
(3)用惰性电极电解氧化吸收法可将废气中的转变为硝态氮,电解质溶液为溶液。电解时阳极的电极反应式为_______。
三、有机推断题
7.(2020·河北保定·统考一模)有研究人员在体外实验中发现药物瑞德西韦对新冠病毒有明显抑制作用。E是合成瑞德西韦的中间体,其合成路线如下:
回答下列问题:
(1)W的化学名称为____;反应①的反应类型为____
(2)A中含氧官能团的名称为____。
(3)写出反应⑦的化学方程式_____
(4)满足下列条件的B的同分异构体有____种(不包括立体异构)。
①苯的二取代物且苯环上含有硝基;②可以发生水解反应。
上述同分异构体中核磁共振氢谱为3:2:2的结构简式为____________
(5)有机物中手性碳(已知与4个不同的原子或原子团相连的碳原子称为手性碳)有 ___个。结合题给信息和已学知识,设计由苯甲醇为原料制备的合成路线_______ (无机试剂任选)。
8.(2021·河北保定·统考一模)某维生素的生理功能是维持上皮组织的完整性和细胞膜的通透性,维持正常视觉,促进年幼动物生长等。以下是该维生素的合成路线的一部分。
已知:
(1)A的化学名称为___。
(2)由A生成B的反应类型为___。
(3)写出由C和M生成N的方程式___。
(4)D的结构简式为___。
(5)醛F的结构简式为___。
(6)B中具有 、—OH且不与NaHCO3反应的同分异构体(不包括B,不考虑立体异构)共__种,其中核磁共振氢谱有三组峰,且峰面积比为6:1:1的同分异构体的结构简式为___。在所有的同分异构体(不考虑立体异构)中,含有手性碳原子的异构体有__种。
9.(2022·河北保定·统考一模)李兰娟院士及其团队研究发现药物“阿比多尔”在体外细胞实验中能有效抑制新冠病毒,一种合成阿比多尔中间体M的路线图如下:
已知:-Ac表示。回答下列问题:
(1)A的化学名称是_______,反应②的反应类型是_______。
(2)D中含氧官能团的名称为_______,D与足量加成后的产物中含有_______个手性碳原子(手性碳原子是指连有4个不同的原子或原子团的饱和碳原子)。
(3)E的结构简式为_______。
(4)G→H反应的化学方程式为_______。
(5)满足下列条件的C的同分异构体共有_______种(不考虑立体异构);
①苯环上有两个取代基,其中一个为氨基;②能与溶液反应。
其中,核磁共振氢谱有4种吸收峰,且峰面积之比为3:2:2:2的同分异构体的结构简式为_____。
(6)仿照上述合成路线,设计一种以硝基苯和为原料,制备的合成路线:_______(其他试剂任选)。
参考答案:
1. 将电极材料Pb、PbO2全部转换为PbSO4 PbSO4(s)+CO32-(aq)=PbCO3 (s)+SO42-(aq) 可以减小污染,对环境友好 近地面不同高度空气含铅量的研究 离地面越低,含铅量越高 铅和铅化合物密度大 偏大
【分析】处理铅酸蓄电池过程中,为了达到节能减排、防治污染和资源循环利用的目的,废旧电池的预处理时需要将电池放电完全,将电极材料全部转换为PbSO4,再加入碳酸钠通过沉淀转化为碳酸铅,同时得到产品硫酸钠,
(1)在原电池中,负极上失电子发生氧化反应,正极上得电子发生还原反应,将正负极电极反应式相加即可得电池反应式,根据电池反应判断;
(2)Ksp(PbSO4)=1.6×10-8,Ksp(PbCO3)=7.4×10-14,碳酸铅更难溶,实现了沉淀的转化;
(3)减少硫排放,防治污染环境;
(4)根据所给的图表入手,根据信息,可得出这是一组关于离地面不同高度的空气含铅量不同的研究数据,由数据可得出答案;
(5)实验最后需称量过滤不溶物,所以称量前应将过滤的不溶物烘干,否则不溶物的质量会偏大。
【详解】(1)铅蓄电池的负极反应为:Pb+SO42--2e-=PbSO4,正极反应为:PbO2+4H++SO42-+2e-=PbSO4+2H2O,将正负极电极反应式相加即可得电池反应式,所以电池反应式为Pb+PbO2+2H2SO4 ═2PbSO4+2H2O,废旧电池的预处理时需要将电池放电完全,目的是将电极材料全部转换为PbSO4;
(2)Ksp(PbSO4)=1.6×10-8,Ksp(PbCO3)=7.4×10-14,碳酸铅更难溶,实现了沉淀的转化,铅膏脱硫时的离子方程式:PbSO4+CO32-=SO42-+PbCO3;
(3)使用纯碱脱硫的显著优点是可以减小污染,对环境友好;
(4)①所给的图表可知,离地面高度越高,空气含铅量越低.可以得出的结果,离地面越低,含铅量越高.进而可知课题名称应为近地面不同高度空气含铅量的研究;
②分析以上实验数据,因为离地面越低,含铅量越高,说明铅和铅化合物密度大;
③由所给的图表可知,离地面高度越高,空气含铅量越低;因为离地面越低,含铅量越高,说明铅和铅化合物密度大;
(5)由实验步骤可知,需在烧杯中处理废水,将废水中的铅转化为沉淀,并进行过滤,洗涤烘干,称量含铅沉淀,实验最后需称量过滤洗涤后不溶物,所以称量前应将过滤洗涤后的不溶物烘干,否则含铅不溶物的质量会偏大,测得废水中铅的含量偏高。
2. 增大接触面积,加快反应速率,提高酸浸时的浸出率 二氧化硅 FeTiO3+2H2SO4═FeSO4+TiOSO4+2H2O 在pH介于4~6之间时,铁离子的基本水解完全 随温度的升高,溶液中亚铁离子氧化生成铁离子 H2TiO3 MnO+5Fe2++8H+═Mn2++5Fe3++4H2O
【分析】钛铁矿的主要成分为FeTiO3(可表示为FeO•TiO2),含有Fe2O3、MgO、CaO、Al2O3、SiO2等杂质,在加热条件下钛铁矿和稀硫酸混合,发生的反应有FeTiO3+2H2SO4═FeSO4+TiOSO4+2H2O、Fe2O3+3H2SO4═Fe2(SO4)3+3H2O等,浸取液中含有Fe3+、Mg2+、Ca2+、Al3+,加入铁粉,Fe3+能和Fe反应生成Fe2+,然后过滤,滤渣①的主要成分是二氧化硅,滤液①结晶过滤得到的晶体成分滤渣②为硫酸亚铁晶体,滤液②中TiOSO4能发生水解反应生成沉淀③H2TiO3和滤液③H2SO4,最后高温煅烧沉淀③得到TiO2。
【详解】(1)磨矿的目的是增大接触面积,加快反应速率,提高酸浸时的浸出率。故答案为增大接触面积,加快反应速率,提高酸浸时的浸出率;
(2)二氧化硅不与酸和水反应,滤渣①的主要成分是二氧化硅。故答案为:二氧化硅;
(3)酸解过程中,FeTiO3发生反应生成FeSO4、TiOSO4、2H2O,化学方程式FeTiO3+2H2SO4═FeSO4+TiOSO4+2H2O。故答案为:FeTiO3+2H2SO4═FeSO4+TiOSO4+2H2O;
(4)①在其它条件不变的情况下,体系中Fe(Ⅲ)含量随pH变化如图1,试分析在pH介于4~6之间时,Fe(Ⅲ)含量基本保持不变的原因:在pH介于4~6之间时,铁离子的基本水解完全。故答案为:在pH介于4~6之间时,铁离子的基本水解完全;
②如图2,55℃后,Fe(Ⅲ)含量增大的原因是随温度的升高,溶液中亚铁离子氧化生成铁离子,温度升高,氧化速度加快。故答案为:随温度的升高,溶液中亚铁离子氧化生成铁离子;
(5)①滤液②中TiOSO4能发生水解反应生成沉淀③H2TiO3和滤液③H2SO4,TiO2++2H2O=2H++H2TiO3↓,水解过程中得到沉淀③的化学式为H2TiO3。故答案为:H2TiO3;
②一定量Fe2+的存在有利于水解工艺的进行,因此在水解之前,先要测定钛液中Fe2+的含量。实验室常用酸性高锰酸钾溶液进行滴定,用离子方程式表示其原理MnO+5Fe2++8H+═Mn2++5Fe3++4H2O。故答案为:MnO+5Fe2++8H+═Mn2++5Fe3++4H2O。
3.(1)
(2)3
(3) 与水互不相溶,且在中溶解程度比在水中更大 酸
(4)将转化为除去
(5) 取最后一次洗涤液少量于试管中,滴加盐酸酸化的溶液,不产生白色沉淀
【详解】(1)“浸出”时,将转化为和S,将、、转化为、、等,滤渣Ⅰ的主要成分除过量外,还有S和。氧化的离子方程式为。
(2)“沉铁”时,转化为沉淀,完全沉淀的,故滴加氨水需要调节最低为3。
(3)“萃取”过程中,转移到有机相中的原因是与水互不相溶,在中溶解程度比在水中更大。“反萃取”过程中平衡逆移,为了提高反萃取效率,反萃取剂应该呈酸性。
(4)“深度净化”中加的目的是将转化为除去。
(5)①“沉锌”时,转化为,其反应的离子方程式为。检验沉淀洗涤干净的方法是取最后一次洗涤液少量于试管中,滴加盐酸酸化的溶液,未产生白色沉淀。
②由题意可知,碱式碳酸锌充分加热分解生成为,为,故,,故碱式碳酸锌的化学式为。
【点睛】本题以锌精矿为原料制备锌白的工艺流程为载体。体现对元素化合物性质和基本概念、基本理论知识的基础性、综合性、创新性、应用性的考查。考查学生的理解与辨析、分析与推测、归纳与论证能力。
4. CH4(g)+H2O(g)=CO(g)+3H2(g) ΔH=+(-p+3n+m)kJ·mol-1 CH3OH+K2Cr2O7+4H2SO4=CO2+K2SO4+Cr2(SO4)3+6H2O 3:8:3 CD < 3
【分析】(1)根据图象书写热化学方程式,结合盖斯定律计算反应热;
(2)结合提供信息,利用氧化还原反应电荷守恒和物料守恒书写方程式;
(3)根据有机物燃烧碳原子守恒、氢原子守恒,以及生成物的比例关系列方程计算M中的碳、氢、氧数目;
(4)①根据平衡状态的特点,以及变量变成不变量时反应达到平衡等分析判断;
②二氧化碳的转化率随温度的升高而降低,据此分析;
③列“三段式”,利用温度不变,平衡常数不变的关系进行解答计算。
【详解】(1)依据三个能量关系图象写出对应的热化学方程式:CO(g)+O2(g)= CO2(g) ΔH1=-m kJ·mol-1;H2(g)+O2(g)=H2O(g) ΔH2=-n kJ·mol-1;CH4(g)+2O2(g)=CO2(g)+ 2H2O(g)ΔH3=-p kJ·mol-1;由盖斯定律得:CH4(g)+H2O(g)=CO(g)+3H2(g)ΔH=ΔH3-3ΔH2-ΔH1=+(-p+3×n+m)kJ·mol-1;
(2)甲醇与酸性K2Cr2O7溶液反应生成CO2、Cr2(SO4)3,Cr的化合价降低3,碳的化合价升高6,根据电荷守恒,物料守恒可得CH3OH+K2Cr2O7+4H2SO4=CO2+K2SO4+Cr2(SO4)3+6H2O;
(3)根据1.84g M中含Cx mol,含H y mol,据题意有,解得x=0.06 y=0.16;则1.84g M中含氧物质的量z= =0.06 mol,1mol M中含C、H、O分别为3、8、3,则M中碳、氢、氧原子个数之比为3:8:3;
(4)①A.断裂3 mol H—H键就意味着消耗了3molH2,CH3OH和H2O中均有H—O键,即反应生成了3mol O-H键,均表明正反应速率的变化关系,所以不能说明v正=v逆,故A错误;
B.由于反应过程中容器的压强一直保持不变,故“压强不再变”的时刻也不能说明v正=v逆,故B错误;
C.容器中反应物、生成物均为气体,气体总质量m一直保持不变,但反应前后气体物质的量差△n≠0,即只有当反应达到平衡状态时,体系的总物质的量n才不再变化,故由M=知“平均摩尔质量不变”能够表明反应达到平衡状态,故C正确;
D.“CH3OH的浓度不再改变”表明,单位时间内生成和消耗的CH3OH的浓度相等,即v正=v逆,反应达到平衡状态,故D正确;
答案选CD;
②由ΔH=-49.58 kJ·mol-1<0,知正反应为放热反应,在同一压强下,温度升高可使CO2的转化率降低,再由图象可知T1<T2;
③由图1知,在T1和p2的条件下,平衡时CO2的转化率为60%。消耗的CO2为1mol ×60%=0.6 mol,故有如下关系:
结合容器的体积(2.4L)有,平衡体系中各物质的浓度为c(CO2)=mol·L-1,c(H2)=mol·L-1,c(CH3OH)=mol·L-1,c(H2O)=mol·L-1,则该条件下的平衡常数为;由于再充入原料气时,反应温度没变,即K不变。设达到平衡时CO2的总转化率为a,则整个过程中反应的CO2为2a mol,同理有如下关系:
。
5. -2762.4 kJ·mol-1 RA 二氧化硫溶解度随温度升高而降低 9 > 温度升高,反应速率增大 1.5 0.75
【详解】(1) ①CaCO3(s)=CaO(s)+CO2(g)△H1=+178.2kJ·mol-1②CaO(s)+SO2(g)=CaSO3(s)△H2=-402.0kJ·mol-1③2CaSO3(s)+O2(g)=2CaSO4(s)△H3=-2314.8kJ·mol-1,根据盖斯定律,△H=2×①+2×②+③=2×178.2-2×402-2314.8=-2762.4 kJ·mol-1;
(2)在较低温度中升高温度对反应速率影响较大,故温度在25~45℃时,总反应速率受RA控制;温度继续升高,会影响溶解度,则45~55℃曲线呈下降趋势的原因:一是CaCO3溶解度随温度的升高而降低;二是二氧化硫溶解度随温度升高而降低;
(3)①根据已知条件列出三段式,设加入二氧化氮和二氧化硫为1,反应消耗为x,,达到平衡时NO和NO2的浓度之比为3:1,即,解得x=0.75,平衡常数;
②,故平衡正向移动,v正>v逆;
(4)①,,故,由此得出结论,温度升高,反应速率增大;
②平衡常数受温度影响,2、3组温度一样,反应后C仍为0.4,为等效平衡,极值转化后与第二组起始量相同,第二组起始量为2,1,0,第三组为a,b,0.5,故a+0.5=2,b+0.25=1,即a=1.5,b=0.75;
6.(1)
(2) Ⅱ 温度一定,越大,的转化率越小 > 1 20% 4
(3)
【解析】(1)
由盖斯定律可知,==,故答案为:。
(2)
①由图可知,下,越大,的转化率越小,故曲线Ⅱ表示的转化率随的变化,故答案为:Ⅱ;温度一定,越大,的转化率越小。
②由于,则越大,的转化率越大,则曲线Ⅰ表示的转化率随的变化,故;曲线Ⅰ中,下的平衡转化率与曲线Ⅱ中时的平衡转化率相同,故,故答案为:>;1。
③下,时,总压为100kPa,的转化率为80%,设起始时NO和CH4的物质的量均为1mol,列出三段式,
平衡时气体总物质的量为:(0.8+0.2+0.4+0.2+0.4)mol=2mol,平衡时、、、和分别为40kPa、10kPa、10kPa、20kPa和20kPa,故的体积分数为;
时该反应的标准平衡常数,故答案为:20%;4。
(3)
电解池中阳极发生氧化反应,由题给信息可知,在碱性条件下转变为硝态氮,氮元素化合价升高,发生氧化反应,则阳极的电极反应式为,故答案为:。
7. 氨基乙酸 取代反应 硝基和羟基 + +H2O 8 2
【分析】根据流程图,A()和发生取代反应生成B(),B和磷酸在加热条件下发生取代生成C,C在一定条件下转化为,中的一个氯原子被取代转化为D;X与HCN发生加成反应生成Y,Y和氨气在一定条件下发生取代反应生成Z,Z在酸性条件下水解得到W,D和R在一定条件下反应生成E,根据E和D的结构简式,可推出R的结构简式为,由此可知W和在浓硫酸加热条件下发生酯化反应生成R,据此分析解答。
【详解】(1)W的结构简式为,结构中有羧基和氨基,化学名称为氨基乙酸;根据分析,反应①为A()和发生取代反应生成B(),反应类型为取代反应;
(2)A的结构简式为,含氧官能团的名称为硝基和羟基;
(3)根据分析,反应⑦为W和在浓硫酸加热条件下发生酯化反应生成R,R的结构简式为,化学方程式+ +H2O;
(4)B的结构简式为,①苯的二取代物且苯环上含有硝基;②可以发生水解反应,说明另一个取代基为酯基,该酯基的结构可为-OOCCH3或-COOCH3或-CH2OOCH,在苯环上与硝基分别有邻间对三种位置,分别为:、、、、、、、、,除去自身外结构外,共有8种; 上述同分异构体中核磁共振氢谱为3:2:2,说明分子中含有三种不同环境的氢原子且个数比为3:2:2,则符合要求的结构简式为 ;
(5)已知与4个不同的原子或原子团相连的碳原子称为手性碳,有机物中手性碳的位置为,有2个;的水解产物为,的结构中的-COOH可由-CN酸性条件下水解得到,而与HCN发生加成反应可生成,再结合苯甲醇催化氧化可得到苯甲醛,则合成路线为:。
8. 甲醛 加成反应 + 7 4
【分析】根据题中所给信息和A的分子式为CH2O,可推知A的结构简式为HCHO,HCHO和 发生加成反应生成B,B的结构简式为 ,B在酸性条件下脱水,生成C,C的结构简式为 ,C和发生已知所给的反应生成N,N的结构简式为 ,N水解生成D,D的结构简式为 ,D在H2SO4条件下发生重排,生成 ,由 和 逆推醇G的结构简式为 ,逆推醛F的结构简式为 ,据此解答。
【详解】(1)由上分析可知,A的结构简式为HCHO,名称为甲醛;答案为甲醛。
(2)由上分析可知,A的结构简式为HCHO,B的结构简式为 ,HCHO和 发生加成反应生成B;答案为加成反应。
(3)C的结构简式为 ,N的结构简式为 ,由C和M生成N的方程式为+;答案为+。
(4)由上分析可知,D的结构简式为 ;答案为 。
(5)由上分析可知,醛F的结构简式为 ;答案为 。
(6)B中具有 、—OH且不与NaHCO3反应,即不含羧基的同分异构体(不考虑B)有 、 、 、 、 、、 共7种,其中核磁共振氢谱有三组峰,且峰面积比为6:1:1的同分异构体的结构简式为 ,在所有的同分异构体(不考虑立体异构)中,含有手性碳原子的异构体有(标有“*”为手性C原子) 、 、 、 共4种;答案为7; ;4。
9.(1) 对硝基苯酚或4-硝基苯酚 还原反应
(2) 酯基和羰基(或酮基) 5
(3)
(4)+2Br2+2HBr
(5) 11
(6)
【解析】(1)
有机物为,苯酚为母体,硝基为取代基,的名称是:对硝基苯酚或 硝基苯酚,反应是硝基转化为氨基,组成上去氧加氢,属于还原反应,故答案为:对硝基苯酚或 硝基苯酚;还原反应
(2)
D中含氧官能团的名称为酯基和羰基(或酮基),D与足量加成后的产物为,其中标“*”的为手性碳原子;故答案为:酯基和羰基(或酮基),5
(3)
E的结构简式为。
(4)
G→H反应为 与溴发生取代反应生成,反应的化学方程式为 +。
(5)
满足条件的C的同分异构体中苯环上的基团为、、、,邻、间、对三种位置异构,共有11种;其中,核磁共振氢谱有4种吸收峰,且峰面积之比为3∶2∶2∶2的同分异构体的结构简式为。
(6)
仿照上述合成路线,以硝基苯和为原料,制备的合成路线:。
【点睛】本题以医药“阿比多尔”中间体的合成为载体,体现对有机化合物的制备、物质结构、反应类型、官能团名称、结构简式和合成路线等有机化学知识的基础性、综合性、应用性和创新性的考查。考查学生的理解与辨析、分析与推测、归纳与论证能力。
河北省唐山市2020届-2022届高考化学三年模拟(二模)试题汇编-综合、推断、流程题: 这是一份河北省唐山市2020届-2022届高考化学三年模拟(二模)试题汇编-综合、推断、流程题,共22页。试卷主要包含了工业流程题,原理综合题,有机推断题等内容,欢迎下载使用。
河北省邯郸市2020届-2022届高考化学三年模拟(二模)试题汇编-综合、推断、流程题: 这是一份河北省邯郸市2020届-2022届高考化学三年模拟(二模)试题汇编-综合、推断、流程题,共25页。试卷主要包含了工业流程题,原理综合题,有机推断题等内容,欢迎下载使用。
河北省保定市2020届-2022届高考化学三年模拟(二模)试题汇编-综合、推断、流程题: 这是一份河北省保定市2020届-2022届高考化学三年模拟(二模)试题汇编-综合、推断、流程题,共25页。试卷主要包含了工业流程题,原理综合题,有机推断题等内容,欢迎下载使用。












