



2023高三二轮复习化学(老高考)专题四 元素及其化合物课件PPT
展开高考命题1 元素及其化合物在生产、生活中的应用
要点 常见无机物的性质与用途或注意事项对应关系归纳
题组❶ 元素及其化合物在生产、生活中的应用
1.[2021·湖南化学]下列说法正确的是( )
解析:糖类分为单糖、二糖和多糖,其中属于多糖的淀粉、纤维素的相对分子质量上万,属于天然高分子化合物,蛋白质也属于天然有机高分子化合物,而单糖和二糖相对分子质量较小,不属于天然高分子化合物,A错误;氧化亚铁具有较强的还原性,在空气中受热容易被氧气氧化为稳定的四氧化三铁,B正确;二氧化硫除了具有漂白作用,可漂白纸浆、毛和丝等,还可用于杀菌消毒,例如,在葡萄酒酿制过程中可适当添加二氧化硫,起到杀菌、抗氧化作用,C错误;镀锌的铁皮镀层破损后构成原电池,锌作负极,铁作正极被保护,铁皮不易被腐蚀,D错误。
2.(双选)[2022·海南化学]NaClO溶液具有漂白能力,已知25 ℃时,Ka(HClO)=4.0×10-8。下列关于NaClO溶液说法正确的是( )
3.[2021·河北化学]硫和氮及其化合物对人类生存和社会发展意义重大,但硫氧化物和氮氧化物造成的环境问题也日益受到关注,下列说法正确的是( )
解析:NO2是红棕色且有刺激性气味的气体,而SO2是无色有刺激性气味的气体,A错误;汽车尾气的主要大气污染物为C与N的氧化物,如NOx和CO等,B错误;氮的固定是指将游离态的氮元素转化为化合态,且植物可吸收土壤中的铵根离子或硝酸根离子,不能直接吸收空气中的氮氧化物,C错误;工业废气中的SO2可采用石灰法进行脱除,如将废气通入石灰乳均可进行脱硫处理,D正确。
题组❷ 元素及其化合物的工业生产
4.[2022·浙江6月选考]下列说法正确的是( )
解析:A.六水合氯化镁中没有自由移动的离子,不能导电,工业上通过电解熔融的无水氯化镁制取金属镁,A不正确;B.接触法制硫酸时,煅烧黄铁矿只能得到二氧化硫,二氧化硫在接触室经催化氧化才能转化为三氧化硫,B不正确;C.在常温下铁与浓硝酸发生钝化反应,在铁表面生成一层致密的氧化物薄膜并阻止反应继续发生,所以可用铁质容器贮运浓硝酸,C不正确;D.“洁厕灵”(主要成分为盐酸)和“84消毒液”(主要成分为次氯酸钠)不能混用,若两者混用会发生归中反应生成氯气,不仅达不到各自预期的作用效果,还会污染环境,D正确。
5.[2021·福建化学]明代《徐光启手迹》记载了制备硝酸的方法,其主要流程(部分产物已省略)如下:
H2SO4 HNO3
下列说法错误的是( )
解析:据图可知FeSO4分解时生成SO2和SO3,部分S元素被还原,则Fe元素应被氧化,X为Fe2O3,A错误;H2SO4与KNO3在蒸馏条件下生成HNO3和K2SO4,为复分解反应,B正确;H2SO4与KNO3混合后,蒸馏过程中生成HNO3,说明HNO3的沸点比H2SO4的低,C正确;硫酸、硝酸均可以和铁反应,所以制备使用的铁锅易损坏,D正确。
6.[2022·浙江1月选考]下列说法正确的是( )
解析:I2属于弱氧化剂,与Fe反应生成FeI2,A错误;电解一定浓度的硫酸锌溶液,Zn2+在阴极得电子析出Zn,B正确;石灰沉淀Mg2+生成的沉淀是Mg(OH)2,C错误;SO2通入BaCl2溶液中不能生成BaSO3沉淀,因为H2SO3酸性比HCl弱,该复分解反应不能发生,D错误。
7.[2021·浙江6月选考]下列说法不正确的是( )
解析:铵态氮肥的主要有效成分为铵根离子,草木灰的主要成分为K2CO3,二者混合可以发生反应生成氨气,降低肥效,不能混合施用,A正确;离子交换法可以很大程度地提取海水中的I-,还可以起到富集低浓度I-的作用,可以提高海水中碘的提取率,B正确;电解饱和食盐水可以得到NaOH、H2、Cl2,不能得到Na单质,C错误;将生铁进一步炼制可以减少含碳量,在使用这种钢材时可以减少电化学腐蚀过程,这样的钢材更耐腐蚀,D正确。
高考命题2 元素及其化合物的性质和转化
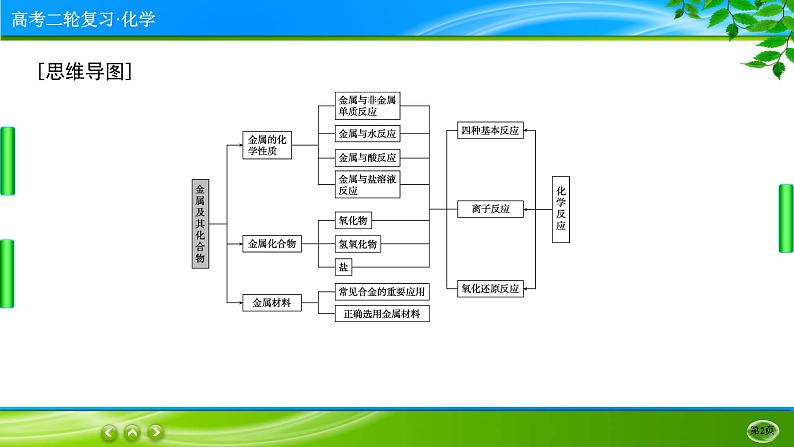
要点❶ 常见金属及其化合物
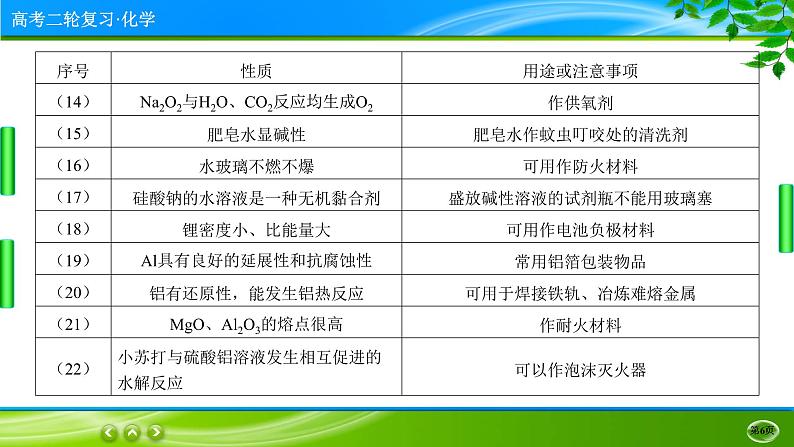
①钠的化合物俗名:火碱、烧碱、苛性钠——NaOH;纯碱、苏打——Na2CO3(纯碱在物质的分类方面的考题中常出现,因其俗名为纯碱,但其不属于碱,而属于盐);小苏打——NaHCO3;芒硝——Na2SO4·10H2O;水玻璃——硅酸钠的水溶液。
③Na2CO3与盐酸反应时,二者相对用量或滴加顺序不同,产生的现象和得到的产物不同。
④不能用Ca(OH)2鉴别Na2CO3和NaHCO3溶液,应选用CaCl2或BaCl2溶液。
⑤除去CO2中的HCl气体,应选用饱和NaHCO3溶液。
⑦鉴别钠元素、钾元素一般利用焰色试验,焰色试验是元素的物理性质。
Li和O2反应只生成Li2O;NaH是离子化合物,是一种强还原剂。Na-K合金常温下呈液态,是原子反应堆的导热剂。
不足量的Na2O2与CO2、H2O(g)混合气体反应时,可以看作Na2O2先与CO2反应。
①要熟记有关“Al”的几个重要反应方程式:
g.2Al2O3(熔融) 4Al+3O2↑(电解制铝)
②铝是活泼金属,但铝抗腐蚀性相当强,因为常温下铝表面能生成一层致密的氧化物薄膜。由于Al2O3的熔点高于Al的熔点,故在酒精灯上加热铝箔直至熔化,发现熔化的铝并不滴落。
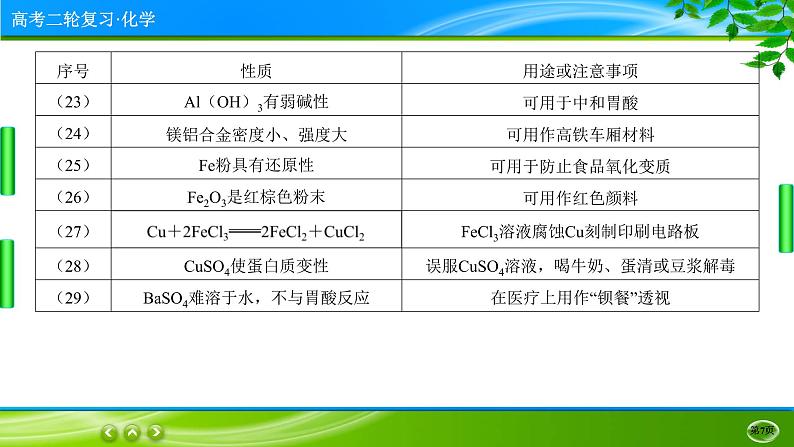
③Al、Al2O3、Al(OH)3均既能与强酸反应,又能与强碱反应。弱酸如碳酸、弱碱如NH3·H2O不能与它们反应。
⑤铝盐与强碱、偏铝酸盐与强酸按不同方式混合产生的现象不同,由反应物的相对用量的差异所致。
⑥铝热反应不仅仅是单质铝与Fe2O3反应,还包含制取其他难熔金属的反应,但不能制备金属性比铝强的金属,如镁等,因为铝热反应本质是利用了铝的强还原性、铝被氧化时放出大量热。铝热剂是混合物。
⑦Al(OH)3可用作抗酸药;明矾常用于净水;泡沫灭火器所用试剂为Al2(SO4)3溶液和NaHCO3溶液。
①Fe与O2、H2O(g)在加热条件下反应的产物都是Fe3O4,而不是Fe2O3。Fe在Cl2中燃烧,无论Cl2过量还是不足均生成FeCl3。Fe与S反应时只能生成FeS。通过上述事实说明Cl2的氧化性强于S的氧化性(或氯元素的非金属性强于硫元素的非金属性)。
②常温下,Fe、Al在冷的浓硫酸或浓硝酸中发生钝化,钝化属于化学变化,但加热后继续反应。
④Fe3+存在的溶液一定呈酸性,因为Fe3+在pH为3.2左右时已经水解完全。
⑤当Fe2+与Fe3+共存时,检验Fe2+的方法是取少许溶液向其中加入酸性高锰酸钾溶液,紫红色褪去;检验Fe3+的方法是取少许溶液,向其中加入KSCN溶液,溶液变为红色。
⑥铁氰化钾法鉴别Fe2+、Fe3+:铁氰化钾化学式为K3[Fe(CN)6],Fe2+能与其反应形成KFe[Fe(CN)6]沉淀(带特征蓝色),而Fe3+则不能。
⑦配制FeCl2溶液要加入Fe粉防氧化;配制FeCl3溶液要加入浓盐酸防止水解。
⑧除去CuCl2溶液中的FeCl2,应先通入Cl2或加入H2O2,将Fe2+氧化为Fe3+,再加入CuO或Cu(OH)2或Cu2(OH)2CO3,使Fe3+水解生成沉淀,过滤除去。
⑨Fe2+、Fe3+的盐溶液蒸干、灼烧,最终得到Fe3+的盐固体或Fe2O3。
①铜在潮湿的空气中最终生成铜绿[Cu2(OH)2CO3]。
②铜及其化合物大多数为有色物质,如Cu:紫红色;CuO:黑色;Cu2S:黑色;CuS:黑色;Cu2O:砖红色;CuSO4·5H2O:蓝色。
④新制Cu(OH)2悬浊液常用来检验醛基,该反应需在碱性环境中进行,加热至沸腾可生成砖红色沉淀氧化亚铜(Cu2O)。
⑥冶炼铜的方法有:a.热还原法;b.湿法炼铜;c.电解精炼铜。
⑦铜合金有:a.青铜(Cu、Sn等);b.黄铜(Cu、Zn等);c.白铜(Cu、Ni等)。
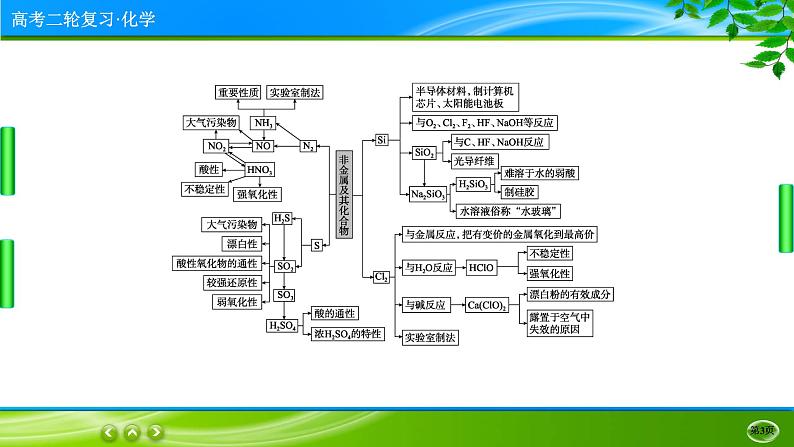
要点❷ 常见非金属及其化合物
(1)碳、硅及其化合物
①Si、SiO2用途易混淆:Si可用作半导体材料、光电池和芯片;SiO2用于制作光导纤维、石英玻璃和光学仪器等。
a.硅酸盐比碳酸盐稳定;b.从化学平衡角度分析可知这两个反应是由高沸点难挥发固体(SiO2)制得低沸点易挥发的气体(CO2)。
⑤水泥、玻璃与陶瓷是三大传统无机非金属材料;碳化硅、氮化硅等是新型无机非金属材料。
①向反应体系中投入1 ml Cl2,转移电子数可能是2NA,也可能是NA[与NaOH、Ca(OH)2反应]或小于NA(与水反应是可逆反应)。
②具有强氧化性的物质不一定具有漂白性。Cl2不具有漂白性,起漂白作用的是HClO。
③Cl2具有强氧化性,但常温下可以储存在钢瓶中。Cl2在点燃条件下与Fe反应,一定将铁氧化为FeCl3,而不是FeCl2,因为Cl2具有强氧化性。
a.强氧化性——作用微粒:Cl2、HClO
氯水中有起漂白作用的HClO,不能用pH试纸测定氯水的pH;氯水与还原剂发生反应并要求书写方程式时一般可只考虑Cl2。
b.强酸性——作用微粒:HCl。
②除去附着在试管内壁上的硫,除了用热的NaOH溶液,还可以用CS2,但不能用酒精。
③物质的褪色与漂白:物质被漂白一定发生了褪色,但物质褪色不一定是漂白,如SO2使品红褪色是漂白,但SO2使酸性高锰酸钾溶液、溴水褪色,则是体现其还原性。
④SO2通入BaCl2溶液无明显现象,原因是H2SO3的酸性比盐酸弱,弱酸不能制取强酸。若继续向溶液中通入NH3、H2S、NO2等气体,可以产生相关的沉淀。
⑤酸的氧化性和氧化性酸:酸的氧化性是指H+的弱氧化性,而氧化性酸是指中心原子具有的强氧化性,如HClO、浓H2SO4、稀硝酸、浓硝酸中的Cl、S、N在反应中体现的强氧化性。
⑥SO2和CO2作为酸性氧化物,性质极其相似,不能从酸性氧化物的角度区分。通常利用SO2的漂白性和强还原性,鉴别SO2和CO2或除去CO2中混有的SO2杂质。
⑦C与浓硫酸反应时,反应产物的确定应按以下流程进行:无水CuSO4确定水→品红溶液确定SO2→酸性KMnO4溶液除去SO2→品红溶液检验SO2是否除尽→澄清石灰水检验CO2。
①氮的固定是指氮元素由游离态变为化合态,故NH3转化为NO、HNO3转化为NO等反应不是氮的固定。
②通常收集气体的方法中,NH3只能用向下排空气法收集;NO只能用排水法收集;NO2只能用向上排空气法收集。
③浓、稀硝酸均具有强氧化性,故与金属反应时都不能生成H2,但二者反应气体产物不同,浓硝酸反应生成的是NO2,稀硝酸反应生成的是NO。根据铜与浓HNO3、稀HNO3反应的剧烈程度差异,说明浓硝酸的氧化性强于稀硝酸,且一般硝酸的浓度越小,还原产物的化合价越低。
④浓HNO3显黄色是因为溶有NO2(HNO3见光或受热分解产生),而工业上制备的盐酸显黄色,是因为溶有Fe3+。
⑥收集NH3时,把一团干燥的棉花放在试管口,以防止与空气对流;收集完毕,尾气处理时,应在试管口放一团用稀硫酸浸湿的棉花,以吸收NH3。
⑦浓盐酸和浓氨水反应有白烟生成,常用于HCl和NH3的相互检验。
⑧NH3、HCl、SO2、NO2可用水进行喷泉实验,水溶性小的气体可用其他溶液(如CO2用NaOH溶液)进行喷泉实验。
题组❶ 元素及其化合物的性质
1.[2022·河北化学]定窑是宋代五大名窑之一,其生产的白瓷闻名于世。下列说法正确的是( )
解析:本题以瓷器为情境,考查物质的组成、性质和转化。传统陶瓷主要成分为硅酸盐,是绝缘材料,A正确,B错误;陶瓷是以黏土及天然矿物为原料,经高温烧结而成,烧制过程中有新物质硅酸盐生成,为化学变化,C错误;白瓷中铁元素含量较少,铁元素含量越多,瓷器颜色一般越深,D错误。
2.[2022·辽宁化学]镀锌铁钉放入棕色的碘水中,溶液褪色;取出铁钉后加入少量漂白粉,溶液恢复棕色;加入CCl4,振荡,静置,液体分层。下列说法正确的是 ( )
解析:本题考查金属的腐蚀与保护。Zn比Fe活泼,更容易失去电子,还原性更强,先与I2发生氧化还原反应,故溶液褪色原因为I2被Zn还原,A错误;液体分层后,I2在CCl4层,CCl4的密度比水大,则下层呈紫红色,B错误;若镀层金属活泼性大于Fe,则Fe不易生锈,反之,若Fe活泼性大于镀层金属,则Fe更易生锈,由于活泼性:Zn>Fe>Sn,则镀锡铁钉更易生锈,C错误;漂白粉的有效成分为Ca(ClO)2,其具有强氧化性,可将I-氧化,D正确。
3.[2022·山东化学]某同学按图示装置进行实验,欲使瓶中少量固体粉末最终消失并得到澄清溶液,下列物质组合不符合要求的是( )
4.[2021·山东化学]下列由实验现象所得结论错误的是( )
5.[2021·河北化学]关于非金属含氧酸及其盐的性质,下列说法正确的是( )
题组❷ 元素及其化合物的转化
6.[2022·江苏化学]氮及其化合物的转化具有重要应用。下列说法不正确的是( )
7.[2021·辽宁化学]含S元素的某钠盐a能发生如图转化。下列说法错误的是( )
A.NO(g) HNO3(aq)
B.稀HNO3(aq) NO2(g)
C.NO(g) N2(g)
解析:NO不溶于水也不与水反应,A错误;稀HNO3与Cu反应得到硝酸铜、水和NO,得不到NO2,B错误;NO有氧化性,CO有还原性,在高温、催化剂条件下二者可发生氧化还原反应转化为无毒的N2和CO2,C正确;O3有强氧化性,不能作还原剂将硝酸根离子还原,D错误。
9.[2021·广东化学]部分含铁物质的分类与相应化合价关系如图所示。下列推断不合理的是 ( )
题组❸ 元素及其化合物性质的探究
10.[2021·北京化学]下列实验中,均产生白色沉淀。
下列分析不正确的是( )
11.[2022·江苏化学]实验室制取少量SO2水溶液并探究其酸性,下列实验装置和操作不能达到实验目的的是 ( )
12.[2022·广东化学]若将铜丝插入热浓硫酸中进行如图(a~d均为浸有相应试液的棉花)所示的探究实验,下列分析正确的是( )
解析:A.铜和浓硫酸反应过程中,生成CuSO4体现出浓硫酸的酸性,生成SO2体现出浓硫酸的强氧化性,故A错误;B.a处的紫色石蕊溶液变红,其原因是SO2溶于水生成了酸,可说明SO2是酸性氧化物,故B正确;C.b处品红溶液褪色,其原因是SO2具有漂白性,而c处酸性高锰酸钾溶液褪色,其原因是SO2和KMnO4发生氧化还原反应,SO2体现出还原性,故C错误;D.实验过程中试管底部出现白色固体,根据元素守恒可知,其成分为无水CuSO4,而非蓝色的CuSO4·5H2O,其原因是浓硫酸体现出吸水性,将反应生成的H2O吸收,故D错误。
13.[2022·湖南化学]为探究FeCl3的性质,进行了如下实验(FeCl3和Na2SO3溶液浓度均为0.1 ml·L-1)。
依据上述实验现象,结论不合理的是( )
A.铁离子的水解反应为吸热反应,加热煮沸可促进水解平衡正向移动,使水解程度加深,生成较多的氢氧化铁,从而使液体显红褐色,故A正确;B.在5 mL FeCl3溶液中滴加2滴同浓度的Na2SO3溶液,根据现象和分析可知,Fe3+既发生了水解反应,生成红褐色的氢氧化铁,又被亚硫酸根离子还原,得到亚铁离子,加入铁氰化钾溶液后,出现特征蓝色沉淀,故B正确;C.实验③中在5 mL Na2SO3溶液中滴加2滴同浓度FeCl3溶液,根据现象和分析可知,仍发生铁离子的水解反应,但未来得及发生铁离子的还原反应,即水解反应比氧化还原反应速率快,故C正确;D.结合三组实验,说明铁离子与亚硫酸根离子混合时,铁离子的水解反应占主导作用,比氧化还原反应的速率快,因证据不足,不能说明亚硫酸离子对铁离子的水解反应无影响,事实上,亚硫酸根离子水解显碱性,可促进铁离子的水解反应,故D错误。
14.[2022·浙江6月选考]亚硝酸钠俗称“工业盐”,其外观、口感与食盐相似,人若误服会中毒。现将适量某样品(成分为亚硝酸钠或氯化钠)溶于水配成溶液,分别取少量该溶液于试管中进行实验。下列方案设计、现象和结论都正确的是( )
解析:A.若样品为NaCl,也会生成白色沉淀,A错误;B.氯化钠电离出的氯离子也可以被酸性高锰酸钾氧化而使其褪色,B错误;C.亚硝酸有氧化性,可以把二价铁氧化为三价铁,溶液变为黄色,C正确;D.稀硝酸可以把亚硫酸根离子氧化为硫酸根离子,加入氯化钡可以生成硫酸钡白色沉淀,D错误。
与非金属有关物质的性质考查
(1)新制氯水中的“三个平衡”
(2)组成微粒——“三分子”“四离子”
(3)新制氯水性质的多样性
(1)SO2与Na2O2、HClO、O3、活性炭漂白原理的比较
③SO2能使溴水、酸性KMnO4溶液褪色,体现了SO2的还原性而不是漂白性。
②SO2不能漂白酸碱指示剂,只能使紫色石蕊溶液变红。
(2)二氧化硫与常见物质反应的现象
4.Na2O2的强氧化性和还原性
从元素化合价角度分析Na2O2的性质
5.“铁三角”及其应用
(2)遇CO2、H2O、H+则发生自身的氧化还原反应。
6.混合溶液中Fe3+、Fe2+的检验
ⅰ.混合溶液 溶液变红色,说明含有Fe3+。
ⅱ.混合溶液 试纸变蓝色,说明含有Fe3+。
ⅰ.混合溶液 酸性KMnO4溶液紫红色褪去,说明含有Fe2+。
ⅱ.混合溶液 溴水褪色,说明含有Fe2+。
ⅲ.混合溶液 生成蓝色沉淀,说明含有Fe2+。
专题(四) 元素及其化合物
1.[2022·上饶联考]某舞蹈诗剧中,舞者生动的还原了北宋名画《千里江山图》,《千里江山图》历经千年,依旧色彩艳丽,璀璨夺目。下列有关《千里江山图》所用的颜料说法正确的是( )
解析:石绿(孔雀石)的主要成分为碱式碳酸铜,故A正确;四氧化三铁具有磁性,“司南柄”的主要成分为四氧化三铁,故B错误;石绿(孔雀石),主要成分为碱式碳酸铜,与盐酸反应,不耐酸的腐蚀,故C错误;朱砂的主要成分是硫化汞,故D错误。
2.[2022·浙江名校联考]下列说法正确的是( )
3.[2022·贵阳监测] 类推的思维方法在化学学习和研究中有时会产生错误的结论,因此类比推出的结论最终要经过实践的检验才能决定其正确与否。下列类推结论中正确的是( )
4.[2022·济宁模拟]已知甲、乙为单质,丙为化合物。不能实现下述转化关系的是( )
甲+乙 丙 丙的溶液 甲
解析:若丙的溶液中滴加NaOH溶液有蓝色沉淀生成,则丙为铜盐,电解时盐中铜离子、阴离子放电,则该铜盐可以是CuCl2等,电解氯化铜溶液生成Cu与氯气,Cu在氯气中燃烧生成氯化铜,符合转化关系,即甲可能为Cu,A正确;若丙的溶液遇Na2CO3产生CO2气体,丙可以为HCl,电解盐酸生成氢气与氯气,氢气在氯气中燃烧生成HCl,符合转化关系,即甲可能为H2,B正确;若丙的溶液中滴加KSCN溶液显红色,则丙中含有Fe3+,电解铁盐溶液不能生成Fe单质,不符合转化关系,C错误;若丙溶于水后得到强碱溶液,丙的溶液可以为NaOH溶液,丙可以为过氧化钠,电解NaOH溶液实质是电解水生成氢气与氧气,钠在氧气中燃烧生成过氧化钠,符合转化题意,D正确。
5.[2022·福建四地市质检]《开宝本草》记载“取钢煅作叶如笏或团,平面磨错令光净,以盐水洒之,于醋瓮中阴处埋之一百日,铁上衣生,铁华成矣”。铁华粉[主要成分为(CH3COO)2Fe·H2O]可用如下方法检测。下列相关说法不正确的是( )
解析:由题中信息可知,制备铁华粉的主要反应方程式正确,A正确;气体X为醋酸蒸气,B错误;加入盐酸,有氢气产生,说明铁华粉中含有铁单质,C正确;由题中实验可知,氢氧根离子能与蓝色沉淀反应生成棕色沉淀,说明有氢氧化铁沉淀生成,说明氢氧根离子结合铁离子的能力强于CN-,D正确。
6.[2022·河北考前模拟]如图是铜及部分含铜粒子的价荷图。下列推断合理的是( )
7.[2022·西城区模拟]某小组探究Cu与H2O2在不同条件下的反应,实验结果如表:
下列说法不正确的是( )
8.[2022·天津联考]“价—类”二维图是学习元素及其化合物知识的重要模型。它是以元素化合价为纵坐标,以物质类别为横坐标的二维平面图像。如图为氯元素的“价—类”二维图。下列叙述不正确的是( )
9.[2021·北京昌平区模拟]某小组利用氯气与NaOH制取 NaClO并探究其性质。
已知:①Ag2SO4:白色固体,微溶于水。
②在水中,Fe3+的存在形式有:[Fe(H2O)4(OH)2]+呈黄色;[Fe(H2O)6]3+呈淡紫色,通常只能观察到无色。
(1)A中反应的离子方程式是 。
(2)一段时间后,NaOH已完全反应,得A中溶液pH=10,用化学用语表示其原因: 。
取所得A中溶液5 mL于试管中,向其中加入稍过量的0.1 ml·L-1 FeSO4溶液和适量H2SO4溶液,观察到无沉淀产生,溶液变为黄色。
(3)甲同学对溶液变黄色可能发生的反应提出下列三种猜想:
乙同学认为猜想2和3不合理,用离子方程式表示原因 。
取Ⅱ中黄色溶液,等分为4份,进行下列操作。
(4)实验ⅰ的现象是 。
答案:(4)红褐色沉淀
解析:(4)黄色溶液中存在Fe3+,加入NaOH溶液生成氢氧化铁红褐色沉淀。
(5)实验ⅱ加入AgNO3出现白色沉淀,不能说明溶液中存在Cl-,原因是 。
解析:(5)银离子能与碳酸根离子、硫酸根离子、氢氧根离子、氯离子等生成白色沉淀,该黄色溶液中含有硫酸根离子,故溶液中加入AgNO3溶液,生成Ag2SO4白色沉淀,不能说明原溶液中有Cl-。
(6)资料表明,氧化性:ClO->Br2>Fe3+>I2。甲同学认为由实验ⅲ的现象证明溶液中仍存在ClO-。乙同学认为甲同学的推断不严谨,设计了能确证溶液中是否存在ClO-的实验方案: 。
答案:(6)取Ⅱ中黄色溶液于试管中,加入NaBr溶液,再加入一定量CCl4溶液,振荡,静置,溶液分层,若下层呈橙红色,证明存在ClO-
解析:(6)氧化性:ClO->Br2,ClO-可以将Br-氧化为Br2,取Ⅱ中黄色溶液于试管中,加入NaBr溶液,再加入一定量CCl4溶液,振荡,静置,溶液分层,若下层呈橙红色,证明存在ClO-。
(7)实验ⅳ中黄色溶液变浅至几乎无色,结合化学用语解释原因 。
10.[2022·河北考前模拟]某实验小组在研究硝酸与铜的反应时,发现稀硝酸和铜反应后的混合液为蓝色,而浓硝酸和铜反应后的混合液为绿色,为此对产生绿色的原因开展探究。按要求完成下列问题:
(1)假设1:
假设2:硝酸铜溶液中溶解了NO2
[实验操作及现象分析]
实验一:向蒸馏水中不断加入硝酸铜晶体,最终配成饱和溶液。配制过程中溶液颜色始终是蓝色,未见绿色出现。
甲同学根据实验一的现象证明了假设1不成立,请补全假设。
答案:(1)硝酸铜溶液颜色与溶液浓度有关
解析:(1)结合实验一操作可知,实验探究的是硝酸铜溶液浓度对溶液颜色的影响,故假设1:硝酸铜溶液颜色与溶液浓度有关。
(2)甲同学在实验一的基础上继续开展了实验二,并初步验证了假设2成立,他的实验操作及现象是 。
乙同学认为假设2不严谨,用以下实验对假设2进行了深入探究。
答案:(2)加热硝酸铜溶液,温度升高,放出红棕色气体,溶液颜色变为蓝色
解析(2)猜想2为硝酸铜溶液中溶解了NO2且甲同学初步验证了假设2成立,则实验设计可以为加热硝酸铜溶液,温度升高,二氧化氮气体溶解度减小而逸出,放出红棕色气体,溶液颜色变为蓝色,说明颜色的变化与溶解了二氧化氮气体有关。
(3)结合实验三,乙同学认为假设2不严谨的证据是 。
答案:(3)向混合溶液中通入氮气会将溶液中溶解的二氧化氮气体带出,而溶液仍保持一段时间绿色
解析(3)实验三向混合溶液中通入氮气会将溶液中溶解的二氧化氮气体带出,而溶液仍保持一段时间绿色,说明绿色的产生不是溶解二氧化氮气体的原因,假设2不严谨。
②金属和浓HNO3的反应一旦发生后速率不断加快,原因是反应过程中有HNO2生成。如Cu和浓HNO3反应,开始生成的NO2溶于水形成HNO2,它再和Cu反应,速率就大大加快。
请依据资料完成以下离子反应方程式。
实验四:乙同学通过以下实验证实了反应过程中有HNO2生成。
(4)乙同学查阅资料发现:
(5)结合化学用语,解释实验3产生该现象的原因 。
新高考化学二轮复习题型分类讲与练专题四 元素及其化合物(含解析): 这是一份新高考化学二轮复习题型分类讲与练专题四 元素及其化合物(含解析),共1页。
高考化学二轮复习专题四元素及其化合物含答案: 这是一份高考化学二轮复习专题四元素及其化合物含答案,共19页。
高考化学二轮复习专题四元素及其化合物含答案: 这是一份高考化学二轮复习专题四元素及其化合物含答案,共19页。












